鑭系收縮
鑭系收縮
鑭系收縮是指鑭系中相鄰元素的半徑之間差值非常小,對於其他周期相鄰元素來說是收縮的,因此被稱之為鑭系收縮。
鑭系元素(離)半徑隨序增減趨勢。屏蔽完,鑭()鑥()隨核荷電子數的逐漸增加,有效核電荷也逐漸增加,引起整個原子體積逐漸縮小。使得銪(Eu)以後的元素離子半徑接近釔(Y),構成性質極相似的釔組元素,彼此在自然界共生,難於分離;同時還使得第三過渡系與第二過渡系的同族元素原子(或離子)半徑相近,如鉿與鋯、鉭與鈮、鎢與鉬等,他們性質上極為相似,也常常共生而難以分離。
鑭系收縮,指鑭系元素左右,半徑減。指,鑭系始六周元素,原子半徑比上面的第五周期的元素的半徑要小,這樣的現象。如,Zr是160,Hf是159。周期表中,從上到下,電子層數逐漸增大,原子半徑應該逐漸增大,但第五周期到第六周期的同族元素,半徑卻很接近,甚至下面的第六周期的還可能更小一點。
歷鑭系,層,導致效核荷增,核吸引增,導致半徑收縮。,質。
這個現象稱為鑭系收縮,但其實並不只發生在鑭系身上。
鑭系元素的原子半徑和離子半徑隨原子序數增大而減小(表1)的現象。從鑭到鑥,原子半徑收縮了15皮米,平均每增加一個核電荷,半徑收縮1皮米。其中銪、鐿半徑明顯大,而鈰略小於鐠。這是由於在鑭系元素的離子中銪、鐿是+2價離子,鈰是+4價離子,其餘是+3價離子。從La到Lu,離子半徑從106.1皮米均勻地降為84.8皮米,這是由於Ln離子結構的變化是由f到f,電子數是均勻改變的。Ln、Ln的離子半徑也是隨原子序數增大而收縮。
鑭系收縮使鑭系元素的性質從鑭到鑥呈現有規律的變化:如金屬標準電極電勢值E°增大,Ln水解傾向增強,Ln(OH)3的鹼性減弱、溶解度減小,對於給定配位體其穩定常數K增大,鹽的水解溫度降低……等(表2)。所有這些均與鑭系元素的離子勢φ=Z/r(Z為化合價,r為離子半徑)逐漸增大有關。價數相同的全部鑭系元素,其化合物的晶形往往也相同。相鄰的兩個鑭系元素的性質極為相似。在自然界中鑭系元素往往是全部或部分共生,鑭系元素相互間分離要比鑭系元素和非鑭系元素分離要困難得多。鑭系收縮使鈧分族中釔的離子Y的最外層電子結構與La等相同,為sp,半徑為88.1皮米,與Ho、Er、Tm相近。釔化合物的性質與鈥、鉺、銩的相應化合物性質相近。鑭系收縮影響鑥以後元素的性質,使第6周期鉿、鉭……的原子半徑分別與第 5周期鋯、鈮……等相同。鉿、鉭……等化合物的性質分別與鋯、鈮……等化合物極為相似。在自然界中鋯與鉿、鈮與鉭、鉑系六種金屬共生,分離相當困難。例如,金屬鋯(Zr,第五周期元素)的原子半徑是1.59Å,而同族的鉿(Hf,第六周期元素)的原子半徑是1.56ÅZr4+的離子半徑是0.79Å,而Hf4+的是0.78Å。儘管原子序數從40增加到72,而相對原子質量從91.22g/mol增加到178.49g/mol,兩個元素的半徑卻十分相近。由於相對原子質量顯著增加,而半徑幾乎不變,使得密度從鋯的6.51g/cm3顯著地增加到鉿的13.35g/cm3。因此,鋯與鉿有著十分相似的化學性質,它們有著十分相似的半徑和電子排布,由於這種相似性,自然界中的鉿總是與鋯共生,而鋯的含量往往要比鉿高得多,這使得鉿的發現比起鋯晚了134年(鋯於1789年被發現,而鉿則在1923年才被人們發現)。性質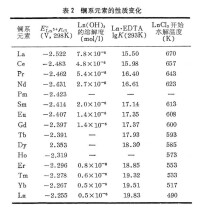 鑭系元素原子半徑隨原子序數的增加總的趨勢是減小。從鑭到鑥,原子序數增加15,而原子半徑卻減小了0.14埃。因為從鈰開始,電子逐個填入內部未滿的4f亞層上,原子的有效核電荷略有增大,對核外電子的吸引也略有增強,故原子半徑逐漸收縮,稱鑭系收縮。結果使過渡元素第五、六周期的同族元素的原子半徑接近,性質相似。周期表第二周期比第一周期多了p區的元素,第三周期的元素與第二周期種類相同,第四周期比第三周期多了d區的元素,第五周期與第四周期的元素種類又相同,第六周期比第五周期多了f區元素,第七周期與第六周期的元素種類又相同。若上下周期元素種類相同,則從上到下,遞變規律很有規律性,若上下周期元素種類突然增加了,往往帶來反常。實際上,都是因為,突然增加了某區元素,核電荷數的增大超過了前面的規律,導致有效核電荷增大的更多,帶來了性質變化規律中的反常。所以,同族元素,從上到下,會有基本規律,但往往在第二周期、第四周期、第六周期元素身上會出現反常。如:1、第二周期的p區元素N、O、F,單鍵鍵能甚至小於第三周期同族元素,第一電子親和能也小於第三周期同族元素,且容易形成氫鍵。2、第四周期As、Se、Br的高價化合物的氧化性要比第三周期同族元素強。3、第六周期Tl、Pb、Bi都出現了惰性電子對效應,其最高正化合價都表現出很強的氧化性。4、Pt、Au、Hg都表現出超常的化學惰性。鑭系元素
鑭系元素原子半徑隨原子序數的增加總的趨勢是減小。從鑭到鑥,原子序數增加15,而原子半徑卻減小了0.14埃。因為從鈰開始,電子逐個填入內部未滿的4f亞層上,原子的有效核電荷略有增大,對核外電子的吸引也略有增強,故原子半徑逐漸收縮,稱鑭系收縮。結果使過渡元素第五、六周期的同族元素的原子半徑接近,性質相似。周期表第二周期比第一周期多了p區的元素,第三周期的元素與第二周期種類相同,第四周期比第三周期多了d區的元素,第五周期與第四周期的元素種類又相同,第六周期比第五周期多了f區元素,第七周期與第六周期的元素種類又相同。若上下周期元素種類相同,則從上到下,遞變規律很有規律性,若上下周期元素種類突然增加了,往往帶來反常。實際上,都是因為,突然增加了某區元素,核電荷數的增大超過了前面的規律,導致有效核電荷增大的更多,帶來了性質變化規律中的反常。所以,同族元素,從上到下,會有基本規律,但往往在第二周期、第四周期、第六周期元素身上會出現反常。如:1、第二周期的p區元素N、O、F,單鍵鍵能甚至小於第三周期同族元素,第一電子親和能也小於第三周期同族元素,且容易形成氫鍵。2、第四周期As、Se、Br的高價化合物的氧化性要比第三周期同族元素強。3、第六周期Tl、Pb、Bi都出現了惰性電子對效應,其最高正化合價都表現出很強的氧化性。4、Pt、Au、Hg都表現出超常的化學惰性。鑭系元素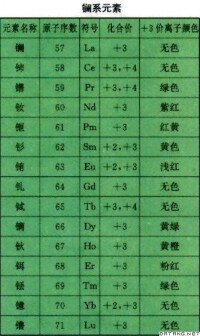 鑭系元素:lanthanide element周期系ⅢB族中原子序數為57~71的15種化學元素的統稱。包括鑭、鈰、鐠、釹、鉕、釤、銪、釓、鋱、鏑、鈥、鉺、銩、鐿、鑥,它們都是稀土元素的成員。鑭系元素通常是銀白色有光澤的金屬,比較軟,有延展性並具有順磁性。鑭系元素的化學性質比較活潑。新切開的有光澤的金屬在空氣中迅速變暗,表面形成一層氧化膜,它並不緊密,會被進一步氧化,金屬加熱至200~400℃生成氧化物。金屬與冷水緩慢作用,與熱水反應劇烈,產生氫氣,溶於酸,不溶於鹼。金屬在 200℃以上在鹵素中劇烈燃燒,在1000℃以上生成氮化物,在室溫時緩慢吸收氫,300℃時迅速生成氫化物。鑭系元素是比鋁還要活潑的強還原劑,在 150~180℃著火。鑭系元素最外層(6S)的電子數不變,都是2。而鑭原子核有57個電荷,從鑭到鑥,核電荷增至71個,使原子半徑和離子半徑逐漸收縮,這種現象稱為鑭系收縮。由於鑭系收縮,這15種元素的化合物的性質很相似,氧化物和氫氧化物在水中溶解度較小、鹼性較強,氯化物、硝酸鹽、硫酸鹽易溶於水,草酸鹽、氟化物、碳酸鹽、磷酸鹽難溶於水。規律理論
鑭系元素:lanthanide element周期系ⅢB族中原子序數為57~71的15種化學元素的統稱。包括鑭、鈰、鐠、釹、鉕、釤、銪、釓、鋱、鏑、鈥、鉺、銩、鐿、鑥,它們都是稀土元素的成員。鑭系元素通常是銀白色有光澤的金屬,比較軟,有延展性並具有順磁性。鑭系元素的化學性質比較活潑。新切開的有光澤的金屬在空氣中迅速變暗,表面形成一層氧化膜,它並不緊密,會被進一步氧化,金屬加熱至200~400℃生成氧化物。金屬與冷水緩慢作用,與熱水反應劇烈,產生氫氣,溶於酸,不溶於鹼。金屬在 200℃以上在鹵素中劇烈燃燒,在1000℃以上生成氮化物,在室溫時緩慢吸收氫,300℃時迅速生成氫化物。鑭系元素是比鋁還要活潑的強還原劑,在 150~180℃著火。鑭系元素最外層(6S)的電子數不變,都是2。而鑭原子核有57個電荷,從鑭到鑥,核電荷增至71個,使原子半徑和離子半徑逐漸收縮,這種現象稱為鑭系收縮。由於鑭系收縮,這15種元素的化合物的性質很相似,氧化物和氫氧化物在水中溶解度較小、鹼性較強,氯化物、硝酸鹽、硫酸鹽易溶於水,草酸鹽、氟化物、碳酸鹽、磷酸鹽難溶於水。規律理論 稀土元素表現出十分豐富的光、電、磁等性質,已被發達國家列為“21世紀戰略元素。”本文所做的主要工作是對稀土鑭系元素的一種重要理化性質做出符合中學生認知水平的理論分析,並進行計算驗證。用德布羅意關係式v=E/h,λ=h/p建立能量與波長成反比的關係,對多電子原子近似能級圖分析后得出,鑭系元素十3價離子4f亞層和5d亞層之間的能級差是造成它們顏色不同的原因。用洪特規則來解釋鑭系元素十3價離子4f亞層的軌道佔有情況,發現在釓以上和以下相對應離子的4 f亞層同時達到穩定的半充滿狀態,前者需要得到的電子數與後者需要失去的電子數是一致的。電子轉移的能量是極為接近的。推理得出相對應離子的波長將處於同一種顏色所對應的波長範圍之內。結合在北京大學稀土材料化學及應用國家重點實驗室的科技實踐活動,應用量子化學計算中的“過渡態方法”,採用該實驗事從荷蘭購買的量子化學計算軟體--密度泛函理論計算程序ADF,進行相關激發能的計算,驗證了理論分析的正確性。通過研究得出結論,鑭系收縮十3價離子的顏色以釓為中心而對稱分佈不是簡單的巧合,而是與它們在4f軌道填充電子的多少及空軌道、全充滿、半充滿三種特殊的狀態有著密切的關係。導致後果一是使釔Y(88pm)在離子半徑的序列中落在鉺Er(88.1pm)的附近,因而在自然界釔常同鑭系元素共生,成為稀土元素的一個成員。二是使鑭系後面各族過渡元素的原子半徑和離子半徑,分別與相應同族上面一個元素的原子半徑和離子半徑極為接近,化學性質相似,結果造成鋯與鉿、鈮與鉭、鉬與鎢這三對元素在分離上的困難。此外,第Ⅷ族中兩排鉑系元素在性質上極為相似,也是鑭系收縮的影響。在鑭系收縮總的趨勢中,銪和鐿反常,這是因為銪和鐿分別有半充滿4f和全充滿4f14的電子層結構的緣故。從La到Lu由於電子結構單調變化使+3價離子半徑做有規律的收縮,結果使鑭系元素化學性質上的微細差異做有規律的遞變。例如,鑭系元素+3價離子的鹼度隨原子序數的遞增而依次減弱,並且與元素的電負性的變化一致。
稀土元素表現出十分豐富的光、電、磁等性質,已被發達國家列為“21世紀戰略元素。”本文所做的主要工作是對稀土鑭系元素的一種重要理化性質做出符合中學生認知水平的理論分析,並進行計算驗證。用德布羅意關係式v=E/h,λ=h/p建立能量與波長成反比的關係,對多電子原子近似能級圖分析后得出,鑭系元素十3價離子4f亞層和5d亞層之間的能級差是造成它們顏色不同的原因。用洪特規則來解釋鑭系元素十3價離子4f亞層的軌道佔有情況,發現在釓以上和以下相對應離子的4 f亞層同時達到穩定的半充滿狀態,前者需要得到的電子數與後者需要失去的電子數是一致的。電子轉移的能量是極為接近的。推理得出相對應離子的波長將處於同一種顏色所對應的波長範圍之內。結合在北京大學稀土材料化學及應用國家重點實驗室的科技實踐活動,應用量子化學計算中的“過渡態方法”,採用該實驗事從荷蘭購買的量子化學計算軟體--密度泛函理論計算程序ADF,進行相關激發能的計算,驗證了理論分析的正確性。通過研究得出結論,鑭系收縮十3價離子的顏色以釓為中心而對稱分佈不是簡單的巧合,而是與它們在4f軌道填充電子的多少及空軌道、全充滿、半充滿三種特殊的狀態有著密切的關係。導致後果一是使釔Y(88pm)在離子半徑的序列中落在鉺Er(88.1pm)的附近,因而在自然界釔常同鑭系元素共生,成為稀土元素的一個成員。二是使鑭系後面各族過渡元素的原子半徑和離子半徑,分別與相應同族上面一個元素的原子半徑和離子半徑極為接近,化學性質相似,結果造成鋯與鉿、鈮與鉭、鉬與鎢這三對元素在分離上的困難。此外,第Ⅷ族中兩排鉑系元素在性質上極為相似,也是鑭系收縮的影響。在鑭系收縮總的趨勢中,銪和鐿反常,這是因為銪和鐿分別有半充滿4f和全充滿4f14的電子層結構的緣故。從La到Lu由於電子結構單調變化使+3價離子半徑做有規律的收縮,結果使鑭系元素化學性質上的微細差異做有規律的遞變。例如,鑭系元素+3價離子的鹼度隨原子序數的遞增而依次減弱,並且與元素的電負性的變化一致。

鑭系收縮

鑭系收縮

鑭系收縮