反應級數
19世紀古德堡提出的基本概念
反應級數是化學里的基本概念,對於特定的化學反應。反應級數被定義為速率方程中各濃度項的冪次之和。反應級數由化學反應機理決定,反應機理描述了反應的各瞬間階段,這些瞬間反應會產生中間物,從而可以控制反應級數。反應級數在探討反應機理的研究中有重要意義。
化學反應的速率方程中各物濃度的指數稱為各物的分級數,所有指數的總和稱為反應總級數,用n表示。如HI合成反應速率方程 為(r為速率,k為速率常數,[ ]代表濃度),表明反應對和的分級數均為1,總級數。反應對級數是由實驗測定的;n可為正、負整數、零或分數。複雜反應,其速率方程不具有簡單的濃度乘積形式者,沒有簡單的級數。
在化學反應的速率方程中,各物濃度項的指數之代數和就稱為該反應的級數(order of reaction),用n表示。
反應速率方程可表示為:反應速率v速率等於速率常數k與反應物濃度的係數次方的乘積(與生成物無關)。
反應物濃度的次方為該反應物的反應級數或分級數,如反應物A的級數是α,反應物D的級數是β,各反應級數的加和α+β就為該反應的反應級數。反應級數越大,表示濃度對反應速率影響越大。
基元反應 有
故對CO是1級反應;對是1級反應;該反應為2級反應。2級反應k 的量綱:。
(鏈式反應機理)對H2 是1級反應,對 是級反應,反應為級反應。
2級反應——反應速率與反應物濃度無關。
4.4.2 零級反應
反應 A → B 是零級反應有:,得:;
相當於 型直線方程;作c — t曲線,得一直線,其斜率的負值是速率常數k,單位是(L·mol-1 )-1 ·s-1
4.4.3 一級反應
半衰期:即反應進行一半所需的時間。T = t1/2是反應物消耗了一半的時間,稱為反應的半衰期。
當時,對於 ,,稱為半衰期, 可由下式求得:
由得:
即有:
4.4.4 二級反應
A → B為二級反應,有,可得即,亦是型直線方程,作圖,則直線斜率為,截距為,k 的單位:(L·mol-1)1·s-1。
4.4.5 三級反應
A → B為三級反應,有即,得:積分得:,可見呈線性關係。k 單位是(L·mol-1)2·s-1。
可見分別以作圖,圖形呈直線時,分別表示反應是零、一、二、三級反應。
一般而言,基元反應中反應物的級數與其計量係數一致;非基元反應則可能不同,其反應級數都是實驗測定的,而且可能因實驗條件改變而發生變化。例如,蔗糖的水解是二級反應,但是當反應體系中水的量很大時,反應前後體系中水的量可認為未改變,則此反應變現為一級反應。
在不同級數的速率方程中,速率常數k的單位不一樣,一般為L·mol·s,n為反應的反應級數。
基元反應和簡單反應的反應級數n可以是整數一、二、三級(只有少數反應為三級),而複雜反應的反應級數n也可以是分數、負數和零級(光化反應、表面催化反應一般是零級)。負數級表示增加該物質的濃度反而使反應速率下降。但反應速率方程不具有簡單的濃度乘積形式者,反應級數的概念就失去了意義。
一級反應
定義:凡是反應速率只與物質濃度的一次方成正比者,稱為一級反應(first order reaction)。
反應的速率方程為:
可以看出,此反應是一個一級反應。
對上式做定積分,,式中c0是初始濃度,c為反應到t時刻的濃度。
由此可知,當反應物消耗一半時,有
可以看出,一級反應的半衰期與反應的速率常數k成反比,而與反應物的起始濃度無關,這也是一級反應的一個特徵。
二級反應
定義:反應速率和物質濃度的二次方成正比者,稱為二級反應(second order reaction)。
其速率方程:
故對CO是1級反應;對NO2是1級反應;該反應為2級反應。2級反應k的量綱:mol·dm·s。
三級反應
定義:反應速率和物質濃度的三次方成正比者,稱為三級反應(third order reaction)。
零級反應
定義:反應速率與物質濃度無關者稱為零級反應(zeroth order reaction)。
反應總級數為零的反應並不多,已知的零級反應中最多的是表面催化反應。例如,氨在金屬鎢上的分解反應:
由於反應只在催化劑表面進行,反應速率只與表面狀態有關。若金屬表面已被吸附的所飽和,再增加NH3的濃度對反應速率不再有影響,此時反應對呈零級反應。
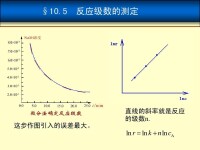
在測定反應級數的實驗中,為了排除產物濃度的干擾,通常是測初速度。為了研究某一反應物濃度與反應速度的函數關係,常常將其他反應物的濃度固定后再確定該反應物的反應級數。
關於微分法。將速率方程取對數 ,則 線性相關,斜率為n。具體步驟為,在曲線上取若干個濃度點,並作切線。計算每點處切線的斜率 ,作 的圖或線性回歸求出n。