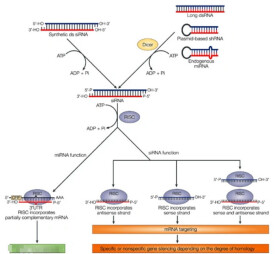
RNA干擾
RNA干擾
RNA干擾(RNA interference, RNAi)是指在進化過程中高度保守的、由雙鏈RNA(double-stranded RNA,dsRNA)誘發的、同源mRNA高效特異性降解的現象。基因沉默,主要有轉錄前水平的基因沉默(TGS)和轉錄后水平的基因沉默(PTGS)兩類:TGS是指由於DNA修飾或染色體異染色質化等原因使基因不能正常轉錄;PTGS是啟動了細胞質內靶mRNA序列特異性的降解機制。有時轉基因會同時導致TGS和PTGS。
由於使用RNAi技術可以特異性剔除或關閉特定基因的表達,(長度超過三十的dsRNA會引起干擾素毒性)所以該技術已被廣泛用於探索基因功能和傳染性疾病及惡性腫瘤的治療領域。
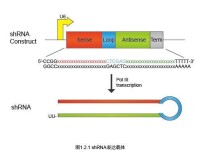
模式圖
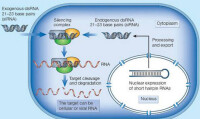
RNA干擾原理圖
1995年,Guo等發現注射正義RNA(sense RNA)和反義RNA均能有效並特異性地抑制秀麗新小桿線蟲par-1基因的表達,該結果不能使用反義RNA技術的理論做出合理解釋。
1998年,Fire等證實Guo等發現的正義RNA抑制同源基因表達的現象是由於體外轉錄製備的RNA中污染了微量dsRNA而引發,並將這一現象命名為RNAi。此後dsRNA介導的RNAi現象陸續發現於真菌、果蠅、擬南芥、錐蟲、水螅、渦蟲、斑馬魚等多種真核生物中,並逐漸證實植物中的轉錄后基因沉默(posttranscriptional gene silencing,PTGS)、共抑制(cosuppression)及RNA介導的病毒抗性、真菌的抑制(quelling)現象均屬於RNAi在不同物種的表現形式。
1999年,Hamilton等首次在PTGS植株中發現了長度為25nt的RNA中間產物。
2000年,Zamore和Hammond等使用體外培養的果蠅細胞進行研究發現,外源性dsRNA通過耗能過程降解成21-23nt的小干擾RNA(small interfering RNA,siRNA)引發RNAi。
2000年,Wianny和Svoboda等分別證實在小鼠胚胎細胞和卵母細胞中dsRNA能引發RNAi效應。
2001年,Elbashir等證實21nt的siRNA可在避免激活dsRNA依賴的蛋白激酶(dsRNA-dependent protein kinase,PKR)和2',5'-寡聚腺苷酸合成酶(2',5'-oligoadenylate synthetase,2',5'-OAS)信號轉導途徑的同時,有效抑制人胚腎293細胞、Hela細胞等哺乳動物細胞中目的基因的表達。
2002年,BrummelKAMP等首次使用小鼠H1啟動子構建了小發卡RNA(small hairpin RNA,shRNA)表達載體pSUPER,並證實轉染該載體可有效、特異性地剔除哺乳動物細胞內目的基因的表達,為利用RNAi技術進行基因治療研究奠定了基礎。
2006年,安德魯•法厄與克雷格•梅洛(Craig C. Mello)由於在RNAi機制研究中的貢獻獲得諾貝爾生理及醫學獎。
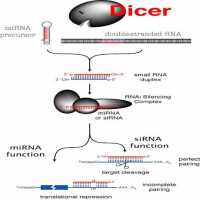
作用機制
懷特黑德生物醫學研究所的本傑明·劉易斯等研究人員發現小RNA能通過阻斷蛋白質合成的方式調控基因表達。他們藉助一個計算模型來確定小RNA和對應的基因,發現了miRNA控制很大一部分生命功能的證據。
研究人員比較了人類和狗、雞、鼠的基因組,對這幾個物種共有的蛋白質合成基因與miRNA尋求對應關係。結果發現,儘管這幾個物種在3.1億年前就開始“分家”各自進化,但它們基因組中受miRNA調控的基因都佔三分之一左右,而且這些基因在進化過程中都得以保存而未發生變化。劉易斯說,隨著更多的基因組數據發布以及實驗技術的進步,還可能發現更多的基因是由小RNA調控的。
RNAi具有的特徵
①RNAi是轉錄后水平的基因沉默機制;
②RNAi具有很高的特異性,只降解與之序列相應的單個內源基因的mRNA;
③RNAi抑制基因表達具有很高的效率,表型可以達到缺失突變體表型的程度,而且相對很少量的dsRNA分子(數量遠遠少於內源mRNA的數量)就能完全抑制相應基因的表達,是以催化放大的方式進行的;
④RNAi抑制基因表達的效應可以穿過細胞界限,在不同細胞間長距離傳遞和維持信號甚至傳播至整個有機體以及可遺傳等特點;
⑤dsRNA不得短於21個鹼基,並且長鏈dsRNA也在細胞內被Dicer酶切割為21 bp左右的siRNA,並由siRNA來介導mRNA切割。而且大於30 bp的dsRNA不能在哺乳動物中誘導特異的RNA干擾,而是細胞非特異性和全面的基因表達受抑和凋亡;
⑥ATP依賴性:在去除ATP的樣品中RNA干擾現象降低或消失顯示RNA干擾是一個ATP依賴的過程。可能是Diecer和RISC的酶切反應必須由ATP提供能量。
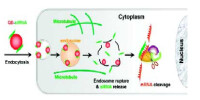
RNA干擾原理圖
兩方面的證據提示轉座子活性的抑制與siRNA有關。
① 發現蠕蟲mut-7 基因參與RNAi 並且與轉座子的轉座抑制有關;
② 在果蠅中, 參與RNAi 的RNA 解螺旋酶Spindle-E 的突變將導致該基因引起的基因沉默的缺失, 同時提高了反轉錄轉座子活性。
RNAi抵禦病毒感染
RNAi參與異染色質的形成和維持
Hall等研究表明,著絲粒同源重複序列和RNAi 組分一起正負調節著異染色質的形成並共同促使異染色質組裝成核;Vople 等在敲除裂殖酵母( S. pombe) 的RNAi 途徑基因( 如Argonaute 、Dicer 、RDRP) 時發現異染色質轉錄得到的dsRNA可以在RNAi 途徑的參與下, 加工成si RNA,si RNA 募集異染色質蛋白1( HP1) , 然後靶向性引起相應異染色質區域的轉基因沉默。
RNAi參與機體的發育調控及生理代謝
RNAi只抑制轉錄后的基因, 所以RNAi 在生物體發育學研究中具有優勢。Chuang 等用RNAi 技術進一步證實了AG、CLV3 、AP1 、PAN 等已知功能基因在擬南芥花發育過程中的功能。在RNAi 過程中形成的RISC 複合物可根據不同情況分別利用si RNA 或stRNA 行使不同的功能, 但最終均導致特定基因沉默。
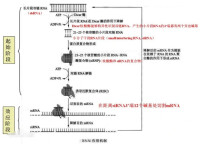
RNAi作用機制
需要ATP:Zamore等認為RNAi過程中至少有2個步驟需要能量的供給:一是長的雙鏈RNA被 Dicer所酶切產生雙鏈RNA;二是在雙鏈RNA與RISC結合解鏈后形成有活性的RISC。
特異性:Elbashir等和Brummel kamp等發現在21~23個鹼基對中有1~2個鹼基錯配會大大降低對靶mRNA的降解效果。
位置效應:Holen等根據人TF(tissue factor)不同的位置各合成了4組雙鏈RNA來檢測不同位置的雙鏈RNA對基因沉默效率的影響。在不同濃度和不同類型的細胞中,hTF167i和hTF372i能夠抑制85%~90%的基因活性,hTF562i只能抑制部分基因活性,而hTF478i則幾乎沒有抑制基因的活性。他們還以hTF167為中心依次相差3個鹼基對在其左右各合成了幾組雙鏈RNA,有趣的是它們所能抑制該基因活性的能力以hTF167為中心依次遞減。特別是hTF158i和 hTF161i只與hTF167i相距9個和6個鹼基,但它們幾乎沒有抑制該基因活性的能力。結果還表明雙鏈RNA對mRNA的結合部位有鹼基偏好性,相對而言,GC含量較低的mRNA被沉默效果較好。
競爭效應:Hoten等將10 nmol/L和30 nmol/L的hTF167i相比,兩者的沉默基因效果無差異,但將20 nmol/L基因抑制效果很差的PSK314i和10 nmol/L的hTF167i相混合后,hTF167i產生的抑制效果明顯降低。
可傳播性:在線蟲中,雙鏈RNA可以從起始位置傳播到遠的地方,甚至於全身。Feinberg 和Hunter在線蟲細胞膜上發現一種跨膜蛋白SID1,它可以將雙鏈RNA轉運出細胞,因此系統性的RNAi包括了SID1介導的雙鏈 RNA在細胞間的運輸。但在果蠅上並未發現有此基因的同源物,因此在果蠅上通過注射產生的RNAi不能擴散。
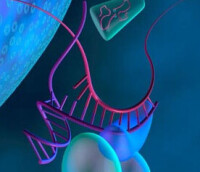
RNA干擾模擬圖
最適用於:已經找到最有效的siRNA的情況下,需要大量siRNA進行研究。
不適用於:篩選siRNA等長時間的研究,主要原因是價格因素。
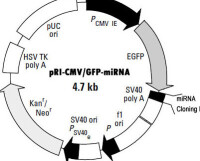
RNA干擾原理圖
最適用於:篩選siRNAs,特別是需要製備多種siRNAs,化學合成的價格成為障礙時。
不適用於:實驗需要大量的,一個特定的siRNA。長期研究。
用RNase III 消化長片斷雙鏈RNA製備siRNA
其他製備siRNA的方法的缺陷是需要設計和檢驗多個siRNA序列以便找到一個有效的siRNA。而用這種方法——製備一份混合有各種siRNAs “混合雞尾酒”就可以避免這個缺陷。選擇通常是200—1000鹼基的靶mRNA模版,用體外轉錄的方法製備長片斷雙鏈dsRNA ,然後用RNase III (or Dicer) 在體外消化,得到一種siRNAs“混合雞尾酒”。在除掉沒有被消化的dsRNA后,這個siRNA混合物就可以直接轉染細胞,方法和單一的siRNA轉染一樣。由於siRNA混合物中有許多不同的siRNAs,通常能夠保證目的基因被有效地抑制。
dsRNA消化法的主要優點在於可以跳過檢測和篩選有效siRNA序列的步驟,為研究人員節省時間和金錢(注意:通常用RNAse III通常比用Dicer要便宜)。不過這種方法的缺點也很明顯,就是有可能引發非特異的基因沉默,特別是同源或者是密切相關的基因。現在多數的研究顯示這種情況通常不會造成影響。
最適用於:快速而經濟地研究某個基因功能缺失的表型
不適用於:長時間的研究項目,或者是需要一個特定的siRNA進行研究,特別是基因治療
前面的3種方法主要都是體外製備siRNAs,並且需要專門的RNA轉染試劑將siRNAs轉到細胞內。而採用siRNA表達載體和基於PCR的表達框架則屬於:從轉染到細胞的DNA模版中在體內轉錄得到siRNAs。這兩種方法的優點在於不需要直接操作RNA。
多數的siRNA表達載體依賴三種RNA聚合酶III 啟動子(pol III)中的一種,操縱一段小的髮夾RNA(short hairpin RNA, shRNA)在哺乳動物細胞中的表達。這三類啟動子包括大家熟悉的人源和鼠源的U6啟動子和人H1啟動子。之所以採用RNA pol III啟動子是由於它可以在哺乳動物細胞中表達更多的小分子RNA,而且它是通過添加一串(3到6個)U來終止轉錄的。要使用這類載體,需要訂購2段編碼短髮夾RNA序列的DNA單鏈,退火,克隆到相應載體的pol III 啟動子下游。由於涉及到克隆,這個過程需要幾周甚至數月的時間,同時也需要經過測序以保證克隆的序列是正確的。
siRNA表達載體的優點在於可以進行較長期研究——帶有抗生素標記的載體可以在細胞中持續抑制靶基因的表達,持續數星期甚至更久。
最適用於:已知一個有效的siRNA序列,需要維持較長時間的基因沉默。
不適用於:篩選siRNA序列(其實主要是指需要多個克隆和測序等較為費時、繁瑣的工作)。
siRNA表達框架(siRNA expression cassettes,SECs)是一種由PCR得到的siRNA表達模版,包括一個RNA pol III啟動子,一段髮夾結構siRNA,一個RNA pol III終止位點,能夠直接導入細胞進行表達而無需事前克隆到載體中。和siRNA表達載體不同的是,SECs不需要載體克隆、測序等頗為費時的步驟,可以直接由PCR得到,不用一天的時間。因此,SECs成為篩選siRNA的最有效工具,甚至可以用來篩選在特定的研究體系中啟動子和siRNA的最適搭配。如果在PCR兩端添加酶切位點,那麼通過SECs篩選出的最有效的siRNA后,可以直接克隆到載體中構建siRNA表達載體。構建好的載體可以用於穩定表達siRNA和長效抑制的研究。
這個方法的主要缺點是①PCR產物很難轉染到細胞中(晶賽公司的Protocol可以解決這一問題)②不能進行序列測定,PCR和DNA合成時可能差生的誤讀不能被發現導致結果不理想。
最適用於:篩選siRNA序列,在克隆到載體前篩選最佳啟動子
不適用於:長期抑制研究。(如果克隆到載體后就可以了)
siRNA表達載體構建好后,即可進行RNA干擾主體實驗。
RNA干擾主體實驗的重點在於:
如果目的細胞的質粒轉染效率較低(低於70%),則應採用腺病毒或慢病毒載體,利用病毒載體的高感染率、高表達特性,更好地開展RNA干擾主體實驗。
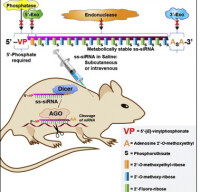
RNA干擾原理圖
⒈轉染試劑對照(監控轉染及培養條件對結果的影響);
⒉nonsense siRNA對照(監控外源核酸本身對結果的影響);
⒊positive siRNA對照(監控假陰性);
⒋技術重複對照(也叫off-target 對照,也就是利用至少2個靶點的siRNA同時實驗,2個siRNA互為off-target control,當兩者的表型相同時,才有可能是特異性的knockdown效應);
⒌rescue 對照(knockdown之後做超表達,看是否有性狀的逆轉,這也是為了說明knockdown的特異性);6.全表達組掃描對照(就是轉錄/表達晶元掃描,以最終確定表型不是由於off-target造成)。
實際實驗中,全表達組掃描對照很少有文獻涉及。其它幾個對照中,1,2兩種對照即所謂的空白細胞對照、NC對照,基本是所有雜誌都要求具備的。4,5兩種對照,主要是為了解決off-target效應,選做一種即可,一般建議選5,涉及的實驗即所謂的“RNA干擾回復實驗”,
一般應該從mRNA水平、蛋白質水平、細胞表型水平三個層次來檢測干擾效率。
mRNA水平:RT-PCR、Real-time PCR;蛋白質水平:Western-blot、ELISA、免疫組化;細胞表型水平:MTT、克隆形成實驗、流式細胞檢測、細胞小室實驗等。RNA干擾效率在動物模型上的進一步驗證(體內)動物模型實驗可以採取“體內法”和“體外法”。
體內法,即先做裸鼠成瘤模型,再將質粒或病毒導入裸鼠,檢測RNA干擾效果。此法操作複雜,對質粒和病毒產品的質和量要求都較高,但是比較貼近實際,說服力較顯著。體外法,即先將質粒或病毒導入腫瘤細胞,再將腫瘤細胞導入動物體內,然後檢測RNA干擾效果。此法操作較簡單,對質粒和病毒產品的質量要求較低,所以為大多數文獻所採用。建議採用此方法來進行動物模型水平的實驗。
Off-target effects(脫靶效應)最早由Dharmacon科學家Jackson和他的同事們提出(Fedorov,Y.,et al. "Off-targeting By siRNA Can Induce Toxic Phenotype." RNA Accepted (2006).)他們給細胞轉染特定基因的單條siRNA后運用全基因組晶元檢測技術鑒定表達上調/下調1.5到3倍的靶基因數量。研究人員發現在這種情況下有大量的基因被非特異性的調控著。siRNA正義鏈和反義鏈與脫靶基因的互補水平有高有低,並且每條siRNA所引發的脫靶基因表達譜也不盡相同,反映了序列依靠性的脫靶效應。
簡單來說,Off-target效應就是指干擾shRNA序列進入了microRNA途徑,通過microRNA途徑,其可以不受完全互補的限制而調控大量靶基因的表達。原本需要19~23nt的RNA序列完全互補才能發生干擾作用,而如果進入microRNA途徑,只需要11~15nt互補就可以產生干擾效果,這使得siRNA可能與非靶基因結合而導致非靶基因沉默,造成脫靶。
如果脫靶干擾的部分基因,正好與目的基因位於同一信號通路中,或者與目的基因的生物學功能相似,那麼,如果因脫靶而干擾了其它基因,亦會造成和目的基因受到干擾后相同的細胞表型改變。而實際上,可能選擇的這條shRNA序列並沒有對目的基因造成有效干擾,或者雖然干擾了目的基因,但是並不會引起預期的細胞表型改變。
基於以上原因,自從Off-target效應被發現並被研究者們廣泛認同后,越來越多的雜誌要求研究者們在投稿時需要有相應的對照來說明Off-target效應。即您需要有相關對照或者實驗來說明,您所獲得的實驗結果,不是由於Off-target效應而產生的。
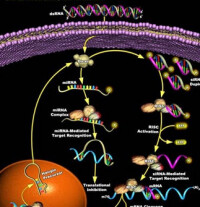
RNA干擾原理圖
RNAi作為一種高效的序列特異性基因剔除技術在傳染性疾病和惡性腫瘤基因治療領域發展極為迅速。在利用RNAi技術對HIV-1、乙型肝炎、丙型肝炎等進行基因治療研究中發現,選擇病毒基因組中與人類基因組無同源性的序列作為抑制序列可在抑制病毒複製的同時避免對正常組織的毒副作用。同時將抑制序列選擇在特定的位點,可對部分有明確基因突變的惡性腫瘤細胞如含有BCL/ABL或AML1/MTG8融合基因的白血病細胞產生凋亡誘導作用。此外尚可通過使用腫瘤特異性啟動子如hTERT啟動子、survivin啟動子或組織特異性啟動子如酪氨酸酶啟動子、骨鈣素啟動子引導針對某些癌基因或抗凋亡分子的siRNA或shRNA表達,從而達到特異性殺傷腫瘤細胞的目的。
已證實N-Ras或BRAF的激活型突變是引發黑素瘤的主要病因,其中66%的病例為BRAF激酶作用域突變。而約80%的BRAF突變病例是因胸腺嘧啶突變為腺嘌呤造成第599位的纈氨酸突變為谷氨酸所致。使用RNAi技術剔除黑素瘤細胞的BRAF表達,不僅抑制了腫瘤細胞生長,而且減弱了其侵襲能力,為黑素瘤基因治療奠定了基礎。
最近研究表明趨化因子受體CXCR4是乳腺癌轉移的重要調節因素,其配體CXCL12可趨化腫瘤細胞並調節其增生和侵襲特性。使用RNAi干擾技術剔除CXCR4證實該分子為原位移植腫瘤生長和轉移所必需。此外,剔除BCRP表達可以逆轉其介導的腫瘤耐葯。
瘢痕疙瘩是一種較為難治的疾病,尚無有確切療效的治療方法。使用特異性siRNA剔除TGF-βII型受體表達可以抑制角膜成纖維細胞表達纖維粘連蛋白並降低其遷移能力。剔除CTGF表達可使皮膚成纖維細胞內I型和III型前膠原蛋白、鹼性成纖維細胞生長因子、組織金屬蛋白酶抑制因子(tissue inhibitor of metalloproteinase,TIMP)-1,TIMP-2和TIMP-3等基因表達水平降低。這些結果提示TGF-β信號轉導通路和CTGF均可能是瘢痕疙瘩治療的潛在靶點。
加州大學洛杉磯分校和加州理工學院的研究人員開發出使用RNAi技術來阻止艾滋病病毒進入人體細胞。這個研究小組設計合成的lenti病毒載體引入siRNA,激發RNAi使其抑制了HIV-1的coreceptor-CCR5進入人體外周T淋巴細胞,而不影響另一種HIV-1主要的coreceptor-CCR4,從而使以lenti病毒載體為媒介引導siRNA進入細胞內產生了免疫應答,由此治療HIV-1和其他病毒感染性疾病的可行性大大增加。RNAi還可應用於其它病毒感染如脊髓灰質炎病毒等,siRNA已證實介導人類細胞的細胞間抗病毒免疫,用siRNA對Magi細胞進行預處理可使其對病毒的抵抗能力增強。全世界約30個國家和地區散發或流行的嚴重急性呼吸綜合征(severe acute respiratory syndrome,SARS)的防治研究中,RNAi也受到了重視。siRNA在感染的早期階段能有效地抑制病毒的複製,病毒感染能被針對病毒基因和相關宿主基因的siRNA所阻斷,這些結果提示RNAi能勝任許多病毒的基因治療,RNAi將成為一種有效的抗病毒治療手段。這對於許多嚴重的動物傳染病的防治具有十分重大的意義。
美國西北大學的Carthew R W和日本基因研究所的Ishizuka A等人發現RNAi同脆性X染色體綜合征(與FMR-1基因異常有關的導致智力低下的染色體病)之間的關係密切,揭示了與RNAi相關機制的缺陷可能導致人類疾病的病理機制。遺傳性疾病的RNAi治療成為當今研究RNAi的又一大熱點。
腫瘤是多個基因相互作用的基因網路調控的結果,傳統技術誘發的單一癌基因的阻斷不可能完全抑制或逆轉腫瘤的生長,而RNAi可以利用同一基因家族的多個基因具有一段同源性很高的保守序列這一特性,設計針對這一區段序列的dsRNA分子,只注射一種dsRNA即可以產生多個基因同時剔除的表現,也可以同時注射多種dsRNA而將多個序列不相關的基因同時剔除。Maen等應用RNAi技術成功地阻斷了MCF7乳腺癌細胞中一種異常表達的與細胞增殖分化相關的核轉錄因子基因Sp1的功能。
Napoli等將1個查爾酮合成酶基因(chs)置於1個強啟動子后導人矮牽牛(Petunia hybrida),試圖加深花朵的紫顏色。結果部分花的顏色並非期待中的深紫色,而是形成了花斑狀甚至白色,而且這種性狀可以遺傳。因為導入的基因和其同源的內源基因同時都被抑制,他們將這種現象命名為共抑制(co-suppression)。類似的結果同樣在真菌脈胞菌(Neurospora crassa)中和其它轉基因植物中存在。對於部分轉基因植物來說,基因沉默可能是因為特異基因的甲基化而導致,這被稱為轉錄水平基因沉默。但確實部分植物中的基因沉默是在轉錄后發生的,這被稱為轉錄后基因沉默。實驗表明在發生PTGS的個體中同源轉錄確實存在,但是很快在胞漿中被降解,沒有積聚。Palauqui等進一步證實,在植物中將出現轉基因沉默的植株嫁接到另一沒有基因沉默的轉基因植株中同樣可以導致PTGS,但對非轉基因植株卻無效。 Cogoni等證實PTGS由一種可擴散的反式作用分子所介導。
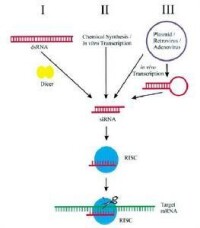
RNAi實驗流程
RISC loading complex (RLC):是一種促使RISC形成的複合物。RLC有方向性地調節小RNA雙螺旋,為以後的RISC組裝作好鋪墊。最近,siRISC loading complexes (siRLCs)在果蠅中研究最多。有研究者認為在果蠅中的siRLCs包含DCR2-R2D2異型二聚體和siRNA雙螺旋;R2D2部分是非對稱性的感受器,為RISC組裝調整好siRNA的方向。miRISC loading complexes (miRISCs)的研究尚未報導,因為它的過程更為複雜,而且體外研究miRLCs的方法還沒有建立。RNA-induced initiation of transcriptional gene silencing (RITS):是一種組織染色質變型的複合物。RITS複合物也包含Dicer加工形成的siRNA和AGO蛋白質,通過結合到異染色質的基因池上來促使異染色質上基因沉默。RNA-induced silencing complex (RISC):一種RNA-蛋白質複合物,通過與目標mRNA完全或者部分的互補配對來實施切割或者翻譯抑制功能。SiRNA組裝siRISC,miRNA組裝miRISC。RISCs(無論siRISC還是miRISC)包括兩種類型:切割型和不切割型。研究表明,RISC當中的AGO蛋白質決定了RISC是切割型的還是不切割型的。Slicer:在切割型RISC中的內切酶的另外一種表述方法。Small interfering RNA (siRNA):是一種小RNA分子(~21-25核苷酸),由Dicer(RNAase Ⅲ家族中對雙鏈RNA具有特異性的酶)加工而成。SiRNA是siRISC的主要成員,激發與之互補的目標mRNA的沉默。