體細胞雜交
體細胞雜交
體細胞雜交又稱體細胞融合,指將兩個GT不同的體細胞融合成一個體細胞的過程。融合形成的雜種細胞,兼有兩個細胞的染色體。
體細胞是生物體除生殖細胞外的所有細胞。將從身體分離的體細胞做組織培養進行遺傳學研究的學科稱為體細胞遺傳學(somaticgenetics)。體外培養細胞可人為控制或改變環境條件,並可建立細胞株,長期保存,進行各種正常和病理研究。與基因定位有關的是體細胞雜交(somaticcellhybridization)。細胞雜交又稱細胞融合(cellfusion),是將來源不同的兩種細胞融合成一個新細胞。大多數體細胞雜交是用人的細胞與小鼠、大鼠或倉鼠的體細胞(hybridcell)進行雜交。
細胞融合后,要進行異核體的篩選。所用方法是:①根據雙親細胞的形態特徵,用不同熒光染料標記,人工挑選或用熒光激活細胞分揀機分離。或通過顯微操作直接挑選。②在合適的選擇壓下,只允許雜種細胞生長,淘汰雙親和同源融合細胞。如生長激素自主選擇、代謝互補選擇、白化互補選擇、營養缺陷型互補選擇、藥物抗性互補選擇等。
融合后的雜種細胞的異核體,多數情況下在第一次有絲分裂期即發生兩個親本核的融合,如果兩個核在雜種細胞中位置較近,也可能在有絲分裂前就發生融合。如果兩個核不融合,有可能發育成嵌合體。如果兩核既相互輔助又相互排斥,從而導致染色體丟失,經常還會伴隨著染色體重排、染色體碎片、染色體環、染色體橋等形成。融合后的兩個原生
質體的細胞質,可能均勻混合,細胞器也均勻分佈,因此雙方的葉綠體及線粒體基因都得到遺傳。也有人認為在兩個原生質體融合時,質體會隨機丟失。融合后的細胞是否為雜種,多用染色體形態比較法和同工酶分析法來鑒定,也有用花器官的形態顏色來檢測的。
一般來說,植物有性雜交只能在同種或在系統分類上相近種的親本間進行,核性狀按孟德爾遺傳規律分離,而核外基因則大多數為母性遺傳。體細胞雜交能克服有性雜交的配子不親合性,獲得一些含有另一親本非整倍體的雜種或胞質雜種。它們的遺傳變異範圍極廣,大大豐富了育種的原始材料,從而創造出自然界中沒有的新物種。如馬鈴薯與番茄融合得到的薯番茄和番茄薯。沒有壁的裸露細胞,有利遺傳操作,轉移部分基因或基因組,已成功的如胡蘿蔔一S歐芹融合。因此體細胞雜交在物種改良上有著廣闊前景。另外甘藍與白菜融合,人工合成的甘藍型歐洲油菜,在實驗室中短時間內重複出現了自然界的進化過程,使芸苔屬的三角進化關係又一次得到驗證。體細胞雜交技術也為細胞生物學研究及遺傳學分析提供了一個新的研究途徑。
體細胞雜交

體細胞雜交
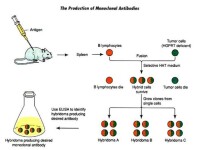
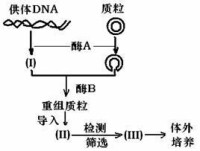
利用高劑量的X射線將候選染色體打斷成若干片段,含有這種片段的細胞可與倉鼠細胞形成雜交克隆。在這種雜交中,人類染色體片段被插入到倉鼠染色體的中間部分,因此大部分克隆片段在進行有絲分裂時處於穩定的狀態。利用類似於遺傳重組原理和最大似然性的統計學方法來計算存在於DNA片段上的多態性或非多態性標記之間的斷點頻率,以此估計標記之間的距離,並建立人類基因組拷貝庫---體細胞雜交系統。可根據不同要求構建出斷裂程度不同的多套拷貝,從而得到不同解析度的放射雜交圖。總之,輻射性雜交是建立在受到X射線照射的供體細胞與非放射線處理的受體細胞融合基礎上的一種體細胞遺傳學方法,是利用兩個標記之間被X射線打斷的概率來計算標記之間距離,通過類似於減數分裂連鎖製圖的方法來確定標記之間的順序。
G3嵌板的產生→確定STSs→PCR體系及反應條件→構建RH圖譜。
優點
熒光原位雜交(FISH)法和輻射雜種細胞系(RH)技術是國際上最常用的基因定位的兩種方法,各有優缺點。FISH可以定位基因組中多個同源位點,結果直觀、可靠,而RH法則很困難。但是FISH法檢測步驟繁雜,尤其受探針大小的影響較大,2kb以下的cDNA序列很難定位,而且結果需要有經驗的細胞遺傳學家進行分析。RH法簡單易行,定位精度高,適合小於lkb--2kb以下的序列,根據統計學方法可直接定位。其結果也便於不同實驗室間比較。和其他作圖法相比,RH作圖法是依賴於輻射引起的斷點而不是靠減數分裂重組得到的斷點,是一種完全獨立的方法,所以是一個互補的作圖方法,可利用所有不同的STSs,具有巨大的DNA補充潛力,從而有利於整合不同的遺傳和轉錄圖以及所有基因組位標(無名序列、中心粒和端粒)。缺點
但是RH法也受到某些自身條件的限制,RH嵌板中每個雜交克隆均包括倉鼠和人的基因組DNA,可以看作是在倉鼠基因組DNA背景下相區別。如有些基因無法定位的原因即在於它的序列包括閱讀框架以及3,UTR區域與倉鼠的相似性高達90%以上。此外,做ESTs或全長cDNA定位的引物為cDNA序列,而RH法是在基因組DNA上擴增出相應的片斷,由於內含子序列的存在,擴增結果與引物設計的部位直接有關,一般應選用3,UTR部位的序列。還應指出,用RH法能否成功定位,依賴於該基因所在染色體區域上合適位標的存在。如果現有的RH圖中此區域分佈的合適位標過少,可改用位標位點多的嵌板。因此隨著今後RH圖精度的提高,越來越多的STSs被放置於染色體上,有望彌補這個缺陷。
輻射性雜交技術是繼熒光原位雜交后新近建立的染色體定位方法,RH作圖法提供了一種聯繫物理圖和遺傳圖的方法,已成為當今構建人類基因組大尺度、高密度、連續的染色體圖的常用方法之一。其用途主要有:EST定位、基因克隆、基因組作圖、測定距離、尋找新基因等。
體細胞雜交
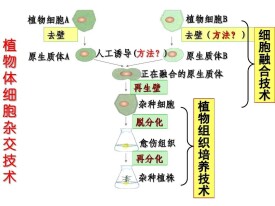
原生質體製備選取煙草植株上的幼嫩葉片和培養好的大豆細胞,用酶解法製備原生質體。煙草的原生質體呈綠色,大豆的無色,在顯微鏡下很容易將二者區別開來。
原生質體融合取等量的煙草和大豆的原生質體混合后,加入聚乙二醇溶液。在顯微鏡下觀察,可以看到原生質體相互黏集在一起。隔一段時間后,加入高鈣、高pH的溶液,這時原生質體才開始融合。原生質體融合包括膜融合和核融合兩個過程。誘導融合只能誘導細胞膜的融合,兩個核的融合是在雜種細胞第一次有絲分裂時進行的。
雜種細胞的篩選和培養煙草與大豆的原生質體融合后,將原生質體轉移到適當的培養基上培養,使原生質體再生出細胞壁。這時,在細胞混合物中,不僅有煙草—大豆雜種細胞,還有煙草細胞、大豆細胞、煙草—煙草細胞、大豆—大豆細胞。雜種細胞的篩選,可以用機械方法,也可以用生理學或遺傳學的方法。以機械方法為例,根據兩種親本細胞在形態、色澤上的差異,將細胞分別接種在帶有小格的培養皿中,每個小格中約放1~3個細胞。在顯微鏡下找出雜種細胞,並且標定位置。等雜種細胞分裂成細胞團時,轉移到培養皿中,培養成愈傷組織。
雜種植株的再生與鑒定雜種植株的再生是指從愈傷組織培養出雜種植株的過程。由於煙草和大豆分別屬於茄科和豆科,二者的原生質體融合后,至今只能長成雜種愈傷組織,還不能分化,因此談不上雜種植株的再生和鑒定。對於能夠再生出雜種植株的,如煙草—海島煙草、白菜—甘藍、胡蘿蔔—羊角芹等,長出的植株究竟是不是雜種,還需要經過鑒定才能確定下來。雜種植株的鑒定方法有形態學方法、生化方法(如電泳)、細胞學方法(如染色體組型分析)、分子生物學方法(如分子雜交)等
了解用聚乙二醇PEG方法誘異同種植物原生質體融合的技術,並能根據新本原生質體的形態樗來鑒別雜種細胞。
不同種植物的原生質體可在人工誘導條件下融合,所產生的雜種細胞,即異核體經過培養可再生新壁,分裂形成愈傷組織,進而分化產生雜種植株。由於進行融合的原生質體來自體細胞,故該項技術也叫體細胞雜交。原生質體融合能使有性雜交不親合的植物種間進行廣泛的遺傳重組,因而在農業育種上具有巨大的潛力。在植物遺傳操作研究中也是關鍵技術之一。
人工誘導原生質體融合可使用物理學方法,如運用細胞融合儀,在電場誘因導下實現融合,然而至今廣為使用的仍是聚乙二醇(PEG)溶液引起原生質體的聚集和粘連,然後用高pH鈣溶液相處理的化學方法(Kao等,1974)。該法應用分子量至為1500~6000的聚乙二醇(PEG)溶液引起原生質體的聚集和粘連,然後用高pH的鈣溶液稀釋時,就產生了高頻率的融合,融合的頻率和省略常與所有PEG的分子量、濃度,作用時間,原生質體的生理狀態與密度以及操作者的細心程度有關。
1.實驗材料:
煙草或其它植物無菌苗的葉片。
胡蘿蔔肉質根誘導的鬆軟愈傷組織或懸浮培養細胞。
2.試劑
2.1酶液及洗滌液,同植物原生質體的分離和培養實驗。
2.2PEG溶液
2.3高pH高鈣稀釋液
2.4DPD培養基同植物原生質體的分離和培養實驗。
所有操作均在超凈工作台上進行。
1.原生質體的分離和收集。
2.將收集的兩種不同材料的原生質體分別懸浮在0.16mol/L的CaCl2·2H2O(pH5.8~6.2)原生質體密度調整為2×105/ml左右(用血細胞計數板統計原生質體密度)。
3.將兩種原生質體懸液等量混合。
4.用刻度吸管將混合的原生質體懸液滴在直徑為60mm的平皿中,每皿滴7~8滴,每滴約0.1ml。然後靜置10in,使原生質體巾在皿底上,形成一薄層。(應有3~5個平皿的重複)。
5.用吸管將等量的PEG溶液緩慢地加在原生質體液滴上,再靜置10~15min。此時可取一個平皿在倒置顯微鏡上觀察原生質體間的粘連。
6.用刻度吸管向原生質體液滴慢慢地加入高pH、商鈣稀液。第一次加0.5ml,第2次1ml,第3、4次各2ml,每次之間間隔5min。
7.將平皿稍微傾斜,吸去上清液,再緩緩加入4ml稀釋液。5min后,再傾斜平皿,吸去上清液注意吸去上清液時勿使原生質體漂浮起來。
8.用DPD培養基如上法換洗二次。
9.每平皿中加培養基2ml,輕輕搖動平皿。
10.用蠟膜密封平皿。置260下進行24h暗培養,然後轉到弱光條件下培養。
1.在倒置顯微鏡下觀察異源融合。在培養3天以內,可根據雙新原生質體的形態特徵來鑒別異核體。因為來自葉肉組織的原生質體具有明顯綠色葉綠粒,而來自培養細胞的原生質體無色,但具濃密原生質絲,並可看到顯示的核區。
2.統計異源融合的頻率。