肝星狀細胞
肝星狀細胞
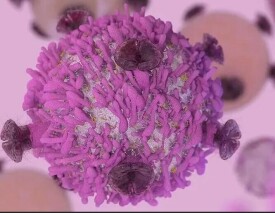
肝星狀細胞(hepatic stellate cell,HSC)的名稱有多種多樣,如肝貯脂細胞(fat-storingcell,FSC)、脂細胞(1ipocyte)、維生素A貯存細胞(vitaminA-storingcell)、竇周細胞(perisinusoidalcell)、Ito細胞等,它是ECM的主要來源,肝星狀細胞激活並轉化為肌成纖維細胞樣細胞(MFC),各種致纖維化因素均把HSC作為最終靶細胞,正常情況下肝星狀細胞處於靜止狀態。當肝臟受到炎症或機械刺激等損傷時,肝星狀細胞被激活,其表型由靜止型轉變為激活型。激活的肝星狀細胞一方面通過增生和分泌細胞外基質參與肝纖維化的形成和肝內結構的重建,另一方面通過細胞收縮使肝竇內壓升高。
早在1876年,德國CarlvonKupffer在使用氯化金染色法研究肝臟
肝星狀細胞
肝星狀細胞位於Disse間隙內,緊貼著肝竇內皮細胞(sinusoidalendothelialcells,SEC)和肝細胞。
肝星狀細胞
正常情況下肝星狀細胞表現為富含VitA脂滴的靜止型,其功能主要有:(1)代謝和貯存VitA:肝臟儲存有體內80%左右的維生素A,對體內維生素A的代謝起著重要作用。視黃醛在小腸內酯化后被運輸到肝臟並與特異的視黃醛結合蛋白結合,然後轉運到鄰近的肝星狀細胞儲存。(2)儲存脂肪:正常肝星狀細胞胞質內的脂滴含有大量的甘油三酯,為肝細胞提供能源。(3)合成和分泌膠原及糖蛋白、蛋白多糖等基質成分:研究認為,肝星狀細胞是正常及纖維化肝臟中細胞外基質(extracellularmatrix,ECM)的主要合成細胞。正常肝臟中合成的膠原以Ⅰ型、Ⅲ和Ⅳ型為主,其合成
肝星狀細胞
正常情況下肝星狀細胞處於靜止狀態。當肝臟受到炎症或機械刺激等損傷時,肝星狀細胞被激活,其表型由靜止型轉變
肝星狀細胞
1、胞體增大,胞突伸展。胞質中脂滴消失,VitA含量減少。胞質內粗面內織網、高爾基體發達,具有旺盛的蛋白質合成能力;
2、細胞增生頻率增加,並且向肝損傷部位遷徙;
3、表達α-平滑肌肌動蛋白(α-smoothmuscleactin,α-SMA)、波形蛋白(vimentin)及結蛋白(desmin),成為肌纖維樣母細胞;
4、收縮性增強;
5、ECM分泌增加;
6、細胞因子、趨化因子及受體分泌增加;
7、TIMP合成及分泌增加,使ECM成分降解減少。其中α-SMA的表達為HSC激活的標誌。
肝星狀細胞的持續激活是肝纖維化發生髮展過程中的關鍵環節。激活的肝星狀細胞一方面通過增生和分泌細胞外基質參與肝纖
肝星狀細胞
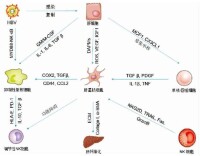
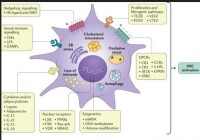
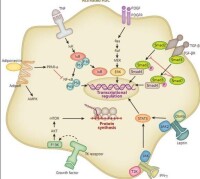
1、啟動階段啟動階段是指早期基因表達的改變及在細胞因子等刺激因素作用下產生的細胞表型改變。當肝實質細胞受到損傷時,鄰近的肝細胞、庫普弗細胞、竇內皮細胞和血小板等通過旁分泌作用可分泌多種細胞因子,如腫瘤壞死因子α(TNF-α)、轉化生長因子β(TGF-β)、胰島素生長因子(IGF-1)、肝細胞生長因子(HGF)、血小板源性生長因子(PDGF)、內皮素(ET)-1等,作用於HSC並使之出現肌成纖維母細胞(myofibroblast,MFB)樣表型轉化,激活並導致細胞增殖、ECM合成增加等。激活后的肝星狀細胞可自分泌TGF、PDGF、ET等細胞因子使活化得以持續,此時即使除去原發因素纖維化仍會持續。
2、持續階段持續階段指由於上述各種因子的作用而維持星狀細胞的激活狀態並有纖維形成。肝星狀細胞活化的持續階段有以下特徵性的變化,這些改變的直接或間接效應是增加ECM的沉積。此階段肝星狀細胞的活化受自分泌和旁分泌的雙重調節。
(1)細胞增殖:PDGF是肝星狀細胞的最強絲裂原,肝星狀細胞活化早期PDGF受體增強了肝星狀細胞對這種絲裂原的反應;
(2)細胞趨化聚集:肝星狀細胞能向化學趨化劑的部位移動,在一定程度上解釋了為什麼肝星狀細胞在肝內多分佈在炎性間隔內;
(3)纖維形成:增加基質形成是肝星狀細胞活化導致肝纖維化的最直接途徑。一方面,ECM合成的量增加;另一方面,合成的ECM種類異常,在正常情況下,肝星狀細胞以合成型膠原為主。而活化后則以產生型膠原為主;
肝星狀細胞
(5)基質降解:在肝纖維化過程中,伴隨著ECM重構,基質蛋白酶質和量的改變起重要作用。肝星狀細胞幾乎能表達基質降解所需要的所有關鍵成分,因此,活化的肝星狀細胞不僅在ECM生成過程中起作用,而且在ECM降解過程中也起重要作用。基質蛋白酶家族是一類鈣依賴蛋白酶,能夠特異性地降解膠原蛋白和一些非膠原蛋白成分。根據基質蛋白酶對底物的特異性將其5類:①間質性膠原酶;②明膠酶;③溶基質素;④膜型基質金屬蛋白酶;⑤金屬彈力蛋白酶;
(6)視黃醇類消失:隨著肝星狀細胞活化,細胞失去了其特徵性的核周視黃醇(維生素A)脂滴;
(7)白細胞趨化及釋放細胞因子:除了肝臟內多種細胞因子通過旁分泌發揮作用外,肝星狀細胞自分泌的細胞因子對其活化的持久延續也很重要。活化的肝星狀細胞自分泌TGF-B以及ET-1。分別導致肝星狀細胞產生大量ECM和具有收縮性。肝星狀細胞還能通過誘導單核巨噬細胞浸潤來擴大炎症效應。
激活的肝星狀細胞有兩個去向:
(1)由激活態轉變回靜止態。目前研究認為IL-10是一種能夠調控這一反應的刺激因子,可以下調炎症反應並增加組織間隙膠原酶的活性;
(2)發生細胞凋亡而死亡。體外培養試驗表明,靜止的肝星狀細胞不發生凋亡,肝星狀細胞在活化的同時出現自發性凋亡。近年來,有關肝星狀細胞凋亡分子機制的研究進展較快,現已證明有多種基因產物參與肝星狀細胞凋亡過程。其中包括死亡受體家族如Fas與FasL系統、天冬氨酸特異性半胱氨酸蛋白酶即Caspase家族、bcl-2調節蛋白家族等。人們通過對這些蛋白家族成員生化特性、生物功能以及上游下游分子作用機理的深入研究,提出了肝星狀細胞凋亡主要的兩條信號轉導通路:細胞凋亡的線粒體依賴性途徑和死亡受體途徑。兩條通路的結果都是引發了Caspase家族的級聯反應,最終表現為凋亡的產生。
1、Fas/FasL系統Fas也稱Apo-1或CD95,屬於腫瘤壞死因子(tumornecrosisfactor,TNF)受體和神經生長因
子(nervegrowthfactor,NGF)受體超家族。Fas是一個48kDa的I型跨膜蛋白分子,由319個氨基酸組成,定位於人10號染色體長臂。Fas主要分佈於組織細胞中,少量以可溶性形式(sFas)存在於細胞質和血清中。Fas配體(FasLigand,FasL)是一個分子量約為40kDa,屬於TNF家族的Ⅱ型跨膜蛋白分子,其C端位於胞外,N端深入胞內,定位於人1號染色體。主要表達於活化的T淋巴細胞表面。FasL或Fas抗體與細胞表面的Fas結合可誘導細胞凋亡。
2、Caspases家族近年來,在機體內發現多種半胱天冬蛋白酶(cysteineaspartate-specificproteinase,caspase)家庭成員,它們是結構特徵相似的同源蛋白酶,這些蛋白酶都是特異性的在底物的天冬氨酸序列后切斷肽鍵。在哺乳動物細胞內至少發現了十三種,編號Caspase-1~13,其中包括兩個在人類還未找到相應對等物的小鼠Caspase-11、12。根據其序列同源性可將它們分為三個亞家族:ICE樣、ICH-1樣和CPP32樣蛋白酶。Caspase家族的過度表達均可引起一系列不可逆轉的蛋白質裂解,最終導致細胞死亡,可以說,Caspases蛋白的表達是各種細胞凋亡機制共同的最後通路。
肝細胞枯否氏細胞貯脂細胞脂細胞竇周細胞內皮細胞。
畢業論文網 http://www.bylw8.com/Thesis/Medicine/Medical_Science/062L3Q62007-1182943438.html