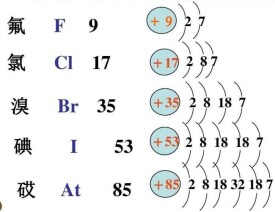
鹵族
周期性VIIA族元素
鹵族元素的單質都是雙原子分子,它們的物理性質的改變都是很有規律的,隨著分子量的增大,鹵素分子間的色散力逐漸增強,顏色變深(氟為淡黃綠色氣體;氯為黃綠色氣體;溴為深紅棕色液體;碘為紫黑色固體),它們的熔點、沸點、密度、原子體積也依次遞增。
鹵素之間形成的化合物稱為互鹵化物,如ClF3、ICl。
鹵素單質都很穩定,除了I2以外,鹵素分子在高溫時都很難分解。
鹵素的毒性從氟開始依次降低。氧化性:F2> Cl2> Br2> I2。還原性相反。
氟單質常溫下為淡黃色的氣體,極毒,與水反應立即生成氫氟酸和氧氣併發生燃燒,同時能使容器破裂,量多時有爆炸的危險。氟、氟化氫和氫氟酸對玻璃有較強的腐蝕性。氟是氧化性最強的元素,只能呈-1價。單質氟與鹽溶液的反應,都是先與水反應,生成的氫氟酸在與鹽的反應,通入鹼中可能導致爆炸。水溶液氫氟酸是一種弱酸。但卻是腐蝕性最強的氫鹵酸,如果皮膚粘到,將一直腐蝕到骨髓。氟可與所有元素髮生反應(除氦、氖、氬)。

氟
氯單質常溫下為黃綠色氣體,可溶於水,1體積水能溶解2體積氯氣。劇毒。氯的水溶液稱為氯水,氯氣溶於水並部分與水發生反應,生成氫氯酸與次氯酸,次氯酸氧化性很強,可用於漂白,次氯酸不穩定,受光照會分解成氫氯酸與氧氣。氫氯酸是一種強酸。氯有多種可變化合價。氯氣對肺部有強烈刺激。氯可與大多數元素反應。

氯
溴單質在常溫下為深紅棕色液體,可溶於水,100g水能溶解約3g溴。揮發性極強,有毒,蒸氣強烈刺激眼睛、粘膜等。水溶液稱為溴水。溴單質需要加水封存,防止蒸氣逸出危害人體。有氧化性,有多種可變化合價,常溫下與水微弱反應,生成氫溴酸和次溴酸。加熱可使反應加快。氫溴酸是一種強酸,酸性強於氫氯酸。溴一般用於有機合成等方面。

溴
碘單質在常溫下為深紫黑色固體,易溶於汽油、乙醇等溶劑,微溶於水,加碘化物可增加碘的溶解度並加快溶解速度。100g水在常溫下可溶解約0.02g碘。低毒,氧化性弱,有多種可變化合價。有升華性,加熱即升華,蒸汽呈紫紅色,但無空氣時為深藍色。有時需要加水封存。氫碘酸為無放射性的最強氫鹵酸,也是無放射性的最強無氧酸。但腐蝕性是所有無放射氫鹵酸中最弱的,僅對皮膚有刺激性。有還原性。 碘是所有鹵族元素中最安全的,因為氟、氯、溴的毒性、腐蝕性均比碘強,而砹 雖毒性比碘弱,但有放射性。
碘是所有鹵族元素中最安全的,因為氟、氯、溴的毒性、腐蝕性均比碘強,而砹 雖毒性比碘弱,但有放射性。

碘
| 鹵素單質 | 顏色和狀態 | 密度 | 熔點/℃ | 沸點/℃ |
| F2 | 淡黃綠色氣體 | 1.69g/L(15℃) | -219.6 | -188.1 |
| Cl2 | 黃綠色氣體 | 3.214g/L(0℃) | -101 | -34.6 |
| Br2 | 深紅棕色液體 | 3.119g/cm3(20℃) | -7.2 | 58.78 |
| I2 | 紫黑色固體、紫色氣體 | 4.93g/cm3(15°C) | 113.5 | 184.4 |
氧化性逐漸減弱,還原性逐漸增強。