鄰位效應
鄰位效應
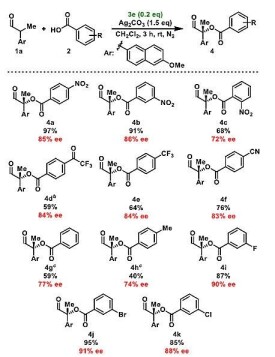
鄰位效應,指苯環內相鄰取代基之間的相互作用,使基團的活性和分子的物理化學性能發生顯著變化的一種效應。這種效應在間位和對位化合物中不存在。鄰位效應包括取代基之間的空間阻礙、誘導效應、場效應和成鍵能力。在苯環六個碳原子上,以一個帶有取代基的碳原子為標準,與它相鄰的碳原子的位置,稱為鄰位。即1,2位置。
鄰位效應
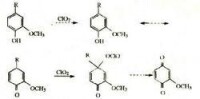
在某種反應過程里,相鄰基團部分地或完全和反應中心相鍵合,使的反應速率明顯增大,這種鄰位效應歸於鄰近基團的參與。因為鄰近基團參與,化合物p里的氯在沸水中易水解,可是化合物q在同樣條件下卻是穩定的。
因為鄰位基團的這種特殊的效應,鄰位基團對分子性能影響並不遵循哈米特方程。

鄰位效應
2、SN1的過程分為兩步:第一步,反應物發生鍵裂(電離),生成活性中間體正碳離子和離去基團;第二步,正碳離子迅速與試劑結合成為產物。總的反應速率只與反應物濃度成正比,而與試劑濃度無關。SN2為舊鍵斷裂和新鍵形成同時發生的協同過程。反應速率與反應物濃度和試劑濃度都成正比。能生成相對穩定的正碳離子和離去基團的反應物容易發生SN1,中心碳原子空間阻礙小的反應物容易發生SN2。如果親核試劑呈鹼性,則親核取代反應常伴有消除反應,兩者的比例取決於反應物結構、試劑性質和反應條件。低溫和鹼性弱對SN取代有利。
鄰位效應
電子基團和鹵原子時,親電試劑較多地進入其鄰位和對位;取代基為吸電子基團時,則以得到間位產物為主。此外,除發生這些正常反應外,有時試劑還可以進攻原有取代基的位置並取而代之,這種情況稱為原位取代。SNAr需要一定條件才能進行。如鹵代芳烴一般不易發生SNAr,但當鹵原子受到鄰或對位硝基的活化,則易被取代。鹵代芳烴在強鹼條件下也可發生取代。此外,芳香族重氮鹽由於離去基團斷裂成為穩定的分子氮,有利於生成苯基正離子,也能發生類似SNl的反應。
4、均裂取代反應。簡稱SH。為自由基對反應物分子中某原子的進攻,生成產物和一個新的自由基的反應。這種反應通常是自由基鏈式反應的鏈轉移步驟。一些有機物在空氣中會發生自動氧化,其過程也是均裂取代,如苯甲醛、異丙苯和四氫萘等與氧氣作用,可分別生成相應的有機過氧化物。
空間位阻效應主要指分子中某些原子或基團彼此接近而引起的空間阻礙作用。如酶反應中空間位阻會降低其催化活性。在配位化合物中,當向一個配體引入某些較大基團后,由於產生空間位阻,影響它與中心原子形成配位化合物。空間產生影響的事實,每個原子在分子中佔有一定的空間。如果原子是太接近了,兩個相鄰的原子就會形成重疊的電子云(表現為斥力),這可能會影響分子和首選形狀(構)的反應。
因分子中靠近反應中心的原子或基團佔有一定的空間位置,而影響分子反應活性的效應。降低分子反應活性的空間效應稱“空間阻礙”。例如,鄰位雙取代的苯甲酸的酯化反應要比沒有取代的苯甲酸困難得多。同樣,鄰位雙取代的苯甲酸酯也較難水解。這是由於鄰位上的基團佔據了較大的空間位置,阻礙了試劑(水、醇等)對羧基碳原子的進攻。相反,反應物轉變為活性中間體的過程中,如降低反應物的空間擁擠程度,則能提高反應速度。這種空間效應稱“空間阻效”。例如,叔丁基正離子比甲基正離子容易形成,這是因為在形成叔丁基正離子的反應中,空間擁擠程度降低得多一些,而在形成甲基正離子的反應中,空間擁擠程度相對降低得少一些。空間效應是影響有機反應歷程的重要因素。空間位阻效應又稱立體效應。主要是指分子中某些原子或基團彼此接近而引起的空間阻礙和偏離正常鍵角而引起的分子內的張力。如乙二胺(在配位化學中簡寫為en)易生成二乙二胺合銅(II)離子,但N,N,N′,N′-四甲基乙二胺(tmen),由於每個N上有兩個甲基,空間位阻較大,不能生成。空間阻礙一般會降低反應速率,例如,在溴代烷的雙分子親核取代反應中,由於烷基體積的增大,引起空間阻礙,使反應速率變小。然而在有些反應中,立體效應有可能增加反應速率,例如,在單分子親核取代反應中,三烷基取代鹵代烷的烷基增大時,由於取代基之間的空間斥力,引起碳鹵鍵的異裂,導致碳正離子的形成,從而提高了反應速率。
鄰位基團空間阻礙可以影響分子的對稱性。鄰位基團的空間阻礙可以把、等共軛基團排斥於苯環的共軛體系之外,從而使該化合物的鍵長、極性、酸鹼性等分子的靜態物理化學性能發生極大的變化。
鄰位效應
鄰位效應
苯甲酸運用:苯甲酸對蘑菇酪氨酸酶的單酚酶和二酚酶活力的影響以及抑制作用機理。研究結果表明,苯甲酸對蘑菇酪氨酸酶的單酚酶和二酚酶活性均有抑制作用,其效應為可逆抑制效應。測定導致單酚酶活力和二酚酶活力下降50%的抑製劑濃度()分別為1.20和。苯甲酸對蘑菇酪氨酸酶的單酚酶的遲滯時間有明顯的延長效應,4mmol/L苯甲酸使得單酚酶的遲滯時間從42s延長到200s。測定苯甲酸對二酚酶的抑制作用表現為非競爭性抑制類型,測定抑制常數為0.95mmol/L。苯甲酸與酶的結合導致天然酶的內源熒光的量子產率下降,但熒光發射峰沒有位移。作者提出抑製劑與酶分子的作用模型。
二氯苯
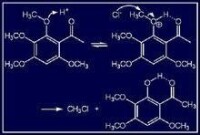
鄰位基團的空間阻礙可以把─NH、─NO等共軛基團排斥於苯環的共軛體系之外,從而使該化合物的鍵長極性、酸鹼性等分子的靜態物理化學性能發生極大的變化。例如化合物c中,由於硝基與對位氨基共軛,氨基上的孤電子對可轉移到硝基上去(c),它的偶極矩是6.18D。但化合物d中,由於鄰位甲基的空間阻礙,─NH和─NO基團平面偏離苯環平面,氨基上的電子對就不能轉移到硝基上去,它的偶極矩只有4.89D:
又如,由於氯原子的誘導效應,化合物e的酸性比化合物f、g為大。在化合物h、i中,由於化合物h是以分子間氫鍵為主,它的沸點可達295℃,而化合物i是以分子內氫鍵為主,它的沸點只有214℃。
鄰位效應對反應速率和反應機理也有影響例如,化合物j能與碘甲烷反應生成四級銨鹽,但化合物k中由於鄰位上的兩個甲基的空間阻礙,─N(CH)基團平面偏離苯環平面,使化合物k極難形成四級銨鹽。
化合物 1在通常條件下的酯化速率要比化合物m、n慢得多。但在濃硫酸中,由於正碳離子的生成,進攻基團可以從與苯環垂直的方向進攻反應中心,所以化合物的酯化反應能順利地進行。這時的酯化機理已發生變化。
在某種反應過程中,相鄰基團部分地或完全與反應中心相鍵合,使反應速率明顯增大,這種鄰位效應屬於鄰近基團的參與。例如,由於鄰近基團的參與,化合物p中的氯在沸水中易水解,但化合物q在同樣條件下卻是穩定的。
由於鄰位基團的這種特殊的效應,鄰位基團對分子性能的影響並不遵循哈米特方程。