共找到2條詞條名為細胞自噬的結果 展開
- 非常簡單的細胞活動
- 分解合成過程所須的中間代謝物的過程
細胞自噬
非常簡單的細胞活動
細胞自噬,所謂自噬作用,是指細胞在應對短暫的生存壓力時,可通過降解自身非必需成分來提供營養和能量,從而維持生命。相應地,自噬作用也可能降解潛在的毒性蛋白來阻止細胞損傷,或是阻止細胞的凋亡進程。然而自噬並不總是良性反應,它更像是在走投無路時進行的一場豪賭。
2016年諾貝爾獎生理學或醫學獎授予日本分子細胞生物學家大隅良典,以表彰他發現了細胞自噬的機制。
細胞自噬,所謂自噬作用(autophagy)是一個非常簡單的細胞活動,字面上也很好理解:自己吃自己。總體上看,動物細胞是一個三層結構:最外面是細胞膜,中間是細胞質,細胞核被包裹在最裡面。大部分功能性細胞器和生物分子都懸浮在細胞質中,因此,很多細胞活動都在細胞質中進行。由於生理生化反應多而複雜,經常產生大量殘渣,致使細胞活動受到影響甚至停滯,在這種情況下,自噬作用就非常重要:將淤積在細胞質中的蛋白質等代謝殘渣清除掉,恢復正常的細胞活動。
清理細胞質能讓細胞重獲新生,對於神經細胞這類不可替換的細胞來說,這個過程尤為重要。神經細胞一旦分化成熟,就會保持當前狀態,直到母體生物死去,它們沒有其他方式來恢復和維護自身功能。細胞生物學家還發現,自噬作用還能抵禦病毒和細菌的侵襲。任何躲過細胞外免疫系統,通過細胞膜進入細胞質的異物或微生物,都可能成為自噬系統的攻擊目標。
降解:所有活細胞的核心功能之一
20世紀50年代中期,科學家觀察到細胞里的一個新的專門“小隔間”(這種隔間的學名是細胞器),包含消化蛋白質,碳水化合物和脂質的酶。這個專門隔間被稱作“溶酶體”,相當於降解細胞成分的工作站。比利時科學家克里斯汀·德·迪夫(Christian de Duve)在1974年因為溶酶體和過氧化物酶體的發現,被授予諾貝爾生理學或醫學獎。
克里斯汀·德·迪夫,1974年獲得諾貝爾生理學或醫學獎,“自噬”這個詞的命名人。
60年代的新觀察表明,在溶酶體內部有時可以找到大量的細胞內部物質,乃至整個的細胞器。因此,細胞似乎有將大量的物質傳輸進溶酶體的策略。進一步的生化和顯微分析發現,有一種新型的囊泡負責運輸細胞貨物進入溶酶體進行降解(圖1)。發現溶酶體的科學家迪夫,創造了自噬(auotophagy)這個詞來描述這一過程。這種新的囊泡被命名為自噬體。
我們的細胞有不同的細胞“小隔間”,承擔不同的作用。溶酶體就是這樣一種隔間,裡面有用於消化細胞內容物的消化酶。人們在細胞內又觀察到了一種新型的囊泡,叫做自噬體。自噬體形成的時候,逐漸吞沒細胞內容物,例如受損的蛋白質和細胞器;然後它與溶酶體相融,其中的內容被降解成更小的物質成分。這一過程為細胞提供了自我更新所需的營養和材料。
圖1
在20世紀70年代和80年代,研究人員集中研究闡明用於降解蛋白質的另一個系統,即“蛋白酶體”。在這一研究領域,阿龍·切哈諾沃(Aaron Ciechanover),阿夫拉姆·赫什科(Avram Hershko)和歐文·羅斯(Irwin Rose)因為“泛素介導的蛋白質降解的發現”被授予2004年諾貝爾化學獎。蛋白酶體降解蛋白質的效率很高,一個個單個降解蛋白質,但這個機制沒有解釋細胞是怎麼解決更大的蛋白質複合物以及破舊的細胞器的。
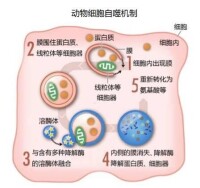
圖為自噬機制
這一概念最早出現於上世紀1960年代,當時研究人員發現細胞能夠消滅自身內部物質,方式是將其包裹進一個膜結構中,從而形成小型囊體並被輸運至被稱作“溶酶體”的回收機構進行分解。對這一過程開展研究非常困難,這也就意味著我們對其知之甚少。
直到上世紀1990年代,在經過一系列出色的實驗之後,日本科學家大隅良典利用麵包酵母找到了與自噬作用有關的關鍵基因。隨後他開始致力於闡明酵母菌體內自噬作用的背後機制,並發現與之相似的複雜過程也同樣存在於我們人類的細胞內。大隅良典的研究更新了我們關於細胞物質循環的舊有觀點,他的研究開啟了理解自噬作用在許多生理過程中關鍵作用的嶄新道路,如生物體對於飢餓的適應或者機體對於感染的反應。自噬基因的突變會導致疾病的發生,自噬作用機制在一些類型的疾病,如癌症和神經疾病等病症中也發揮了作用。
20世紀70年代至80年代,研究人員主要專註於研究另一套用來降解蛋白質的系統,即“蛋白酶體”(proteasome)。在該研究領域,阿龍-切哈諾沃(Aaron Ciechanover)、阿夫拉姆-赫什科(Avram Hershko)和美國科學家歐文-羅斯(Irwin Rose)被授予2004年諾貝爾化學獎,以表彰他們在泛素調節的蛋白質降解研究領域中的卓越成就。蛋白酶體雖然能有效地逐步降解蛋白質,但該機制仍未能解釋細胞是如何消除大型蛋白質複合物和受損的細胞器。
開創性實驗
大隅良典活躍於多個研究領域,但在他於1988年最初建立自己實驗室的時候,他主要致力於對液泡內的蛋白質降解進行研究,液泡的地位就類似於人體細胞內的溶酶體。酵母細胞相對比較容易開展研究,因此它們常被科學家們用做人類細胞模型。它們對於鎖定複雜細胞機制背後的特定基因尤其有效。但大隅良典正面臨一項挑戰:酵母細胞很小,在顯微鏡能夠下它們的細胞器並不容易分辨出來。因此此時的大隅良典甚至還不能確認在這種細胞內部是否存在自噬現象。
他推理認為,如果他能夠打斷正在進行中的細胞物質自噬降解過程,那麼液泡內部就應該會聚集大量的自噬小體,從而在顯微鏡下變得可見。於是他培養了經過改造,缺乏液泡膜降解酶的酵母菌並通過飢餓的方法激活細胞的自噬機制。這一實驗得到的結果是驚人的!在短短几小時內,細胞液泡內快速聚集起大量未能被降解的小型囊體。
這些小型囊體是自噬小體。大隅良典的實驗證明在酵母菌內部同樣存在自噬作用。但更加重要的是,他現在有了一種方法去識別並觀察在細胞自噬機制背後起到關鍵作用的基因。這是一項突破性的進展,大隅良典在1992年發表的文章里相信進行了報告。
發現自噬基因
大隅良典開始利用其所克隆的酵母菌。在酵母菌被餓死的過程中,自噬體就會被積累。但如果自噬基因是滅活的,該積累過程就不會出現。大隅良典將酵母細胞暴露在一種化學物質下,隨意引入多個基因的突變后,開始誘導自噬。這種做法奏效了!在發現酵母自噬現象后的一年內,大隅良典又發現了導致自噬的第一個基因。在後來的一系列研究中,由這些基因所編碼的蛋白質也被從功能層面上被識別。這些研究結果表明,自噬由一連串的蛋白質和蛋白質複合物所控制,每一個都掌管著自噬體的萌生和形成的不同階段。
自噬—人類細胞的一個重要機制
在發現酵母自噬機制后,一個核心問題油然而生:在其他生物體中是否也有一個相應的機制來控制這一過程?很快就有了答案,在人類細胞中也運行著幾乎同樣的機制。如今,用於研究人體自噬重要性的工具也已經誕生。
細胞自噬主要有三種形式:微自噬(microautophagy)、巨自噬(macroautophagy)和分子伴侶介導的自噬 (Chaperone-mediated autophagy,CMA)。
定義:指溶酶體或者液泡內膜直接內陷底物包裹並降解的過程。
作用時間:多在種子成熟時儲藏蛋白的沉積或萌發時儲存蛋白的降解中起作用。
定義:在其過程中,底物蛋白被一種雙層膜的結構(粗面內質網的無核糖體附著區脫落的雙層膜)包裹后形成直徑約400-900納米大小的自噬小泡(autophagosome),接著自噬小泡的外膜與溶酶體膜或者液泡膜融合,釋放包裹底物蛋白的泡狀結構到溶酶體或者液泡中,並最終在一系列水解酶的作用下將其降解,我們將這種進入溶酶體或者液泡腔中的泡狀結構稱為自噬小體。
作用時間:營養缺乏條件下培養的細胞、植物的免疫反應、葉片衰老及環境脅迫應答。
在動物細胞衰老反應過程中,往往發生分子伴侶介導的自噬過程,保存必須的組成細胞結構的蛋白和其他材料。
誘導劑(1) Bredeldin A / Thapsigargin / Tunicamycin :模擬內質網應激(2) Carbamazepine/ L-690,330/ Lithium Chloride(氯化鋰):IMPase 抑製劑(即Inositol monophosphatase,肌醇單磷酸酶)(3) Earle's平衡鹽溶液:製造飢餓(4) N-Acetyl-D-sphingosine(C2-ceramide):Class I PI3K Pathway抑製劑(5) Rapamycin:mTOR抑製劑(6) Xestospongin B/C:IP3R阻滯劑抑製劑(1) 3-Methyladenine(3-MA):(Class III PI3K) hVps34 抑製劑(2) Bafilomycin A1:質子泵抑製劑(3) Hydroxychloroquine(羥氯喹):Lysosomal lumen alkalizer(溶酶體腔鹼化劑)除了選用上述工具葯外,一般還需結合遺傳學技術對自噬相關基因進行干預:包括反義RNA干擾技術(Knockdown)、突變株篩選、外源基因導入等。觀察檢測細胞經誘導或抑制后,需對自噬過程進行觀察和檢測,常用的策略和技術有:1、觀察自噬體的形成由於自噬體屬於亞細胞結構,普通光鏡下看不到,因此,直接觀察自噬體需在透射電鏡下。Phagophore的特徵為:新月狀或杯狀,雙層或多層膜,有包繞胞漿成分的趨勢。自噬體(AV1)的特徵為:雙層或多層膜的液泡狀結構,內含胞漿成分,如線粒體、內質網、核糖體等。自噬溶酶體(AV2)的特徵為:單層膜,胞漿成分已降解。(autophagic vacuole,AV)2、在熒光顯微鏡下採用GFP-LC3融合蛋白來示蹤自噬形成由於電鏡耗時長,不利於監測(Monitoring)自噬形成,人們利用LC3在自噬形成過程中發生聚集的現象開發出了此技術。無自噬時,GFP-LC3融合蛋白彌散在胞漿中;自噬形成時,GFP-LC3融合蛋白轉位至自噬體膜,在熒光顯微鏡下形成多個明亮的綠色熒光斑點,一個斑點相當於一個自噬體,可以通過計數來評價自噬活性的高低。3、利用Western Blot檢測LC3-II/I比值的變化以評價自噬形成自噬形成時,胞漿型LC3(即LC3-I)會酶解掉一小段多肽,轉變為(自噬體)膜型(即LC3-II),因此,LC3-II/I比值的大小可估計自噬水平的高低。(注意:LC3抗體對LC3-II有更高的親和力,會造成假陽性。方法2和3需結合使用,同時需考慮溶酶體活性的影響。)4、檢測長壽蛋白的批量降解:非特異5、MDC(Monodansylcadaverine,單丹磺醯屍胺)染色:包括自噬體,所有酸性液泡都被染色,故屬於非特異性的。6、CellTrackerTM Green染色:主要用於雙染色,但其能染所有的液泡,故也屬於非特異性的。蛋白定位在研究自噬相關蛋白時,需對其進行定位。由於自噬體與溶酶體、線粒體、內質網、高爾基體關係密切,為了區別,常用到一些示蹤蛋白在熒光顯微鏡下來共定位:Lamp-2:溶酶體膜蛋白,可用於監測自噬體與溶酶體融合。LysoTrackerTM 探針:有紅或藍色可選,顯示所有酸性液泡。pDsRed2-mito:載體,轉染后表達一個融合蛋白(紅色熒光蛋白+線粒體基質定位信號),可用來檢測線粒體被自噬掉的程度(Mitophagy)。MitoTraker探針:特異性顯示活的線粒體,熒光在經過固定后還能保留。Hsp60:定位與線粒體基質,細胞死亡時不會被釋放。Calreticulin(鈣網織蛋白):內質網腔
揭示機制
加州大學聖地亞哥分校的管坤良教授領導的一支研究團隊揭示了調控細胞自噬的一個關鍵分子機制,研究人員發現,AMPK酶,不僅參與了細胞的感測和能量調控,而且在細胞自噬酶作用方面,也扮演了重要角色。細胞自噬是細胞在惡劣條件下確保其生存的基本應激反應。研究人員發現,AMPK能以不同的方式,調控一種稱為Vps34激酶家族不同的複合物,一些Vps34酶參與了正常細胞的囊泡運輸——細胞中一種重要的分子運輸,還有一些Vps34複合物則參與了細胞自噬。管教授與其同事們發現,AMPK能抑制那些未參與細胞自噬的酶,而激活參與細胞自噬的Vps34酶。
近年來科學家發現,細胞自噬作用與生物發育以及許多人類疾病,如衰老、腫瘤、感染與免疫、心血管疾病、肌肉病變及神經退化性疾病等密切相關。
應該說細胞自噬受到熱捧的一個很重要原因就在於其與疾病的關聯,首當其衝是衰老。
細胞自噬的典型特徵是形成自噬體並呈遞給溶酶體,這一過程在蛋白質和細胞器質量控制中起基礎作用並維持了細胞能量的穩態。一些研究表明,自噬與細胞衰老密切相關,參與蛋白酶和自噬相關調節的BAG蛋白家族中BAG3/BAG1比值在複製性衰老時增高,且BAG3在細胞衰老時能介導自噬的激活。研究還發現在Ras誘導的細胞衰老進程中亦可觀察到較高的自噬活性。
其次是包括帕金森症在內的一些神經退行性疾病,2013年的一項研究就指出一種與細胞自噬作用相關的基因若出現異常,會導致一種罕見的腦病。這種罕見腦病被稱作“伴隨成人期神經退行性變性的兒童期靜態腦病”(SENDA),患者大腦萎縮並伴隨認知障礙。
當時參與研究的科學家指出,自噬作用的異常,比如負責運送蛋白到溶酶體的自噬CMA過程出了問題,都有可能導致認知障礙。
另外一大類就是與腫瘤的關係,近年來大量的研究表明,自噬與腫瘤的發生髮展密切相關,許多調節自噬的藥物被用於臨床腫瘤治療的研究中。
雖然到目前為止激活細胞自噬來預防腫瘤發生的直接臨床依據稍顯不足,但自噬在腫瘤早期發生過程中的抑制作用已被廣泛證實, 因此適當地提高基礎自噬水平可能成為未來腫瘤預防的重要措施。
瑞典斯德哥爾摩當地時間2016年9月3日中午11時30分,2016年諾貝爾生理學或醫學獎授予日本分子細胞生物學家大隅良典(Yoshinori Ohsumi),以表彰他發現了細胞自噬的機制。
大隅良典生於1945年,是東京工業大學教授、分子細胞生物學家。他將獲得今年諾貝爾生理學或醫學獎的獎金800萬瑞典克朗(約合93.33萬美元)。