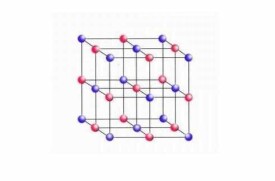
晶體結構
晶體中實際質點的具體排列情況
晶體以其內部原子、離子、分子在空間作三維周期性的規則排列為其最基本的結構特徵。任一晶體總可找到一套與三維周期性對應的基向量及與之相應的晶胞,因此可以將晶體結構看作是由內含相同的具平行六面體形狀的晶胞按前、后、左、右、上、下方向彼此相鄰“並置”而組成的一個集合。晶體學中對晶體結構的表達可採取原子分立分佈的方式,亦可用具連續分佈的電子密度函數的方式。

晶體結構
晶體是各向異性的均勻物體。生長良好的晶體,外觀上往往呈現某種對稱性(圖1)。從微觀來看,組成晶體的原子在空間呈周期重複排列(圖2)。即以晶體中的原子或其集合為基點,在空間中三個不共面的方向上,各按一定的點陣周期,不斷重複出現。如從重複出現的每個基元中各取某一相當點,則這些點合在一起形成一個空間點陣的一部分,圖3a為其示意圖。確切地說,點陣是一組按連接其中任何兩點的矢量進行平移后而能復原的點的重複排列。
空間點陣是認識晶體結構基本特徵的關鍵之一,用它可以方便而又清楚地說明晶體的微觀結構在宏觀中所表現出的面角守恆、有理指數等定律以及X射線衍射的幾何關係。各點分佈在同一直線上的點陣稱為直線點陣,分佈在同一平面中者稱為平面點陣,而分佈在三維空間中者稱為空間點陣。如圖3a所示,空間點陣可以分解為各組平行的直線點陣或平面點陣,並可劃分成並置的平行六面體單位。規定這個單位的矢量為a、b和c,如圖3b所示。空間點陣劃分成一個個並置的平行六面體單位后,若點陣中各點都位於各平行六面體的頂點處,則此單位只攤到一個點,稱為素單位。平行六面體單位也可在面上或體內帶心,攤到一個以上的點,成為復單位。按照空間點陣的平行六面體單位,可劃分成晶體結構的單位,這樣的單位稱為晶胞。
晶體的一些宏觀規律性反映了它微觀結構中具有長程序的空間點陣形式。晶體之所以不同於一般具有短程序的非晶態固體和液體而成為各向異性體,與此有關。晶體外形為晶面構成的多面體,而晶面必與空間點陣中一組平面點陣平行,晶棱則與某一直線點陣組平行。在同一種晶體上兩個給定晶面之間的交角是兩組相應的點陣平面之間的交角,從而是常數。

晶體結構
有了點陣概念就可以將晶體結構用下述所謂公式來簡單表示:
晶體結構= 點陣+ 結構基元
在晶體的外形以及其他宏觀表現中還反映了晶體結構的對稱性。晶體的理想外形或其結構都是對稱圖象。這類圖象都能經過不改變其中任何兩點間距離的操作后復原。這樣的操作稱為對稱操作,平移、旋轉、反映和倒反都是對稱操作。能使一個圖象復原的全部不等同操作,形成一個對稱操作群。在晶體結構中空間點陣所代表的是與平移有關的對稱性,此外,還可以含有與旋轉、反映和倒反有關並能在宏觀上反映出來的對稱性,稱為宏觀對稱性,它在晶體結構中必須與空間點陣共存,並互相制約。制約的結果有二:①晶體結構中只能存在1、2、3、4和6次對稱軸,②空間點陣只能有 14種形式。n次對稱軸的基本旋轉操作為旋轉360°/n,因此,晶體能在外形和宏觀中反映出來的軸對稱性也只限於這些軸次。
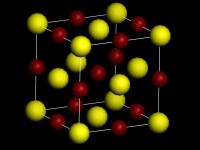
晶體結構
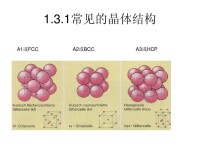
晶體可以由原子、離子或分子結合而成。例如非金屬的碳原子通過共價鍵可以形成金剛石晶體。金屬的鈉原子與非金屬的氯原子可以先分別形成Na和Cl離子,然後通過離子鍵結合成氯化鈉晶體,每個離子周圍是異號離子。離子結合而成的晶體稱為離子晶體。在有些晶體中原子可以先結合成分子,然後通過分子間鍵或范德華(Van der Waals)力結合成晶體。如非金屬的硫原子先通過共價鍵形成王冠狀的S分子,然後再通過范德華力形成硫黃晶體。又如在石墨中碳原子先通過共價鍵形成層型分子,然後通過范德華力結合成晶體。在層型分子內部,化學鍵是連亘不斷的。礦物主要以金屬氧化物、硫化物以及硅酸鹽晶體的形式存在,它們一般為離子晶體。金屬原子通過金屬鍵結合而成金屬晶體。典型結構有A、A和A型等三種。晶體中每一原子周圍所具有的,與其等距離的最近鄰的原子數目叫配位數。
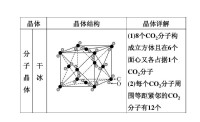
晶體結構
由於原子並不處於靜止狀態,存在著外來原子引起的點陣畸變以及一定的缺陷,基本結構雖然仍符合上述規則性,但絕不是如設想的那樣完整無缺,存在數目不同的各種形式的晶體缺陷。另外還必須指出,絕大多數工業用的金屬材料不是只由一個巨大的單晶所構成,而是由大量小塊晶體組成,即多晶體。在整塊材料內部,每個小晶體(或稱晶粒)整個由三維空間界面與它的近鄰隔開。這種界面稱晶粒間界,簡稱晶界。晶界厚度約為兩三個原子。
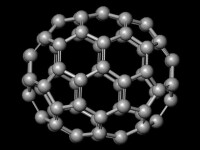
晶體結構
人們很早就注意一些具有規則幾何外形的固體,如岩鹽、石英等,並將其稱為晶體。顯然,這是不嚴格的,它不能反映出晶體內部結構本質。事實上,晶體在形成過程中,由於受到外界條件的限制和干擾,往往並不是所有晶體都能表現出規則外形;一些非晶體,在某些情況下也能呈現規則的多面體外形。因此,晶體和非晶體的本質區別主要並不在於外形,而在於內部結構的規律性。迄今為止,已經對五千多種晶體進行了詳細的X射線研究,實驗表明:組成晶體的粒子(原子、離子或分子)在空間的排列都是周期性的有規則的,稱之為長程有序;而非晶體內部的分佈規律則是長程無序。
各種晶體由於其組分和結構不同,因而不僅在外形上各不相同,而且在性質上也有很大的差異,儘管如此,在不同晶體之間,仍存在著某些共同的特徵,主要表現在下面幾個方面。
晶體物質在適當的結晶條件下,都能自發地成長為單晶體,發育良好的單晶體均以平面作為它與周圍物質的界面,而呈現出凸多面體。這一特徵稱之為晶體的自范性。

晶體結構
當晶體受到敲打、剪切、撞擊等外界作用時,可有沿某一個或幾個具有確定方位的晶面劈裂開來的性質。如固體雲母(一種硅酸鹽礦物)很容易沿自然層狀結構平行的方向劈為薄片,晶體的這一性質稱為解理性,這些劈裂面則稱為解理面。自然界的晶體顯露於外表的往往就是一些解理面。
晶體的物理性質隨觀測方向而變化的現象稱為各向異性。晶體的很多性質表現為各向異性,如壓電性質、光學性質、磁學性質及熱學性質等。例如:石墨的電導率,當我們沿晶體不同方向測其電導率時,得到方向不同而石墨的電導率數值也不同的結果。
晶體結構
實驗表明:從氣態、液態或非晶態過渡到晶體時都要放熱,反之,從晶態轉變為非晶態、液態或氣態時都有要吸熱。表明:在相同的熱力學條件下,與同種化學成分的氣體、液體或非晶體相比,晶體的內能最小。即在相同的熱力學條件下,以具有相同化學成分的晶體與非晶體相比,晶體是穩定的,非晶體是不穩定的,後者有自發轉變為晶體的趨勢。
晶體具有固定的熔點。當加熱晶體到某一特定的溫度時,晶體開始熔化,且在熔化過程中保持溫度不變,直至晶體全部熔化后,溫度才又開始上升。如圖1-1-3所示:石英的熔點是1470℃,硅單晶的熔點是 1420℃。
晶體結構