非組蛋白
非組蛋白
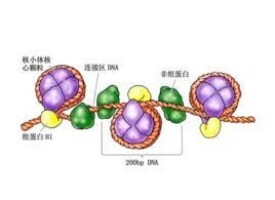
非組蛋白是細胞核中組蛋白以外的蛋白,包括以DNA 為底物的酶以及作用於組蛋白的一些酶,如組蛋白甲基化酶,此外還有DNA 結合蛋白、組蛋白結合蛋白和調控蛋白。非組蛋白具有多樣性和異質性,不同組織細胞中其種類和數目都不相同。非組蛋白對DNA 具有識別特異性,識別信息來源於DNA 核苷酸序列本身,識別位點存在於DNA 雙螺旋的大溝部分。識別與結合靠氫鍵和離子鍵。在不同的基因組之間,這些非組蛋白所識別的DNA 序列是保守的。非組蛋白具有多方面的重要功能,包括基因表達的調控和染色質高級結構的形成,如幫助DNA 分子摺疊,以形成不同的結構域協助啟動DNA 複製,控制基因轉錄,調節基因表達。
首先製備一段帶有放射性標記的已知特異序列的DNA,將要檢測的細胞抽提物與標記DNA混合,進行凝膠電泳。
未結合蛋白的自由DNA在凝膠上遷移最快,而與蛋白質結合的DNA遷移慢,一般結合的蛋白質分子越大,DNA分子的延滯現象越明顯,然後通過放射性自顯影分析,即可發現一系列DNA帶譜,每條帶分別代表不同的DNA-蛋白質複合物。每條帶相對應的結合蛋白隨後再通過細胞抽提物組分分離方法被進一步分開。
1、酸鹼性:組蛋白是鹼性的,而非組蛋白則大多是酸性的。
2、多樣性:非組蛋白占染色質蛋白的60%~70%,不同組織細胞中其種類和數量都不相同,代謝周轉快。包括多種參與核酸代謝與修飾的酶類如DNA聚合酶和RNA聚合酶、HMG蛋白(high mobility group protein)、染色體支架蛋白、肌動蛋白和基因表達蛋白等。
3、特異性:能識別特異的DNA序列,識別信息來源於DNA核苷酸序列本身,識別位點存在於DNA雙螺旋的大溝部分,識別與結合靠氫鍵和離子鍵。在不同的基因組之間,這些非組蛋白所識別的DNA序列在進化上是保守的。這類序列特異性DNA結合蛋白具有一個共同特徵,即形成與DNA結合的螺旋區並具有蛋白二聚化的能力。
4、功能多樣性:雖然與DNA特異序列結合的蛋白質在每一個真核細胞中只有10 000個分子左右,約佔細胞總蛋白的1/50 000,但具有多方面的重要功能,包括基因表達的調控和染色質高級結構的形成。如幫助DNA分子摺疊,以形成不同的結構域;協助啟動DNA複製,控制基因轉錄,調節基因表達等。
雖然非組蛋白種類眾多,但是根據它們與DNA結合的結構域不同,可分為不同的家族。
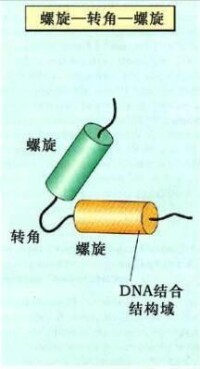
α螺旋-轉角-α螺旋模式
(helix - turn - helix motif)
非組蛋白
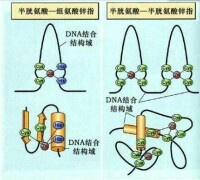
鋅指模式
(zinc finger motif)
非組蛋白
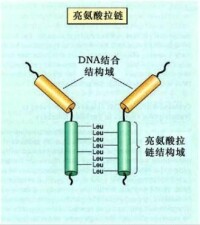
亮氨酸拉鏈模式
非組蛋白
螺旋-環-螺旋結構模式
(helix - loop - helix motif,HLH)
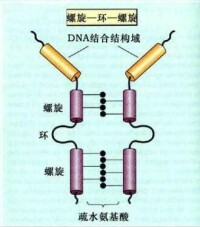
非組蛋白
HMG框結構模式
(HMG-box motif)
在發現一組豐富的高速泳動族蛋白(high mobility group protein)以後,首先命名HMG框結構模式。該結構由3個α螺旋組成 boomerang-shaped 結構模式,具有彎曲DNA的能力。因此,具有HMG框結構的轉錄因子又稱為“構件因子(architectural factor)”,它們通過彎曲DNA、促進與鄰近位點相結合的其他轉錄因子的相互作用而激活轉錄。SRY是一種HMG蛋白,在人類男性性別分化中具有關鍵作用,HMG蛋白由Y染色體上一個基因編碼,在誘導睾丸分化途徑中一些相關基因的轉錄活性被HMG蛋白所激活。
1、酶(RNA合成酶、蛋白質磷酸化酶等);
2、遺傳信息的保持和表達調節(HMG14,HMG17及許多酸性染色體蛋白質);
3、染色體的結構支持體(matrix protein,基質蛋白質等;scaffold protein,支架蛋白質)等。