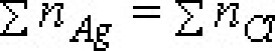沉澱滴定法
以沉澱反應為基礎的滴定分析法
是以沉澱反應為基礎的一種滴定分析方法。
沉澱滴定法必須滿足的條件:1.S小,且能定量完成;2.反應速度大;3.有適當指示劑指示終點;4.吸附現象不影響終點觀察。
福爾哈德法
①直接滴定法。在含Ag的酸性試液中,加為指示劑,以為滴定劑,先生成白色沉澱,當紅色的出現時,表示已被定量沉澱,終點已到達。此法主要用於測。
②返滴定法。在含鹵素離子的酸性溶液中,先加入一定量的過量的標準溶液,再加指示劑,以標準溶液滴定過剩的,直到出現紅色為止。兩種試劑用量之差即為鹵素離子的量。此法的優點是選擇性高,不受弱酸根離子的干擾。但用本法測時,宜加入硝基苯,將沉澱包住,以免部分的由沉澱轉入溶液。
在中性或弱鹼性的含試液中加入吸附指示劑熒光黃,當用滴定時,在等當點以前,溶液中過剩,AgCl沉澱的表面吸附而帶負電,指示劑不變色。在等當點后,過剩,沉澱的表面吸附而帶正電,它會吸附荷負電的熒光黃離子,使沉澱表面顯示粉紅色,從而指示終點已到達。此法的優點是方便。
原則
此法又稱銀量法。
雖然可定量進行的沉澱反應很多,但由於缺乏合適的指示劑,而應用於沉澱滿定的反應並不多,目前比較有實際意義的是銀量法。因此本人將銀量法用兩種表達方式集合一起給大家參考,希望能讓大家都掌握這個方法。
沉澱滴定法:根據其確定終點指示劑的方法不同常分為三種。
指示劑
(一)原理:以標準溶液測定為例
終點前:
終點時:
沉澱的溶解度S:
二甲基二碘熒光黃>>曙紅>>熒光黃或二氯熒光黃
計量點附近終點出現的早晚與溶液中[]有關:
過大------終點提前------結果偏低(-TE%)
過小-------終點推遲------結果偏高(+TE%)
(二)指示劑用量(濃度)
理論計算:
在計量點時,溶液中物質的量應等於物質的量若計量點時溶液的體積為100ml,實驗證明,在100ml溶液中,當能覺察到明顯的磚紅色出現時,需用去物質的量為,即:
實際滴定中:因為本身呈黃色,按加入,則黃顏色太深而影響終點觀察,實驗中,採用濃度為範圍比較理想。(計算可知此時引起的誤差)
在實驗中:50~100ml溶液中加入5%1ml。
(三)滴定條件
1.溶液的酸度
通常溶液的酸度應控制在(中性或弱鹼性),
若酸度高,則:
若鹼性太強:
當溶液中有少量存在時,則應控制在:
2.沉澱的吸附現象先生成的易吸附使溶液中,終點提前,滴定時必須劇烈搖動。吸附更強。
3.干擾離子的影響
①能與Ag+生成沉澱的陰離子()
②能與生成沉澱的陽離子()
③在弱鹼性條件下易水解的離子()
④大量的有色離子()都可能幹擾測定,應預先分離。
鐵銨礬[]指示劑
(一)原理:
沉澱滴定法
終點出現早晚與大小有關。
(二)滴定條件
1.溶液的酸度——在硝酸的酸性條件下進行
2.直接滴定法測定時,吸附,近終點時劇烈搖動
3.返滴定法測定時:
大
小
終點時:(紅)發生轉化作用:
致使,已生成的離解,紅色消失,多消耗,造成較大誤差,常採取預防措施:
(2)近終點時,防止劇烈搖動;

沉澱滴定法
吸附指示劑
(一)原理:
吸附指示劑大多是有機酸------當被沉澱表面吸附后------結構發生變化------顏色發生變化
例:用溶液滴定,採用有機酸熒光黃指示劑(HFIn),為指示劑:
(黃綠色)
計量點前:(白色)
吸附構晶離子

沉澱滴定法
黃綠色粉紅色
(二)滴定條件
1.加入膠體保護劑——糊精或澱粉
2.酸度:一般在中性、弱鹼性、弱酸性溶液中進行
HFIn分子不易被吸附,FIn-陰離子存在與Ka有關.
Ka-允許酸度越高(pH值ˉ)
如:曙紅Ka較大,pH32以上使用;
而熒光黃Ka較小,pH37以上使用。
但:最高pH二甲基二碘熒光黃>Br->曙紅>>熒光黃或二氯熒光黃
以硝酸銀液為滴定液,測定能與Ag+反應生成難溶性沉澱的一種容量分析法。
以硝酸銀液為滴定液,測定能與Ag+生成沉澱的物質,根據消耗滴定液的濃度和毫升數,可計算出被測物質的含量。
反應式:
X-表示等離子。
(一)鉻酸鉀指示劑法
1.原理
用滴定液滴定氯化物、溴化物時採用鉻酸鉀作指示劑的滴定方法。滴定反應為:
終點前
終點時(磚紅色)
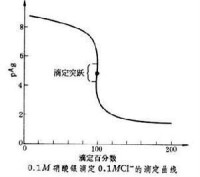
根據分步沉澱的原理,溶度積(Ksp)小的先沉澱,溶度積大的后沉澱。由於AgCl的溶解度小於AgCrO的溶解度,當Ag+進入濃度較大的溶液中時,AgCl將首先生成沉澱,而,AgCrO不能形成沉澱;隨著滴定的進行,Cl濃度不斷降低,Ag濃度不斷增大,在等當點后發生突變,
,於是出現磚紅色沉澱,指示滴定終點的到達。
2.滴定條件
(1)終點到達的遲早與溶液中指示劑的濃度有關。為達到終點恰好與等當點一致的目的,必須控制溶液中CrO的濃度。每50~100ml滴定溶液中加入5%(W/V)KCrO溶液1ml就可以了。
(2)用KCrO作指示劑,滴定不能在酸性溶液中進行,因指示劑KCrO是弱酸鹽,在酸性溶液中CrO依下列反應與H離子結合,使CrO濃度降低過多,在等當點不能形成AgCrO沉澱。
也不能在鹼性溶液中進行,因為Ag將形成AgO沉澱:
滴定不能在氨性溶液中進行,因AgCl和AgCrO皆可生成[Ag(NH)]而溶解。
3.主要應用
本法多用於的測定。
(二)硫酸鐵銨指示劑法
1.原理
在酸性溶液中,用(或KSCN)為滴定液滴定,以為指示劑的滴定方法。滴定反應為:
終點前
終點時(淡棕紅色)
鹵化物的測定可用回滴法,需向檢品溶液中先加入定量過量的滴定液,以為指示劑,用滴定液回滴剩餘的,滴定反應為:
終點前
終點時(淡棕紅色)
這裡需指出,當滴定Cl-到達等當點時,溶液中同時有AgCl和AgSCN兩種難溶性銀鹽存在,若用力振搖,將使已生成的絡離子的紅色消失。因AgSCN的溶解度小於AgCl的溶解度。當剩餘的被滴定完后,就會將AgCl沉澱中的Ag+轉化為AgSCN沉澱而使重新釋出。
↓
這樣,在等當點之後又消耗較多的滴定液,造成較大的滴定誤差。
2.滴定條件及注意事項
(1)為了避免上述轉化反應的進行,可以採取下列措施:
a將生成的AgCl沉澱濾出,再用NH4SCN滴定液滴定濾液,但這一方法需要過濾、洗滌等操作,手續較繁。
b在用NH4SCN滴定液回滴之前,向待測Cl-溶液中加入1~3ml硝基苯,並強烈振搖,使硝基苯包在AgCl的表面上,減少AgCl與SCN-的接觸,防止轉化。此法操作簡便易行。
(2)此外,用本法時,應注意下列事項:
a為防止的水解,應在酸性溶液中進行滴定,在酸性溶液中,及等離子的存在也不干擾。與鉻酸鉀指示劑法相比,這是本法的最大優點。
b為避免由於沉澱吸附Ag+過早到達終點,在用硝基苯包裹AgCl沉澱時,臨近終點應輕輕旋搖,以免沉澱轉化,直到溶液出現穩定的淡棕紅色為止。
d滴定不宜在較高溫度下進行,否則紅色絡合物褪色。
(三)吸附指示劑法
1.原理
用液為滴定液,以吸附指示劑指示終點,測定鹵化物的滴定方法。
若以Fl-代表熒光黃指示劑的陰離子,則變化情況為:
終點前Cl-過量
終點時Ag+過量
吸附
(黃綠色)(微紅色)
2.滴定條件
為了使終點顏色變化明顯,應用吸附指示劑時需要注意以下幾個問題:
(1)吸附指示劑不是使溶液發生顏色變化,而是使沉澱的表面發生顏色變化。因此,應儘可能使鹵化銀沉澱呈膠體狀態,具有較大的表面。為此,在滴定前應將溶液稀釋並加入糊精、澱粉等親水性高分子化合物以形成保護膠體。同時,應避免大量中性鹽存在,因為它能使膠體凝聚。
(2)膠體顆粒對指示劑離子的吸附力,應略小於對被測離子的吸附力,否則指示劑將在等當點前變色。但對指示劑離子的吸附力也不能太小,否則等當點后也不能立即變色。滴定鹵化物時,鹵化銀對鹵化物和幾種常用的吸附指示劑的吸附力的大小次序如下:
I->二甲基二碘熒光黃>Br->曙紅>Cl->熒光黃
因此在測定Cl-時不能選用曙紅,而應選用熒光黃為指示劑。
(3)溶液的pH應適當,常用的吸附指示劑多是有機弱酸,而起指示劑作用的是它們的陰離子。因此,溶液的pH應有利於吸附指示劑陰離子的存在。也就是說,電離常數小的吸附指示劑,溶液的pH就要偏高些;反之,電離常數大的吸附指示劑,溶液的pH就要偏低些。
(4)指示劑的離子與加入滴定劑的離子應帶有相反的電荷。
(5)帶有吸附指示劑的鹵化銀膠體對光線極敏感,遇光易分解析出金屬銀,在滴定過程中應避免強光照射。
(一)硝酸銀滴定液
1.配製間接法配製
2.標定用基準氯化鈉標定,以熒光黃指示液指示終點。
3.貯藏置玻璃塞的棕色玻瓶中,密閉保存。
(二)硫氰酸銨滴定液
1.配製間接法配製
2.標定用硝酸銀滴定液標定,以硫酸鐵銨指示液指示終點。
1.用鉻酸鉀指示劑法,必須在近中性或弱鹼性溶液(pH6.5~10.5)中進行滴定。因鉻酸鉀是弱酸鹽,在酸性溶液中,與結合,降低濃度,在等當點時不能立即生成鉻酸銀沉澱;此法也不能在鹼性溶液中進行,因銀離子氫氧根離子生成氧化銀沉澱。
2.應防止氨的存在,氨與銀離子生成可溶性絡合物,干擾氯化銀沉澱生成。
5.滴定應在室溫進行,溫度高,紅色絡合物易褪色。
6.滴定時需用力振搖,避免沉澱吸附銀離子,過早到達終點。但滴定接近終點時,要輕輕振搖,減少氯化銀與接觸,以免沉澱轉化。
7.吸附指示劑法,滴定前加入糊精、澱粉,形成保護膠體,防止沉澱凝聚使吸附指示劑在沉澱的表面發生顏色變化,易於觀察終點。滴定溶液的pH值應有利於吸附指示劑的電離,隨指示劑不同而異。
8.吸附指示劑法選用指示劑應略小於被測離子的吸附力,吸附力大小次序為I->二甲基二碘熒光黃>Br->曙紅>Cl->熒光黃。
9.滴定時避免陽光直射,因鹵化銀遇光易分解,使沉澱變為灰黑色。
10.有機鹵化物的測定,由於有機鹵化物中鹵素結合方式不同,多數不能直接採用銀量法,必須經過適當處理,使有機鹵素轉變成鹵離子后再用銀量法測定。
1.鉻酸鉀指示劑法:在中性或弱鹼性溶液中用硝酸銀滴定液滴定氯化物、溴化物時採用鉻酸鉀指示劑的滴定方法。
2.硫酸鐵銨指示劑法:在酸性溶液中,用硫氰酸銨液為滴定液滴定,採用硫酸鐵銨為指示劑的滴定方法。
3.吸附指示劑法:用硝酸銀液為滴定液,以吸附指示劑指示終點測定鹵化物的滴定方法。
本法的相對偏差不得超過0.3%。