氧合肌紅蛋白
氧合肌紅蛋白
氧合肌紅蛋白紅蛋白存在於肌肉中,心肌中含量特別豐富。抹香鯨紅蛋白三級結構於1960年由Kendrew用X線衍射法闡明,這是世界上第一個被描述的蛋白質三級結。由於三級結構與蛋白質的生物學功能直接相關,而且三級結構的分析工作難度很高,所以這項工作獲得學術界的高度評價。
肌紅蛋白分子由分子量約17000的一條肽鏈組成,含153 個氨基酸殘基。
本質:肌紅蛋白=一條多肽鏈+一個輔基多肽鏈:由153個氨基酸殘基組成
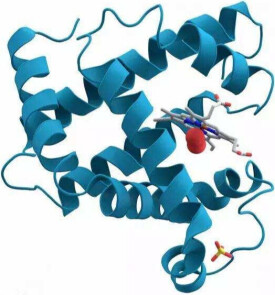
功能:在肌肉中有運輸氧和儲氧功能肌紅蛋白的三級結構
多肽鏈中氨基酸殘基上的疏水側鏈大都在分子內部,疏水側鏈多位於分子表面,因此其水溶性較好。
三級結構
有8段α-螺旋區
每個α-螺旋區含7~24個氨基酸殘基,分別稱為A、B、C…G及H肽段。
有1~8個螺旋間區
肽鏈拐角處為非螺旋區(亦稱螺旋間區),包括N端有2個氨基酸殘基,C端有5個氨基酸殘基的非螺旋區
內部存在一口袋形空穴,血紅素居於此空穴中
氧合肌紅蛋白有8段α-螺旋區,每個α-螺旋區含7~24個氨基酸殘基,分別稱為A、B、C…G及H肽段。
有1~8個螺旋間區,肽鏈拐角處為非螺旋區(亦稱螺旋間區),包括N端有2個氨基酸殘基,C端有5個氨基酸殘基的非螺旋區內部存在一口袋形空穴,血紅素居於此空穴中血紅素是鐵卟淋化合物,它由4個吡咯通過4個甲炔基相連成一個大環,Fe2+居於環中。鐵與卟啉環及多肽鏈氨基酸殘基的連接:鐵卟啉上的兩個丙酸側鏈以離子鍵形式與肽鏈中的兩個鹼性氨基酸側鏈上的正電荷相連。血紅素的Fe2+與4個咯環的氮原子形成配位鍵,另2個配位鍵1個與F8組氨酸結合,1個與O2結合,故血紅素在此空穴中保持穩定位置。這種構象非常有利於運氧和儲氧功能,同時也使血紅素在多肽鏈中保持穩定。
大氣中 CO2的分壓或體內氫離子濃度升高導致pH的下降,氧合肌紅蛋白則無此效應。
包括居住環境的海拔高度、性別、年齡等,比如長期居住在高原地區的人,由於環境中缺氧,人體就會生成更多的紅細胞來適應機體對氧的需要,這是機體的生理性代償能力,於是紅蛋白量就比平原地區的人高。一般而言,女性低於男性、兒童低於成人。妊娠期婦女紅蛋白較平時略低等都屬於正常生理情況。有些病理情況也影響血紅蛋白的含量,比如嚴重嘔吐、腹瀉使人體水分大量丟失時,血液濃縮了,紅蛋白含量就會升高;相反,在嚴重心臟病造成的心力衰竭、尿少、水腫時體內水分過多,血液受到稀釋,就血紅蛋白含量下降。
兩種以血紅素為輔基並能與氧分子可逆結合的蛋白質。血紅蛋白的功能是將大氣中的氧輸送給機體;肌紅蛋白的功能則是貯存氧氣,當機體需要時再釋放。肌紅蛋白存在於肌細胞中,從軟體動物到人的各種動物中都有。血紅蛋白主要存在於脊椎動物血液的紅細胞中。酵母、草履蟲、許多無脊椎動物也有血紅蛋白。1945年中國科學家王應睞和英國科學家D.基林從豆科植物的根瘤中分離出了豆血紅蛋白。
一級結構 血紅蛋白分子有兩個α和兩個β亞基,一般用α2β2表示。血紅蛋白的分子量為64000,每個亞基的分子量為16000,其中α亞基含141個氨基酸殘基,β亞基含146個氨基酸殘基,α亞基的C端是精氨酸,β亞基的C端是組氨酸,人血紅蛋白的α及β亞基的全部氨基酸順序均已闡明。
血紅蛋白的每個亞基都有一個輔基──血紅素。血紅素是一個由原卟啉分子與一個鐵原子結合的化合物,所以又稱鐵卟啉。二價鐵離子(Fe2+)的絡合價(配位鍵)是6,與卟啉的4個氮原子絡合后還剩下兩價。在血紅蛋白分子中,Fe2+的第五個絡合價在α亞基中與87位的組氨酸中的咪唑基結合,在β亞基中與92位組氨酸結合。Fe2+的第六個絡合價就是與氧分子(O2)結合的地方。因此血紅蛋白的每個亞基可以結合一個O2,整個分子可結合 4個O2。血紅蛋白在與O2結合前後,血紅素中的Fe2+價態不變。當鐵原子為二價或三價時相應的血紅蛋白分別稱為亞鐵及正鐵血紅蛋白,正鐵血紅蛋白失去與氧結合的能力。與氧結合的血紅蛋白稱氧合血紅蛋白,未與氧結合的血紅蛋白稱脫氧血紅蛋白。
肌紅蛋白分子由分子量約17000的一條肽鏈組成,含153 個氨基酸殘基。每個肌紅蛋白分子含有一個血紅素輔基。肌紅蛋白的一級結構與血紅蛋白的α亞基或β亞基極為相似。因此推想,它們是從同一個分子進化而來。
高級結構 血紅蛋白分子的α亞基和β亞基和肌紅蛋白分子的二級和三級結構高度相似,即三者的螺旋與非螺旋結構成分的分佈以及肽鏈的走向都非常相似.
| 氧合肌紅蛋白 |
英國科學家 J.C.肯德魯利用X射線晶體衍射技術闡明了肌紅蛋白的立體結構,這是第一個闡明空間結構的蛋白質。整個肽鏈共有 8段α-螺旋。各段螺旋從N端起,依次標為A,B,C,D,…,H等。肌紅蛋白中有80%的氨基酸殘基處在α-螺旋區域,分子中沒有β-摺疊層,在肽鏈的拐曲處呈無規則捲曲。幾乎所有的疏水殘基均位於分子內部,因此靠近中心處的血紅素處在一個疏水環境中,位於螺旋E和螺旋F之間的口袋裡。血紅素的鐵原子的第五配位價與92位HiS絡合,64位HiS處在Fe的第六配位價附近,中間的空隙就是氧結合的位置。大部分極性基團暴露於分子表面。
血紅蛋白分子是一個近似於圓球的四面體,長、寬、高分別為64埃、55埃和50埃。四個亞基分別位於四面體的四個角上,相同的亞基位於對角線位置。亞基雖近似於球狀,但相互之間凹凸正好相補。四個血紅素的位置處在貼近分子表面的袋穴之中.
| 氧合肌紅蛋白 |
與氧的結合 血液中O2的飽和度指血紅蛋白實際結合氧的數量與最大可能結合氧的數量的百分比,即
| 氧合肌紅蛋白 |
氧飽和度和大氣內氧分壓Po2之間的關係如圖3所示,圖中列出血紅蛋白和肌紅蛋白的氧飽和度曲線,也稱氧結合或氧解離曲線。肌紅蛋白的氧結合曲線呈雙曲線,而血紅蛋白呈S形曲線。這是因為每個肌紅蛋白分子僅有一個O2的結合位置,因此每一肌紅蛋白分子和O2的結合均是獨立的,和其他肌紅蛋白分子無關。而血紅蛋白分子是由四個亞基所組成,每一亞基均有一個O2的結合位置,血紅蛋白分子對O2的結合是四個亞基的協同作用的結果。這也反映了兩種蛋白質的生理功能是不同的。肌紅蛋白的功能是儲備氧,只有當劇烈活動時血液輸氧不足以補償肌肉消耗而致局部氧分壓很低的情況下,才放出氧來應急。而血紅蛋白的功能是運輸氧,所以它既能在肺篩泡的高氧分壓條件下充分結合氧,又能在周圍組織的低氧分壓條件下將大部分氧釋放出來。
將血紅蛋白與氧分子的結合寫成下列平衡關係:
| 氧合肌紅蛋白 |
k是各亞基依次與氧結合的平衡常數。圖3S 形曲線表明它們之間存在下列關係: k1k2≈k3k4 這一關係表現為典型的正協同作用
| 氧合肌紅蛋白 |
大氣中 CO2的分壓或體內氫離子濃度升高導致pH的下降,可以降低血紅蛋白結合氧的親和力。這一現象稱波爾效應,具有重要的生理意義,因為當血液流經周圍組織時局部 CO2分壓較高,促進氧合血紅蛋白分子釋放O2,生成的脫氧血紅蛋白分子可與CO2結合。當血液流經肺部時,CO2的釋放促使脫氧血紅蛋白與氧的親和力增加,從而有更多的氧合血紅蛋白生成。肌紅蛋白則無此效應。
不同發育階段的血紅蛋白 在大多數正常人的一生中可以合成 5種不同的亞基,即α、β、γ、δ、和ε。在正常成人的紅細胞中含有兩種類型的血紅蛋白,一種是HbA,佔總量96%以上,另一種HbA2,佔1.5~4%,在人胎兒的紅細胞中含有另外一種血紅蛋白 HbF。這些血紅蛋白的區別在於亞基組成的不同。它們均具有相同的兩條α亞基,但另兩條亞基構成不同。HbA是 α2β2,HbA2是α2δ2,HbF是α2γ2。HbF在新生兒的最初七個月中存在。上述幾種血紅蛋白都屬於正常類型。雖然β、γ、δ亞基的一級結構相互有一些差異,但是它們的高級結構非常相似。在不同的發育階段都能發揮相應要求的輸氧功能。
異常血紅蛋白 有些人攜帶的血紅蛋白亞基與上述正常亞基的一級結構略有不同,引起了氧結合能力的異常,稱為異常血紅蛋白。到80年代初,已發現約400種異常血紅蛋白。其中很多對攜帶者是無害的,但也有某些異常血紅蛋白會引起致命的疾病,如導致鐮刀狀貧血症的血紅蛋白就是一例(圖4)。異常血紅蛋白常可用電泳方法分離和鑒定。中國科學家從1980年開始至1982年底,在20個省市、自治區共調查了近60萬人.