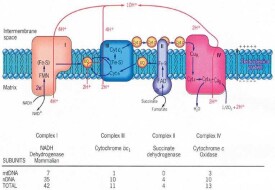
呼吸鏈
由電子載體構成的連續反應體系
呼吸鏈(respiratory chain)是由一系列的遞氫反應(hydrogen transfer reactions)和遞電子反應(eletron transfer reactions)按一定的順序排列所組成的連續反應體系,它將代謝物脫下的成對氫原子交給氧生成水,同時有ATP生成。實際上呼吸鏈的作用代表著線粒體最基本的功能,呼吸鏈中的遞氫體(hydrogen carrier)和遞電子體(electron carrier)就是能傳遞氫原子或電子的載體,由於氫原子可以看作是由質子和核外電子組成的,所以遞氫體也是遞電子體,遞氫體和遞電子體的本質是酶、輔酶、輔基或輔因子。
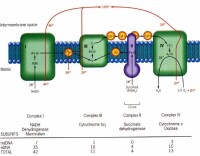
呼吸鏈
還原型輔酶通過呼吸鏈再氧化的過程稱為電子傳遞過程。其中的氫以質子形式脫下,電子沿呼吸鏈轉移到分子氧,形成粒子型氧,再與質子結合生成水。放出的能量則使ADP和磷酸生成ATP。電子傳遞和ATP形成的偶聯機制稱為氧化磷酸化作用。整個過程稱為氧化呼吸鏈或呼吸代謝。
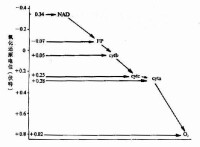
在葡萄糖的分解代謝中,一分子葡萄糖共生成10個NADH和2個FADH2,其標準生成自由能是613千卡,而在燃燒時可放出686千卡熱量,即90%貯存在還原型輔酶中。呼吸鏈使這些能量逐步釋放,有利於形成ATP和維持跨膜電勢。
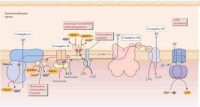
呼吸鏈中五種酶複合體
即NADH,輔酶Q氧化還原酶複合體,由NADH脫氫酶(一種以FMN為輔基的黃素蛋白)和一系列鐵硫蛋白(鐵—硫中心)組成。它從NADH得到兩個電子,經鐵硫蛋白傳遞給輔酶Q。鐵硫蛋白含有非血紅素鐵和酸不穩定硫,其鐵與肽類半胱氨酸的硫原子配位結合。鐵的價態變化使電子從FMNH2轉移到輔酶Q。
是呼吸鏈中唯一的非蛋白氧化還原載體,可在膜中迅速移動。它在電子傳遞鏈中處於中心地位,可接受各種黃素酶類脫下的氫。複合體Ⅲ 輔酶Q:細胞色素C氧化還原酶複合體,是細胞色素和鐵硫蛋白的複合體,把來自輔酶Q的電子,依次傳遞給結合在線粒體內膜外表面的細胞色素C。
都以血紅素為輔基,紅色或褐色。將電子從輔酶Q傳遞到氧。根據吸收光譜,可分為三類:a,b,c。呼吸鏈中至少有5種:b、c、c、a、a(按電子傳遞順序)。細胞色素aa以複合物形式存在,又稱細胞色素氧化酶,是最後一個載體,將電子直接傳遞給氧。從a傳遞到a的是兩個銅原子,有價態變化。
複合體Ⅳ:細胞色素C氧化酶複合體。將電子傳遞給氧。
構成呼吸鏈的遞氫體和遞電子體主要分為以下五類。
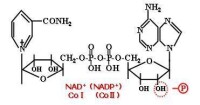
輔酶I與輔酶II
NAD 的主要功能是接受從代謝物上脫下的2H(2H +2e ),然後傳給另一傳遞體黃素蛋白。
在生理pH條件下,尼克醯胺中的氮(吡啶氮)為五價的氮,它能可逆地接受電子而成為三價氮,與氮對位的碳也較活潑,能可逆地加氫還原,故可將NAD+視為遞氫體。反應時,NAD+的尼克醯胺部分可接受一個氫原子及一個電子,尚有一個質子(H )留在介質中。
此外,亦有不少脫氫酶的輔酶為尼克醯胺腺嘌呤二核苷酸磷酸(NADP ),又稱輔酶Ⅱ(CoⅡ),它與NAD 不同之處是在腺苷酸部分中核糖的2′位碳上羥基的氫被磷酸基取代而成。
當此類酶催化代謝物脫氫后,其輔酶NADP+接受氫而被還原生成NADPH+H ,它須經吡啶核苷酸轉氫酶(pyridine nucleotide transhydrogenase)作用將還原當量轉移給NAD+,然後再經呼吸鏈傳遞,但NADPH+H 一般是為合成代謝或羥化反應提供氫。
黃素蛋白(flavoproteins)種類很多,其輔基有兩種,一種為黃素單核苷酸(FMN),另一種為黃素腺嘌呤二核苷酸(FAD),兩者均含核黃素(維生素B2),此外FMN尚含一分子磷酸,而FAD則比FMN多含一分子腺苷酸(AMP)。
呼吸鏈
多數黃素蛋白參與呼吸鏈組成,與電子轉移有關,如NADH脫氫酶(NADh dehydrogenase)以FMN為輔基,是呼吸鏈的組分之一,介於NADH與其它電子傳遞體之間;琥珀酸脫氫酶,線粒體內的甘油磷酸脫氫酶(glycerol phosphate dehydrogenase)的輔基為FAD,它們可直接從作用物轉移還原當量H++e reducing equivalent)到呼吸鏈,此外脂肪醯CoA脫氫酶與琥珀酸脫氫酶相似,亦屬於FAD為輔基的黃素蛋白類,也能將還原當量從作用物傳遞進入呼吸鏈,但中間尚需另一電子傳遞體稱為電子轉移黃素蛋白,輔基為FAD)參與才能完成。
又稱鐵硫中心,其特點是含鐵原子。鐵是與無機硫原子或是蛋白質肽鏈上半胱氨酸殘基的硫相結合,常見的鐵硫蛋白有三種組合方式(a)單個鐵原子與4個半胱氨酸殘基上的巰基硫相連。(b)兩個鐵原子、兩個無機硫原子組成(2Fe-2S),其中每個鐵原子還各與兩個半胱氨酸殘基的巰基硫相結合。(c)由4個鐵原子與4個無機硫原子相連(4Fe?4S),鐵與硫相間排列在一個正六面體的8個頂角端;此外4個鐵原子還各與一個半胱氨酸殘基上的巰基硫相連。
(a)單個鐵與半胱氨酸硫相連(b)2Fe-2S (c)4Fe-4S
鐵硫蛋白中的鐵可以呈兩價(還原型),也可呈三價(氧化型),由於鐵的氧化、還原而達到傳遞電子作用。
在呼吸鏈中它多與黃素蛋白或細胞色素b結合存在。
呼吸鏈
異戊二烯單位組成。
泛醌接受一個電子和一個質子還原成半醌,再接受一個電子和質子則還原成二氫泛醌,後者又可脫去電子和質子而被氧化恢復為泛醌。
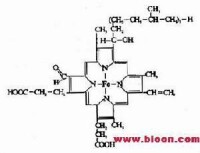
1926年Keilin首次使用分光鏡觀察昆蟲飛翔肌振動時,發現有特殊的吸收光譜,因此把細胞內的吸光物質定名為細胞色素。細胞色素是一類含有鐵卟啉輔基的色蛋白,屬於遞電子體。線粒體內膜中有細胞色素b、c1、c、aa3,肝、腎等組織的微粒體中有細胞色素P450。細胞色素b、c1、c為紅色細胞素,細胞色素aa3為綠色細胞素。不同的細胞色素具有不同的吸收光譜,不但其酶蛋白結構不同,輔基的結構也有一些差異。
細胞色素c為一外周蛋白,位於線粒體內膜的外側。細胞色素C比較容易分離提純,其結構已清楚。哺乳動物的Cyt c由104個氨基酸殘基組成,並從進化的角度作了許多研究。Cyt c的輔基血紅素(亞鐵原卟啉)通過共價鍵(硫醚鍵)與酶蛋白相連(見右上圖),其餘各種細胞色素中輔基與酶蛋白均通過非共價鍵結合。
呼吸鏈
細胞色素a和a3不易分開,統稱為細胞色素aa3。和細胞色素P450、b、c1、c不同,細胞色素aa3的輔基不是血紅素,而是血紅素A(見圖6?)。細胞色素aa3可將電子直接傳遞給氧,因此又稱為細胞色素氧化酶。
鐵卟啉輔基所含Fe2+可有Fe2+←→Fe3++e的互變,因此起到傳遞電子的作用。鐵原子可以和酶蛋白及卟啉環形成6個配位鍵。細胞色素aa和P?450輔基中的鐵原子只形成5個配位鍵,還能與氧再形成一個配位鍵,將電子直接傳遞給氧,也可與CO、氰化物、H2S或疊氮化合物形成一個配位鍵。細胞色素aa3與氰化物結合就阻斷了整個呼吸鏈的電子傳遞,引起氰化物中毒。
1.魚藤酮、安密妥、殺粉蝶菌素:阻斷電子從NADH到輔酶Q的傳遞。魚藤酮是極毒的植物物質,可作殺蟲劑。
2.抗黴素A:從鏈黴素分離出的抗生素,抑制從細胞色素b到c的傳遞。
3.氰化物、疊氮化物、CO、HS等,阻斷由細胞色素aa3到氧的傳遞。