共找到2條詞條名為氫化鋁鋰的結果 展開
- 溶於乙醚的白色或灰白色結晶體
- 用做測定羰基的試劑
氫化鋁鋰
溶於乙醚的白色或灰白色結晶體
密 度:相對密度(水=1)0.92 穩定性 穩定 常溫下在干空氣中能穩定存在。易受潮氣作用。遇水和醇發生劇烈反應。
危險標記:10(遇濕易燃物品) 主要用途 用作聚合催化劑、還原劑、噴氣發動機燃料,也用於合成藥物

氫化鋁鋰
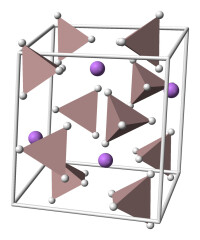
氫化鋁鋰
危險代碼:F
危險等級:15-35
安全等級:7/8-26-36/37/39-43-45
聯合國編號:UN1410
侵入途徑:吸入、食入。
燃燒(分解)產物:氧化鋁、水。
隔離泄漏污染區,限制出入。切斷火源。建議應急處理人員戴自給正壓式呼吸器,穿消防防護服。不要直接接觸泄漏物。小量泄漏:避免揚塵,使用無火花工具收集於乾燥、潔凈、有蓋的容器中。轉移至安全場所。大量泄漏:用塑料布、帆布覆蓋,減少飛散。與有關技術部門聯繫,確定清除方法。
呼吸系統防護:可能接觸毒物時,應該佩戴頭罩型電動送風過濾式防塵呼吸器。必要時,建議佩戴自給式呼吸器。
眼睛防護:呼吸系統防護中已作防護。
身體防護:穿化學防護服。
手防護:戴橡膠手套。
其它:工作現場嚴禁吸煙。工作畢,淋浴更衣。注意個人清潔衛生。
皮膚接觸:立即脫去被污染的衣著,用大量流動清水沖洗,至少15分鐘。就醫。
眼睛接觸:立即提起眼瞼,用大量流動清水或生理鹽水徹底沖洗至少15分鐘。就醫。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
食入:誤服者用水漱口,給飲牛奶或蛋清。就醫。
1947年, Schlesinger、Bond和Finholt首次製得氫化鋁鋰,其方法是令氫化鋰與無水三氯化鋁在乙醚中進行反應:4LiH + AlCl3 −Et2O→ LiAlH4 + 3LiCl
這個反應一般稱為 Schlesinger 反應,反應產率以三氯化鋁計算為86%。反應開始時要加入少量氫化鋁鋰作為引發劑,否則反應要經歷一段誘導期才能發生,並且一旦開始後會以猛烈的速度進行,容易發生事故。Schlesinger 法有很多缺點,如需要用引發劑、氫化鋰要求過量和高度粉細、需要用稀缺的原料金屬鋰、反應中3/4的氫化鋰轉化為價廉的氯化鋰等。雖然如此,相對於其他方法,Schlesinger 法較簡便,至今仍是製取氫化鋁鋰的主要方法。
其他製取氫化鋁鋰的方法包括:
高壓合成法:用鹼金屬或氫化物,鋁,高壓氫在烴或醚溶劑中反應。
LiH + Al + 2H2 → LiAlH4
由氫化鋁鈉製取。工業合成上一般採用高溫高壓合成氫化鋁鈉,然後與氯化鋰進行複分解反應。這一製備方法可以實現氫化鋁鋰的高產率:
Na + Al + 2H2 → NaAlH4
NaAlH4 + LiCl −Et2O→ LiAlH4 + NaCl
其中LiCl由氫化鋁鋰的醚溶液過濾掉,隨後使氫化鋁鋰析出,獲得包含1%(w/w)左右LiCl的產品。
上述的氫化鋁鈉若換成氫化鋁鉀也可反應,可與氯化鋰或是乙醚或四氫呋喃中的氫化鋰反應。
溶解度
氫化鋁鋰可溶於多種醚溶液中,不過,由於雜質的催化作用,氫化鋁鋰可能會自動分解,但是在四氫呋喃中表現得更穩定,因此雖然在四氫呋喃的溶解度較低,相比乙醚,四氫呋喃應該是更好的溶劑。
氫化鋁鋰在常溫下是亞穩的。在長時間的貯存中,氫化鋁鋰會分解成Li3AlH6和LiH。這一過程可以通過鈦、鐵、釩等助催化元素來加速。
當加熱氫化鋁鋰時,其反應機理分為3步:
3 LiAlH4 → Li3AlH6 + 2 Al + 3 H2 (R1)
2 Li3AlH6 → 6 LiH + 2 Al + 3 H2 (R2)
2 LiH + 2 Al → 2 LiAl +H2 (R3)
R1通常以氫化鋁鋰的熔化開始,溫度範圍為150-170℃,接著立即分解為Li3AlH6,但是R1是在低於LiAlH4熔點的情況下進行的。在大約200℃時,Li3AlH6分解成LiH和Al(R2),接著在400℃以上分解成LiAl(R3)。反應R1在實際中是不可逆的,而R3是可逆反應,在500℃時的平衡壓強是25千帕。在有適當催化劑的情況下,R1和R2反應可以在常溫下發生。
LiAlH4遇水立即發生爆炸性的猛烈反應並放出氫氣:
LiAlH4 + 2H2O → LiAlO2 + 4H2
LiAlH4 + 4H2O → LiOH + Al(OH)3 + 4H2
由於放出的氫是定量的,該反應可用來測定樣品中氫化鋁鋰的含量。為了防止反應過於劇烈,常加入一些二惡烷、乙二醇二甲醚或四氫呋喃作為稀釋劑。
這一反應提供了一個有用的實驗室製取氫氣的方法。長期暴露在空氣中的樣品通常會發白,因為樣品已經吸收了足夠的水分,生成了由氫氧化鋰和氫氧化鋁組成的白色混合物。
LiAlH4 的乙醚或四氫呋喃溶液能同氨猛烈作用放出氫氣:
2LiAlH4 + 5NH3 → [LiAlH(NH2)2]2NH+ 6H2
當氨的量不足時,發生如下反應:
LiAlH4 + 4NH3 → LiAl(NH2)4 + 2H2
NH3/LiAlH4比值更小時,則氨中的三個氫都可被取代:
LiAlH4 + NH3 → Li[Al(NH2)4]
氫化鋁鋰幾乎可以與所有的鹵化物反應生成相應的配位鋁氫化物,當配位鋁氫化物不穩定時,則分解為相應的氫化物。通式為:
nLiAlH4 + MXn → M(AlH4)n + nLiX
M(AlH4)n → MHn + nAlH3
因此可通過此方法製備很多金屬或非金屬氫化物,如:
2LiAlH4 + ZnI2 −(−40℃,乙醚)→ ZnH2 +2AlH3 + 2LiI
LiAlH4 + 4 NaCl → 4 NaH + LiCl + AlCl3
氫化鋁鋰可與NaH在四氫呋喃中進行複分解反應,高效的生產氫化鋁鈉(NaAlH4):
LiAlH4 + NaH → NaAlH4 + LiH
氫化鋁鉀(KAlH4)可以用二乙二醇二甲醚作為溶劑,以類似的方式製取:
LiAlH4 + KH → KAlH4 + LiH
氫化鋁鋰
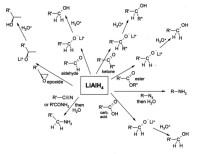
能被氫化鋁鋰還原的官能團主要包括:
鹵代烷被還原成烷烴。碘代烷反應最快,其次是溴代烷和氯代烷。此反應中一級鹵代烷(伯鹵代烷)性能較好,所得產物發生構型轉化,因此認為該反應是SN2機理。二級鹵代烷(仲鹵代烷)也可用此法還原,三級鹵代烴(叔鹵代烷)容易發生消除反應,不適用此法。氫化鋁鋰只能用於還原醇基在附近的炔烴,不能用於還原簡單烯烴和芳香烴。
硅鹵化物等還原為硅烷,如:
LiAlH4 + SiCl4 → SiH4 + LiCl + AlCl3
羰基化合物(醯胺除外)被還原為醇,如酯和羧酸都可以被氫化鋁鋰還原成伯醇。在氫化鋁鋰還原酯的方法發現之前,一般用布沃-布朗還原反應還原酯,即將煮沸的金屬鈉-無水醇作為還原劑,但這一反應較難進行。醛和酮也可以被氫化鋁鋰還原成醇,不過一般使用如NaBH4這類更溫和的試劑來還原。α,β-不飽和酮會被還原成烯丙醇。
環氧化合物。當環氧化合物被還原時,氫化鋁鋰試劑會攻擊環氧化合物的位阻小的一端,通常會生成仲醇或叔醇。環氧環己烷會被優先還原成a鍵(直立鍵)的醇。
醯胺和醯亞胺被還原成胺。這類反應一般產率較高,並且用N,N-取代的原料反應比其他要快很多。
與醇反應生成烷氧基氫化鋁鋰:
LiAlH4 + ROH → LiAl(OR)H3 + H2
LiAlH4 + 2ROH → LiAl(OR)2H2 + 2H2
LiAlH4 + 3ROH → LiAl(OR)3H + 3H2
LiAl(OR)2H2 是將醯胺還原為醛的適宜試劑,LiAl(OC(CH3)3)3H 是將醯氯還原為醛的適宜試劑,而利用氫化鋁鋰不能將醯氯部分還原生成對應的醛,因為氫化鋁鋰會將後者完全還原為伯醇,因此必須要使用更溫和的三叔丁氧基氫化鋁鋰(LiAl(OC(CH3)3)3H)來還原醯氯。三叔丁氧基氫化鋁鋰與醯氯的反應比與醛的反應迅速得多,例如在異戊酸中加入氯化亞碸會生成異戊醯氯,這時可利用三叔丁氧基氫化鋁鋰將異戊醯氯還原為異戊醛,產率能達到65%。
氫化鋁鋰是白色固體,但工業品由於含有雜質,通常為灰色粉末。氫化鋁鋰可以通過從乙醚中重新結晶來提純,若進行大規模的提純可以使用索式提取器。一般來說,不純的灰色粉末用於合成,因為雜質是無害的,可以很容易地與有機產物分離。
純氫化鋁鋰粉末是在空氣中自燃,但大塊晶體不易自燃。一些氫化鋁鋰工業品中會包含礦物油,以防止材料與空氣中的水反應,但更通常的作法是放入防水塑料袋中密封。應儲存於陰涼、乾燥、通風良好的專用庫房內,遠離火種、熱源。庫溫不超過32℃,相對濕度不超過75%。應與氧化劑、酸類、醇類等分開存放,切忌混儲。儲區應備有合適的材料收容泄漏物。
氫化鋁鋰可作羰基試劑、還原劑,可以製造其他氫化物及硅烷、硼烷等。如氫化鋁鋰與氯化硼反應製取乙硼烷:
3 LiAlH4+4 BCl3===(乙醚中)===2 B2H6+3 LiCl+3 AlCl3
在醫藥、香料、農藥、染料及其他精細有機合成中用作還原劑。可將醛酮、酸、酸酐、酯、醌、醯氯等還原為醇,將腈還原為伯胺,將鹵化烴還原為烴,芳香硝基化合物還原成偶氮化合物。但通常不能使碳—碳雙鍵氫化。除此之外,還用作聚合催化劑、噴氣發動機燃料、合成藥物等。
本品加熱至125℃即分解出氫化鋰與金屬鋁,並放出氫氣;在空氣中磨碎時可發火;受熱或與濕氣、水、醇、酸類接觸,即發生放熱反應並放出氫氣而燃燒或爆炸;與強氧化劑接觸猛烈反應而爆炸。
本品對黏膜、上呼吸道、眼睛及皮膚有強烈刺激性。吸入后,可因喉和支氣管的炎症、水腫、痙攣、化學性肺炎、肺水腫而致死。接觸后引起燒灼感、咳嗽、喘息、喉炎、氣短、頭痛、噁心和嘔吐等。
