自噬體
生物學科中的現象
自噬(autophagy)是由 Ashford 和 Porter 在 1962 年發現細胞內有“自己吃自己”的現象后提出的,是指從粗面內質網的無核糖體附著區脫落的雙層膜包裹部分胞質和細胞內需降解的細胞器、“蛋白質”等成分形成自噬體(autophagosome),並與溶酶體融合形成自噬溶酶體,降解其所包裹的內容物,以實現細胞本身的代謝需要和某些細胞器的更新。
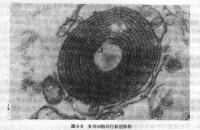
自噬體
自噬體通過自噬作用循環細胞內源物,在細胞營養不良時分解較不重要的細胞結構來提供養份,可能對實現細胞代謝需要、更新某些細胞器並維持細胞內穩態有較重要的作用。但也有觀點認為,自噬體是細胞程序性死亡中分解老化、損傷細胞的主體。自噬體對細胞所起的作用尚未完全闡明,包括其對癌細胞的作用。
自噬主要的生理功能是將胞質中的大分子物質(如蛋白質、RNA、過量儲存的糖原等)和一些細胞內源性底物(包括由於生理或病理原因引起的衰老、破損的細胞器)在單位膜包裹的囊泡中大量降解,實現再循環,以維持細胞自身的穩定。這個過程對於細胞成分更新、保持旺盛的生理狀態是至關重要的。在此過程中,自噬體的形成是關鍵,其直徑一般為 300 ~ 900 nm,平均 500 nm,囊泡內常見的包含物有胞質成分和某些細胞器如線粒體、內吞體、過氧化物酶體等。與其他細胞器相比,自噬體的半衰期很短,只有 8 min 左右,說明自噬是細胞對於環境變化的有效反應。根據細胞物質運到溶酶體內的途徑不同,自噬分為以下幾種。①大自噬:由內質網來源的膜包繞待降解物形成自噬體,然後與溶酶體融合併降解其內容物; ②小自噬:溶酶體的膜直接包裹長壽命蛋白等,並在溶酶體內降解; ③分子伴侶介導的自噬(CMA):胞質內蛋白結合到分子伴侶后被轉運到溶酶體腔中,然後被溶酶體酶消化。CMA 的底物是可溶的蛋白質分子,在清除蛋白質時有選擇性,而前兩者無明顯的選擇性。
自噬體(autophgosome)
自噬溶酶體(autolysosome)
當自噬體與溶酶體融合后,形成自噬溶酶體。
自噬性溶酶體是一種自體吞噬泡, 作用底物是內源性的,即細胞內的蛻變、破損的某些細胞器或局部細胞質。這種溶酶體廣泛存在於正常的細胞內,在細胞內起“清道夫”作用,作為細胞內細胞器和其它結構自然減員和更新的正常途徑。在組織細胞受到各種理化因素傷害時,自噬性溶酶體大量增加,因此對細胞的損傷起一種保護作用。
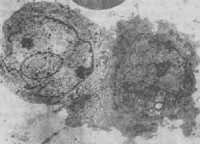
自噬體
吞噬性溶酶體內的各種大分子在水解酶的作用下,可被分解為簡單物質。例如,能將蛋白質分解為二肽或遊離氨基酸;把核酸分解為核苷和磷酸;使碳水化合物分解為寡糖類或單糖;將中性脂肪分解為甘油和脂肪酸等。這些被分解而生成的可溶性小分子物質,能透過溶酶體體膜進入細胞質基質,重新參與細胞的物質代謝,一些未被完全消化的物質殘留下來,形成殘餘小體。
在骨生長和骨重建過程中,溶酶體對骨質的更新起著重要作用。破骨細胞的溶酶體酶能釋放到細胞外,分解和消除陳舊的骨基質,這是骨質更新的一個重要步驟。溶酶體酶釋放的具體過程可能是:細胞內的環化酶活性發生改變后,隨著cAMP的增加,蛋白質激酶被活化而引起微管及其周圍的蛋白質的磷酸化,其結果微管發生聚集,致使溶酶體向細胞膜方向移動,並與細胞膜相互融合,然後溶酶體內的水解酶被排出細胞外,以分解和消除陳舊的骨質。
自噬作用是普遍存在於大部分真核細胞中的一種現象, 是溶酶體對自身結構的吞噬, 它是細胞內的循環系統
自噬體
雖然基礎水平的自噬對細胞是一種保護性作用,但是過度自噬也會引起自噬性細胞死亡甚至加速疾病的進展,如血管平滑肌細胞自噬,會導致膠原合成減少,纖維帽變薄,最終導致急性心血管事件的發生。
自噬體包裹需降解的細胞內容物並脫離進入細胞質基質后,會與溶酶體融合形成自噬溶酶體,自噬溶酶體中部分大分子物質會被這些囊泡中的酶水解成可通過滲透作用穿過囊泡膜回到細胞質基質中繼續參與細胞的代謝,而剩餘的未被分解的物質則殘留在自噬溶酶體中,產生殘留體。
