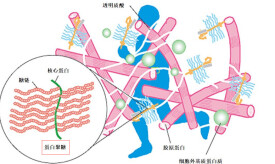
蛋白聚糖
蛋白聚糖
蛋白聚糖(proteoglycan,PG)是一類特殊的糖蛋白,由一條或多條糖胺聚糖和一個核心蛋白共價鏈接而成。蛋白聚糖除含糖胺聚糖鏈外,尚有一些N—或(和)O—鏈接的寡糖鏈。蛋白聚糖不僅分佈於細胞外基質,也存在於細胞表面以及細胞內的分泌顆粒中。在組織分化及成熟階段,透明質酸含量逐漸降低,同時伴有其他硫酸化氨基聚糖成分的增多。
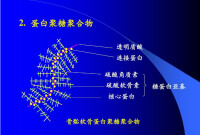
蛋白聚糖的結構
與糖胺聚糖共價結合的多肽鏈稱核心蛋白(core protein),它的種類很多,M從約2萬~25萬,其中不少於已測得其氨基酸序列。核心蛋白具有以下幾個特點:
(1)多數核心蛋白含有幾個不同的結構域;
(2)所有的核心蛋白都含有相應的糖胺聚糖結合結構域;
(3)某些蛋白聚糖可通過核心蛋白中的特定結構域,錨定在細胞表面或細胞外基質的大分子上;
(4)有些核心蛋白尚含有具特異相互作用的結構域。
除透明質酸外,所有糖胺聚糖鏈的延伸都是在一個與核心蛋白共價連接的所謂連接區(寡糖鏈)上進行的。連接區合成的起始和糖肽間連鍵類型與糖蛋白中的相同,只是寡糖鏈形式有所不同。CS/DS鏈和HS/Hp鏈的連接區是一個四糖鏈:GlcUAβ(1→3)Galβ(1→3)Xylβ1-O-Ser,屬O-寡糖鏈;聚糖的二糖單位(己糖醛酸→己糖胺)裝配在它的非還原端GlcUA上。軟骨可聚蛋白中的連接區是另一形式的O-寡糖鏈,即O-GalNAc糖鏈,這是一個分支的六糖鏈,Siaα2→3Galβ1→4GlcNAcβ1→6(Siaα2→3Galβ1→3)GalNAcα1-O-Ser/Thr。CS或KS就是取代其中一個分支末端的Sia殘基與核心蛋白相連的。很多蛋白聚糖的連接區是N-寡糖鏈,例如存在於角膜中的小分子硫酸角質素蛋白聚糖(KSPG),其KS就是通過一個二天線複雜性N-寡糖鏈與核心蛋白連接的。
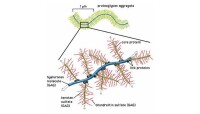
蛋白聚糖聚集體
包括肽鏈的合成及糖鏈的合成。核心蛋白質肽鏈的合成是蛋白聚糖合成的限速步驟,在粗面內質網進行,其過程與一般蛋白質相同。肽鏈的糖基化在內質網起始,在戈爾吉氏體完成。氨基聚糖糖鏈的合成過程與糖蛋白者類似。亦由一系列糖基轉移酶催化逐個將活化單糖的糖基轉移到肽鏈及未完成的糖鏈,使之不斷延長。糖基的硫酸化是在糖鏈的延長過程中進行的。由硫酸基轉移酶催化,從磷酸腺苷磷酸硫酸轉移硫酸基到糖基,糖鏈中的艾杜糖醛酸是由葡萄糖醛酸基在差向異構酶催化下發生旋光異構化形成的。
可在一系列細胞外酶或溶酶體中的細胞內酶的催化下進行。水解糖鏈的酶包括內切糖苷酶及外切糖苷酶,分別催化水解糖鏈中的及糖鏈非還原末端的糖苷鏈。透明質酸酶是了解最多的內切糖苷酶。精細胞產生的透明質酸酶對其穿過卵膜實現受精是必要的。細菌分泌的透明質酸酶對其侵犯宿主組織有重要作用。氨基聚糖中的硫酸基由硫酸酯酶催化水解脫硫酸。脫硫酸常為氨基聚糖糖鏈降解的限速步驟。未經脫硫酸則糖苷酶無法發揮作用。至於核心蛋白質及連接蛋白質的降解過程與一般蛋白質相同。
氨基聚糖及蛋白聚糖是細胞外基質的重要成分之一。可與細胞外基質中的膠原、纖粘連蛋白、層粘連蛋白及彈性蛋白結合,構成具有組織特性的細胞外基質。像膠原一樣,不同組織的細胞外基質中含有不同類型、不同含量的氨基聚糖及蛋白聚糖,並與其功能相適應。例如,軟骨及長骨的骨骺含較多硫酸軟骨素蛋白聚糖。硫酸軟骨素的保水性(由糖基的多羥基及多陰離子決定)使其佔據一定的空間,具有一定的容量,這對於骨骺的生長板尤其重要。硫酸軟骨素蛋白聚糖的缺乏或硫酸軟骨素的硫酸化不足均可縮減骺板的體積,從而導致肢體發育短小和畸形。氨基聚糖的多陰離子可結合二價陽離子(如Ca2+),這對組織的鈣化,尤其是骨鹽的沉積有重要作用。角膜中的蛋白聚糖主要含硫酸角質素及硫酸皮膚素,且蛋白質的含量較高,在角膜基質的構建及維持上有重要作用,從而使角膜基質具有光透明性。細胞外基質中的各種成分(包括氨基聚糖及蛋白聚糖)彼此交聯,形成孔徑不同或電荷密度不同的凝膠,不但使細胞外基質連成一體,而且可以作為控制分子及細胞通過的篩網。這在腎小球及脈管基膜尤其重要。
透明質酸的合成在發育中及創傷修復中的組織內特別旺盛。它可促進細胞遷移及增殖,並阻止細胞分化。當細胞遷移達到特定的部位或增殖達到足夠的數量時,透明質酸酶便將其降解。因此透明質酸的作用似乎是防止細胞過早的分化。在組織分化及成熟階段,透明質酸含量逐漸降低,同時伴有其他硫酸化氨基聚糖成分的增多。在不同的組織內增加的硫酸化氨基聚糖種類不同。這些具有組織特點的氨基聚糖又可穩定分化表型。這已在軟骨形成及角膜上皮分化中得到證明。
哺乳類動物組織中的氨基聚糖的種類及含量隨生長、發育及年齡而變動。例如,胚胎髮育早期,皮膚中的氨基聚糖幾乎全部由透明質酸及硫酸軟骨素組成。3個月胎兒的皮膚中透明質酸及硫酸軟骨素的含量為成人者的20倍,5個半月的胎兒為5倍,足月胎兒為2倍。在胚胎髮育過程中膠原纖維逐漸形成,它們的一部分又逐漸被硫酸皮膚素取代。至70歲以後膠原纖維周圍的氨基聚糖含量顯著降低,同時硫酸皮膚素所佔的比重顯著增加。關節軟骨中的蛋白聚糖亦隨年齡的增長出現量與質的改變:總量逐漸減少,硫酸角質素逐漸取代硫酸軟骨素,糖所佔比重下降,蛋白質所佔比重相對增加,從而導致組織的保水能力及彈性減弱。可見,氨基聚糖及蛋白聚糖與老化過程有關。
某些氨基聚糖可與血漿蛋白結合。例如,肝素可與凝血相關的幾種凝血因子(如因子Ⅹ及凝血酶)及抗凝血酶Ⅲ(血漿α2糖蛋白)結合,從而抗凝血。動脈壁內膜的硫酸皮膚素蛋白聚糖可與血漿低密度脂蛋白結合。其結合作用可能主要由靜電引力造成,因為低密度脂蛋白的載脂蛋白apo-B帶正電荷,可直接被帶負電荷的硫酸皮膚素吸引。此外,脂蛋白中的磷脂所帶的負電荷可藉助於Ca2+而與氨基聚糖的陰離子基團結合,此與動脈粥樣硬化的形成有關。除血漿蛋白外,肝素還可與毛細血管壁上的脂蛋白脂肪酶結合,從而將之釋入血循環。脂蛋白脂肪酶可分解甘油三酯,因而使血脂降低。
動脈壁中的氨基聚糖及蛋白聚糖是引起低密度脂蛋白及鈣沉積的內在因素。動脈壁中硫酸皮膚素的含量隨年齡的增長而增多,而且可在生理性pH及離子強度下與低密度脂蛋白結合。有動脈粥樣硬化斑塊的主動脈組織中可見硫酸皮膚素含量異常增高,由病變部位增殖的平滑肌細胞產生。
蛋白聚糖還與腫瘤的發生及轉移有關。在一些腫瘤,如間質瘤、成腎母細胞瘤、乳腺癌及神經膠質瘤等,腫瘤細胞合成及分泌的透明質酸增多,體液(血、尿)中透明質酸的含量增高,這具有一定診斷意義。在肝、肺、乳腺、結腸及前列腺等腫瘤組織中硫酸軟骨素的含量增多。體外實驗證明,硫酸軟骨素有促進乳腺癌生長的作用;體內實驗證明對艾氏腹水癌有促進生長的作用。降解硫酸軟骨素的酶可抑制艾氏腹水癌的生長。總之,腫瘤組織中透明質酸及硫酸軟骨素的增多,可能與其增殖失控有一定關係。反之,硫酸乙醯肝素則具有抑制細胞增殖的作用。體外實驗證明,從肝或肝質膜分離的硫酸乙醯肝素可抑制肝癌細胞的生長。
在人的肝癌、小鼠的骨髓瘤、自發性乳腺癌及腹水型肝癌等均可見硫酸乙醯肝素的硫酸化程度降低。這不單可能影響其抑制細胞增殖的功能,而且可能導致其與纖粘連蛋白、層粘連蛋白及膠原的親和性減弱,以致瘤細胞周圍的基質組裝異常,瘤細胞之間的粘合減弱,腫瘤細胞易從瘤組織上脫落。這就為腫瘤轉移造成了先決條件。此外,能降解硫酸乙醯肝素的內切糖苷酶存在於某些易轉移的腫瘤(如黑素瘤)中,它可破壞硫酸乙醯肝素,同時其降解產物被釋放到血液中,具有肝素樣抗血凝活性,可造成出血不止。
先天性缺乏降解氨基聚糖的酶(如糖苷酶或硫酸酯酶等)可導致氨基聚糖或蛋白聚糖,或其降解產物在體內一定部位堆積,引起粘多糖病。