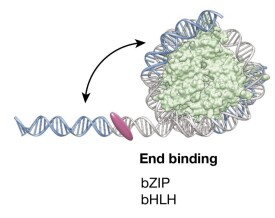
組蛋白密碼
組蛋白密碼
遺傳特異性由基因組鹼基序列決定,序列變化導致細胞行為改變。但是科學發展到今天,這已不是問題的全部。有人提出"表觀遺傳學"概念,表觀遺傳學的一個典型例子就是抑瘤基因異常甲基化與腫瘤相關。隨著轉錄調控研究的深入,一種新的調節機制 --"組蛋白密碼"日益被科研工作者重視,組蛋白密碼信息存在於轉錄后組蛋白修飾等過程中。
染色體的多級摺疊過程中,需要 DNA同組蛋白 (H3、H4、H2A、H2B和H1)結合在一起。
研究中,人們發現組蛋白在進化中是保守的,但它們並不是通常認為的靜態結構。這種常見的組蛋白外在修飾作用包括乙醯化、甲基化、磷酸化、泛素化、糖基化、ADP核糖基化、羰基化等等,它們都是組蛋白密碼的基本元素。與DNA密碼不同的是,組蛋白密碼和它的解碼機制在動物、植物和真菌類中是不同的。我們從植物細胞保留有發育成整個植株的全能性和去分化的特性中,就可以看出它們在建立和保持表觀遺傳信息方面與動物是不同的。在組蛋白的修飾中,乙醯化、甲基化研究最多。乙醯化修飾大多在組蛋白H3的 Lys9、l4、l8、23和H4的Lys5、8、12、l6等位點。對這兩 種修飾結果的研究顯示,它們既能激活基因也能使基因沉默。甲基化修飾主要在組蛋白H3和H4的賴氨酸和精氨酸兩類殘基上。
組蛋白密碼
細胞對外在刺激作出的每一個反應幾乎都會涉及到染色質活性的改變,這一改變就是通過修飾組蛋白,變換組蛋白密碼實現的。既然幾乎每一種生物學過程都有特定的組蛋白修飾標記,那麼特定的組蛋白修飾標記就能反應相應的特定生物學過程。因此通過組蛋白修飾系列抗體特異性地識別靶蛋白修飾形式,就能簡化對組蛋白修飾的研究
染色質的轉錄活性與組蛋白修飾相伴(見表1)。總體上來說,組蛋白乙醯化水平增加與轉錄活性增強有關,而組蛋白甲基化修飾的結果則相對複雜,它可以是轉錄增強或轉錄抑制。
表1-組蛋白修飾與轉錄狀態
| 轉錄激活 | 轉錄抑制乙醯化 | 增加 | 降低賴氨酸甲基化 | 組蛋白H3 K4 | 組蛋白H3 K9,K27,K79精氨酸甲基化 | 組蛋白H3 R2,R17,R26 | 降低 | 組蛋白H3 R4 |
有絲分裂過程也與特異性組蛋白修飾有顯著的相關性。在有絲分裂過程中,有數個組蛋白磷酸化反應,其中大多數由Aurora B激酶催化。特異性組蛋白修飾可在有絲分裂的不同階段檢測到,在細胞核分裂中發揮多種功能。(見表2)
表2-組蛋白修飾於有絲分裂
| 分裂間期 | G2/M | 分裂早期 | 分裂晚期 H3 S10 Phos | +/- | + | +++ | ++++H3 S28 Phos | - | - | ++ | +++CENP-A Ser 7 Phos | - | - | +++ | +H4 K20 Me | + | ++ | +++ | +++ |
組蛋白修飾還參與DNA損傷和凋亡。在凋亡的級聯反應中,激酶(包括CHK1和CHK2)的主要底物之一是組蛋白衍生物H2A.X ,H2A.X的磷酸化是凋亡早期最早標誌之一。在凋亡後期,Caspase激活蛋白激酶Mst1, Mst1使組蛋白H2B的14位絲氨酸磷酸化。這一修飾在染色質濃縮步驟中可檢測到,是凋亡途徑良好的標記物。也有報道稱在凋亡過程中發現組蛋白H2B的32位絲氨酸磷酸化。