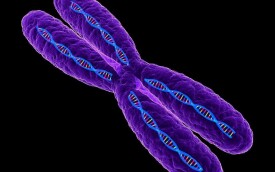
染色質
染色質
染色質是指間期細胞核內由DNA、組蛋白、非組蛋白及少量RNA 組成的線性複合結構,是間期細胞遺傳物質存在的形式。染色體是指細胞在有絲分裂或減數分裂過程中,由染色質聚縮而成的棒狀結構。實際上,兩者化學組成沒有差異,而包裝程度即構型不同,是遺傳物質在細胞周期不同階段的不同表現形式。在真核細胞的細胞周期中,大部分時間是以染色質的形態而存在的。
1888年,Waldeyer正式提出染色體的命名。
經過一個多世紀的研究,人們認識到,染色質和染色體是在細胞周期不同階段可以相互轉變的形態結構。
通過分離胸腺、肝或其他組織細胞的核,用去垢劑處理后再離心收集染色質進行生化分析,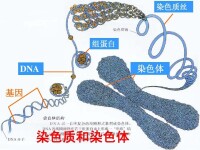 確定染色質的主要成分是DNA和組蛋白,還有非組蛋白及少量RNA。大鼠肝細胞染色質常被當作染色質成分分析模型,其中組蛋白與DNA含量之比近於1:1,非組蛋白與DNA之比是0.6:1,RNA與DNA之比為0.1:1。DNA與組蛋白是染色質的穩定成分,非組蛋白與RNA的含量則隨細胞生理狀態不同而變化。
確定染色質的主要成分是DNA和組蛋白,還有非組蛋白及少量RNA。大鼠肝細胞染色質常被當作染色質成分分析模型,其中組蛋白與DNA含量之比近於1:1,非組蛋白與DNA之比是0.6:1,RNA與DNA之比為0.1:1。DNA與組蛋白是染色質的穩定成分,非組蛋白與RNA的含量則隨細胞生理狀態不同而變化。

染色質
基因組
凡是具有細胞形態的生物其遺傳物質都是DNA,只有少數病毒的遺傳物質是RNA。在真核細胞中,每條未複製的染色體包含一條縱向貫穿的DNA分子。狹義而言,某一生物的細胞中儲存於單倍染色體組中的總遺傳信息,組成該生物的基因組。真核生物基因組DNA的含量比原核生物高得多。
突變分析結果表明,並非所有基因都是細胞生存的必需基因,如酵母基因組有40%的基因屬於非必需基因,果蠅基因組只有5000個必需基因,最小最簡單的細胞支原體,有迄今發現的能獨立生活的有機體的最小基因組(482個基因),其中只有256個必需基因。
類型
以人類基因組為例,生物基因組DNA可以分為以下幾類。
1、蛋白編碼序列。以三聯體密碼方式進行編碼。編碼DNA在基因組中所佔比例隨生物而異,在人類細胞基因組中,這一比例只有1.5%左右。這類編碼序列主要是非重複的單一DNA序列,一般在基因組中只有一個拷貝(單一基因),然而,也有可能有兩個或幾個拷貝甚至多達上千個拷貝的情況,這些都來自於從基因家族裡派生出來的重複基因或多基因。
2、編碼rRNA、tRNA、snRNA和組蛋白的串聯重複序列。它們在基因組中一般有20~300個拷貝,人類基因組中約含有0.3%這樣的DNA。
3、含有重複序列的DNA。這類DNA在基因組中佔有很大一部分。它們又可以分為兩個亞類:簡單序列DNA和散在重複序列。DNA轉座子、LTR反轉座子、非LTR反轉座子和假基因都屬於散在重複序列。非LTR反轉座子包括短散在元件和長散在元件。典型SINE其長度少於500bp,如人和靈長類基因組中大量分散存在的Alu家族,人基因組中有50萬~70萬份Alu拷貝,相當於平均每隔4kb就有一個Alu序列;典型LINE其長度在6~8kb之間,如人基因組中L1家族,有100 000個L1拷貝。
4、未分類的間隔DNA。
5、高度重複DNA序列:
①衛星DNA,重複單位長5~100bp,不同物種重複單位鹼基組成不同,一個物種也可能含有不同的衛星DNA序列。
②小衛星DNA,重複單位長12~100bp,重複3 000次之多,又稱數量可變的串聯重複序列,每個小衛星區重複序列的拷貝數是高度不變的,因此早前常用於DNA指紋技術作個體鑒定。研究發現小衛星序列的改變可以影響鄰近基因的表達,基因的異常表達會導致一系列不良後效應。
③微衛星DNA,重複單位序列最短,只有1~5bp,串聯成簇長度50~100bp。
二級結構
生物的遺傳信息儲存在DNA的核苷酸序列中,生物界物種的多樣性也寓於DNA分子4種核苷酸千變萬化的排列之中。DNA分子不僅一級結構具有多樣性,而且二級結構也具有多態性。所謂二級結構是指兩條多核苷酸鏈反向平行盤繞所生成的雙螺旋結構。DNA二級結構構型分3種:
①B型DNA(右手雙螺旋DNA),是“經典”的Watson-Crick結構,二級結構相對穩定,水溶液和細胞內天然DNA大多為B型DNA;
②A型DNA(右手雙螺旋DNA),是一般B型DNA的重要變構形式,其分子形狀與RNA的雙鏈區和DNA/RNA雜交分子很相近;
③Z型DNA(左手雙螺旋DNA),也是B型DNA的變構形式。
3種構型DNA中,特別是大溝的特徵在遺傳信息表達過程中起關鍵作用,基因表達調控蛋白都是通過其分子上特定的氨基酸側鏈與溝中鹼基對兩側潛在的氫原子供體(═NH)或受體(O和N)形成氫鍵而識別DNA遺傳信息的。由於大溝和小溝中這些氫原子供體和受體各異以及排列不同,所以大溝攜帶的信息要比小溝多。此外,溝的寬窄及深淺也直接影響鹼基對的暴露程度,從而影響調控蛋白對DNA信息的識別。B型DNA是活性最高的DNA構型,變構后的A型DNA仍有較高活性,變構后的Z型DNA活性明顯降低。
此外,DNA雙螺旋能進一步扭曲盤繞形成特定的高級結構,正、負超螺旋是DNA高級結構的主要形式。DNA二級結構的變化與高級結構的變化是相互關聯的,這種變化在DNA複製、修復、重組與轉錄中具有重要的生物學意義。
與染色質DNA結合的蛋白負責DNA分子遺傳信息的組織、複製和閱讀。 這些DNA結合蛋白包括兩類:一類是組蛋白,與DNA結合但沒有序列特異性;另一類是非組蛋白,與特定DNA序列或組蛋白相結合。
這些DNA結合蛋白包括兩類:一類是組蛋白,與DNA結合但沒有序列特異性;另一類是非組蛋白,與特定DNA序列或組蛋白相結合。

染色質蛋白
組蛋白
染色質
用聚丙烯醯胺凝膠電泳可以區分5種不同的組蛋白:H1、H2A、H2B、H3和H4。幾乎所有真核細胞都含有這5種組蛋白,而且含量豐富,每個細胞每種類型的組蛋白約6×10個分子。5種組蛋白在功能上分為兩組:
①核小體組蛋白。包括H2A、H2B、H3和H4。這4種組蛋白有相互作用形成複合體的趨勢,它們通過C端的疏水氨基酸互相結合,而N端帶正電荷的氨基酸則向四面伸出以便與DNA分子結合,從而幫助DNA捲曲形成核小體的穩定結構。這4種組蛋白沒有種屬及組織特異性,在進化上十分保守,特別是H3和H4是所有已知蛋白質中最為保守的。從這種保守性可以看出,H3和H4的功能幾乎涉及它們所有的氨基酸,任何位置上氨基酸殘基的突變可能對細胞都將是有害的。
②H1組蛋白。其分子較大。球形中心在進化上保守,而N端和C端兩個“臂”的氨基酸變異較大,所以H1在進化上不如核小體組蛋白那麼保守。在構成核小體時H1起連接作用,它賦予染色質以極性。H1有一定的種屬及組織特異性。在哺乳類細胞中,組蛋白H1約有6種密切相關的亞型,氨基酸順序稍有不同。在成熟的魚類和鳥類的紅細胞中,H1 為H5取代。有的生物如酵母缺少H1,結果酵母細胞差不多所有染色質都表現為活化狀態。
非組蛋白
非組蛋白主要是指與特異DNA序列相結合的蛋白質,所以又稱序列特異性DNA結合蛋白(sequence specific DNA binding protein)。利用凝膠延滯實驗(gel retardation assay),可以在細胞抽提物中進行檢測。首先製備一段帶有放射性標記的已知特異序列的DNA,將要檢測的細胞抽提物與標記DNA混合,進行凝膠電泳。 未結合蛋白的自由DNA在凝膠上遷移最快,而與蛋白質結合的DNA遷移慢,一般結合的蛋白質分子越大,DNA分子的延滯現象越明顯,然後通過放射自顯影分析,即可發現一系列DNA帶譜,每條帶分別代表不同的DNA-蛋白質複合物。每條帶相對應的結合蛋白隨後再通過細胞抽提物組分分離方法被進一步分開。
未結合蛋白的自由DNA在凝膠上遷移最快,而與蛋白質結合的DNA遷移慢,一般結合的蛋白質分子越大,DNA分子的延滯現象越明顯,然後通過放射自顯影分析,即可發現一系列DNA帶譜,每條帶分別代表不同的DNA-蛋白質複合物。每條帶相對應的結合蛋白隨後再通過細胞抽提物組分分離方法被進一步分開。

非組蛋白
特性
①酸鹼性:組蛋白是鹼性的,而非組蛋白則大多是酸性的。
②多樣性:非組蛋白占染色質蛋白的60%~70%,不同組織細胞中其種類和數量都不相同,代謝周轉快。包括多種參與核酸代謝與修飾的酶類如DNA聚合酶和RNA聚合酶、HGM蛋白(high mobility group protein)、染色體支架蛋白、肌動蛋白和基因表達蛋白等。
③特異性:能識別特異的DNA序列,識別信息來源於DNA核苷酸序列本身,識別位點存在於DNA雙螺旋的大溝部分,識別與結合靠氫鍵和離子鍵。在不同的基因組之間,這些非組蛋白所識別的DNA序列在進化上是保守的。這類序列特異性DNA結合蛋白具有一個共同特徵,即形成與DNA結合的螺旋區並具有蛋白二聚化的能力。
④功能多樣性:雖然與DNA特異序列結合的蛋白質在每一個真核細胞中只有10 000個分子左右,約佔細胞總蛋白的1/50 000,但具有多方面的重要功能,包括基因表達的調控和染色質高級結構的形成。如幫助DNA分子摺疊,以形成不同的結構域;協助啟動DNA複製,控制基因轉錄,調節基因表達等。
結構模式
雖然非組蛋白種類眾多,但是根據它們與DNA結合的結構域不同,可分為不同的家族。
①α螺旋-轉角-α螺旋模式(helix - turn - helix motif)
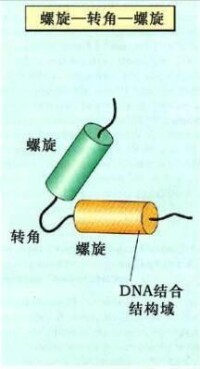
染色質
②鋅指模式(zinc finger motif)
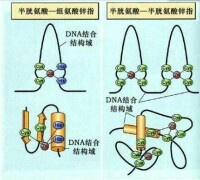
染色質
③亮氨酸拉鏈模式(leucine zipper motif,ZIP)
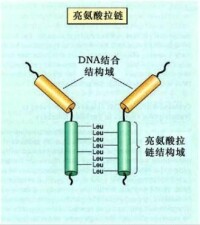
染色質
④螺旋-環-螺旋結構模式(helix - loop - helix motif,HLH)
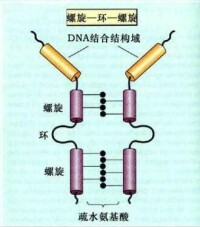
染色質
⑤HMG框結構模式(HMG-box motif)
在發現一組豐富的高速泳動族蛋白(high mobility group protein)以後,首先命名HMG框結構模式。該結構由3個α螺旋組成 boomerang-shaped 結構模式,具有彎曲DNA的能力。因此,具有HMG框結構的轉錄因子又稱為“構件因子(architectural factor)”,它們通過彎曲DNA、促進與鄰近位點相結合的其他轉錄因子的相互作用而激活轉錄。SRY是一種HMG蛋白,在人類男性性別分化中具有關鍵作用,HMG蛋白由Y染色體上一個基因編碼,在誘導睾丸分化途徑中一些相關基因的轉錄活性被HMG蛋白所激活。
20世紀70年代以前,人們關於染色質結構的傳統看法認為,染色質是組蛋白包裹在DNA外面形成的纖維狀結構。直到1974年Kornberg等人根據染色質的酶切和電鏡觀察,發現核小體是染色質組裝的基本結構單位,提出染色質結構的“串珠”模型,從而更新了人們關於染色質結構的傳統觀念。
染色質
2、用非特異性微球菌核酸酶消化染色質時,經過蔗糖梯度離心及瓊脂糖凝膠電泳分析,發現絕大多數DNA被降解成大約 200 bp的片段;如果部分酶解,則得到的片段是以 200 bp為單位的單體、二體、三體等。蔗糖梯度離心得到的不同組分,在波長 260 nm的吸收峰的大小和電鏡下所見到的單體、二體和三體的核小體組成完全一致。如果用同樣方法處理裸露的DNA,則產生隨機大小的片段群體。從而提示染色體DNA除某些周期性位點之外均受到某種結構的保護,避免酶的接近。
3、應用X射線衍射、中子散射和電鏡三維重建技術,研究染色質結晶顆粒,發現核小體顆粒是直徑為 11 nm、高 6.0 nm的扁圓柱體,具有二分對稱性。核心組蛋白的構成是先形成(H3)-(H4)四聚體,然後再與兩個H2A-H2B異二聚體結合形成八聚體。
4、SV40微小染色體分析。用SV40病毒感染細胞,病毒DNA進入細胞后,與宿主的組蛋白結合,形成串珠狀微小染色體,電鏡觀察SV40 DNA為環狀,周長1 500 nm,約 5.0 kb。若 200 bp相當於一個核小體,則可形成25個核小體,實際觀察到23個,與推斷基本一致。如用0.25mol/L鹽酸將SV40溶解,可在電鏡下直接看到組蛋白的聚合體,若除去組蛋白,則完全伸展的DNA長度恰好為 5.0 kb。
1、每個核小體單位包括 200 bp左右的DNA超螺旋和一個組蛋白八聚體以及一個分子的組蛋白H1。
2、組蛋白八聚體構成核小體的盤狀核心顆粒,相對分子質量100 000,由4個異二聚體組成,包括兩個H2A-H2B和兩個H3-H4。
3、146 bp的DNA分子超螺旋盤旋組蛋白八聚體1.75圈。組蛋白H1在核心顆粒外結合額外 20 bp DNA,鎖住核小體DNA的進出端,起穩定核小體的作用。
4、兩個相鄰核小體之間以連接DNA相連,典型長度 60 bp,不同物種變化值為 0~80 bp不等。
5、組蛋白與DNA之間的相互作用主要是結構性的,基本不依賴於核苷酸的特異序列。正常情況下不與組蛋白結合的DNA,當與從動、植物中分離鈍化的組蛋白共同孵育時,可以體外組裝成核小體亞單位。實驗表明,核小體具有自組裝的性質。
6、核小體沿DNA的定位受不同因素的影響。如非組蛋白與DNA特異性位點的結合,可影響鄰近核小體的相位;DNA盤繞組蛋白核心的彎曲也是核小體相位的影響因素,因為富含AT的DNA片段優先存在於DNA雙螺旋的小溝,面向組蛋白八聚體,而富含GC的DNA片段優先存在於DNA雙螺旋的大溝,面向組蛋白八聚體,結果核小體傾向於形成富含AT和富含GC的理想分佈,從而通過核小體相位改變影響基因表達。
整個過程如下:
①最開始是H3·H4四聚體的結合,由CAF-1介導與新合成的裸露的DNA結合。
②然後是兩個H2A·H2B二聚體由NAP-1和NAP-2介導加入。為了形成一個核心顆粒,新合成的組蛋白被特異地修飾。組蛋白H4的Lys5和Lys12兩個位點典型地被乙醯化。
③核小體最後的成熟需要ATP來創建一個規則的間距以及組蛋白的去乙醯化。ISWI和SWI/SNF家族的蛋白參與此過程的調節。連接組蛋白(H1)的結合伴隨著核小體的摺疊。
④4個核小體 組成一個螺旋或由其他的組裝方式形成一個螺線管結構。
⑤進一步的摺疊事件將使染色質在細胞核中最終形成確定的結構。
染色質
在真核生物細胞周期的S期,染色體的完全複製不僅需要基因組DNA的複製,也需要把複製好的DNA組裝成染色質。普遍認為,在複製叉的移動期間,染色質短暫地解組裝,然後在兩條複製好的子代DNA鏈上重新進行組裝。新複製的DNA主要通過以下兩種途徑組裝成染色質:第一,在複製叉的移動期間,父代的核小體核心顆粒與DNA分離,到該段DNA複製完成,父代的核小體核心顆粒直接轉移到兩條子鏈DNA的一條上;第二,染色質組裝因子利用剛剛合成的、乙醯化的組蛋白介導核小體在複製DNA上組裝。
染色質組裝的前期過程,即從裸露DNA組裝成直徑30納米的螺線管已有直接的實驗證據,並被絕大多數科學家認可。然而,染色質如何進一步組裝成更高級結構,直至最終成染色體的過程尚不是非常清楚,主要有兩種模型。
人的每個體細胞所含DNA約6×109bp分佈在46條染色體中,總長達2米,平均每條染色體DNA分子長約5厘米,而細胞核直徑只有5~8微米,這就意味著從染色質DNA組裝成染色體要壓縮近萬倍,相當於一個網球內包含有2千米長的細線。
多級螺旋模型
由DNA與組蛋白組裝成核小體,在組蛋白H1的介導下核小體彼此連接形成直徑約10納米的核小體串珠結構,這是染色質組裝的一級結構。不過在細胞中,染色質很少以這種伸展的串珠狀形式存在。當細胞核經溫和處理后,在電鏡下往往會看到直徑為30納米的染色質纖維。在有組蛋白H1存在的情況下,由直徑10納米的核小體串珠結構螺旋盤繞,每圈6個核小體,形成外徑25~30納米,螺距12納米的螺線管。組蛋白H1對螺線管的穩定起著重要作用。螺線管是染色質組裝的二級結構。
Bak等(1977)從胎兒離體培養的分裂細胞中分離出染色體,經溫和處理后,在電鏡下看到直徑0.4微米,長11~60微米的染色線,成為單位線。在電鏡下觀察,判明單位線是由螺線管進一步螺旋化形成直徑為0.4微米的圓筒狀結構,稱為超螺線管,這是染色質組裝的三級結構。這種超螺線管進一步螺旋摺疊,形成長2~10微米的染色單體,即染色質組裝的四級結構。經過四級螺旋組裝形成的染色體結構,共壓縮了8 400倍。
骨架-放射環結構模型
Laemmli等人用2mol/L的NaCl或硫酸葡聚糖加肝素處理HeLa細胞中期染色體,除去組蛋白和大部分非組蛋白后,在電鏡下可觀察到由非組蛋白構成的染色體骨架和由骨架伸出的無數的DNA側環。此外,實驗觀察發現,不論是原核細胞的染色體還是兩棲類卵母細胞的燈刷染色體或昆蟲的多線染色體,幾乎都含有一系列的袢環結構域,從而提示袢環結構可能是染色體高級結構的普遍特徵。
該模型認為,30納米的染色線摺疊成環,沿染色體縱軸,由中央向四周伸出,構成放射環,即染色體的骨架-放射環結構模型。首先是直徑2納米的雙螺旋DNA與組蛋白八聚體構建成連續重複的核小體串珠結構,其直徑10納米。然後按每圈6個核小體為單位盤繞成直徑30納米的螺線管。由螺線管形成DNA複製環,每18個複製環呈放射狀平面排列,結合在核基質上形成微帶。微帶是染色體高級結構的單位,大約10個微帶沿縱軸構建成子染色體。
如果說細胞核是細胞遺傳與代謝的調控中心,那麼這個中心的最重要成員便是染色質。幾乎所有細胞生命活動都要從染色質開始。我們知道細胞的成長、分裂甚至衰老與死亡都是受基因控制的,而細胞內基因存在與發揮功能的結構基礎是染色質。與基因組直接相關的細胞活動都是在染色質水平進行的,如DNA複製、基因轉錄、同源重組、DNA修復,包括轉錄耦聯的修復以及DNA和組蛋白的各種修飾。這些修飾包括甲基化、乙醯化、磷酸化、亞硝基化和泛素化等。
真核生物的基因組都是在細胞核的三維空間中發揮功能,如基因組的複製、DNA 突變、DNA 修復、基因的轉錄和調控、長鏈非編碼 RNA 的傳播和胚胎髮育等。
間期染色質按其形態特徵、活性狀態和染色性能區分為兩種類型:常染色質和異染色質。按功能狀態的不同可將染色質分為活性染色質和非活性染色質。
常染色質是指間期細胞核內染色質纖維摺疊壓縮程度低,相對處於伸展狀態,用鹼性染料染色時著色淺的那些染色質。在常染色質中,DNA組裝比為1/2 000~1/1 000,即DNA實際長度為染色質纖維長度的1 000~2 000倍。構成常染色質的DNA主要是單一序列DNA和中度重複序列DNA。常染色質並非所有基因都具有轉錄活性,處於常染色質狀態只是基因轉錄的必要條件,而不是充分條件。
異染色質是指間期細胞核中,染色質纖維摺疊壓縮程度高,處於聚縮狀態,用鹼性染料染色時著色深的那些染色質。異染色質又分為結構異染色質(組成型異染色質)和兼性異染色質。結構異染色質指的是各種類型的細胞中,除複製期以外,在整個細胞周期均處於聚縮狀態,DNA組裝比在整個細胞周期中基本沒有較大變化的異染色質。兼性異染色質是指在某些細胞類型或一定的發育階段,原來的常染色質聚縮,並喪失基因轉錄活性,變為異染色質。
活性染色質是指具有轉錄活性的染色質。活性染色質的核小體發生構象改變,具有疏鬆的染色質結構,從而便於轉錄調控因子與順式調控元件結合和RNA 聚合酶在轉錄模板上滑動。
活性染色質主要特徵活性:染色質具有DNase I超敏感位點(DNase I hypersensitive site);活性染色質很少有組蛋白H1與其結合;活性染色質的組蛋白乙醯化程度高;活性染色質的核小體組蛋白H2B很少被磷酸化;活性染色質中核小體組蛋白H2A在許多物種很少有變異形式;HMG14和HMG17隻存在於活性染色質。
非活性染色質是指不具有轉錄活性的染色質。