共找到3條詞條名為萃取的結果 展開
- 分離混合物的單元操作
- 遊戲英雄聯盟中的裝備
- 2008年化學工業出版社出版的圖書
萃取
分離混合物的單元操作
萃取,又稱溶劑萃取或液液萃取,亦稱抽提,是利用系統中組分在溶劑中有不同的溶解度來分離混合物的單元操作。即,是利用物質在兩種互不相溶(或微溶)的溶劑中溶解度或分配係數的不同,使溶質物質從一種溶劑內轉移到另外一種溶劑中的方法。廣泛應用於化學、冶金、食品等工業,通用於石油煉製工業。另外將萃取后兩種互不相溶的液體分開的操作,叫做分液。
固-液萃取,也叫浸取,用溶劑分離固體混合物中的組分,如用水浸取甜菜中的糖類;用酒精浸取黃豆中的豆油以提高油產量;用水從中藥中浸取有效成分以製取流浸膏叫“滲瀝”或“浸瀝”。
雖然萃取經常被用在化學試驗中,但它的操作過程並不造成被萃取物質化學成分的改變(或說化學反應),所以萃取操作是一個物理過程。
萃取是有機化學實驗室中用來提純和純化化合物的手段之一。通過萃取,能從固體或液體混合物中提取出所需要的物質。
原理示意圖
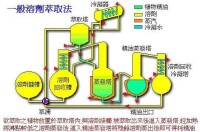
溶劑萃取工藝過程一般由萃取、洗滌和反萃取組成。一般將有機相提取水相中溶質的過程稱為萃取(extraction),水相去除負載有機相中其他溶質或者包含物的過程稱為洗滌(scrubbing),水相解析有機相中溶質的過程稱為反萃取(stripping)。
分配定律是萃取方法理論的主要依據,物質對不同的溶劑有著不同的溶解度。同時,在兩種互不相溶的溶劑中,加入某種可溶性的物質時,它能分別溶解於兩種溶劑中,實驗證明,在一定溫度下,該化合物與此兩種溶劑不發生分解、電解、締合和溶劑化等作用時,此化合物在兩液層中之比是一個定值。不論所加物質的量是多少,都是如此。屬於物理變化。用公式表示。

分液漏斗
要把所需要的溶質從溶液中完全萃取出來,通常萃取一次是不夠的,必須重複萃取數次。利用分配定律的關係,可以算出經過萃取后化合物的剩餘量。
設:V為原溶液的體積
為萃取前化合物的總量
為萃取一次后化合物的剩餘量
為萃取二次后化合物的剩餘量
為萃取n次后化合物的剩餘量
S為萃取溶液的體積
經一次萃取,原溶液中該化合物的濃度為;而萃取溶劑中該化合物的濃度為;兩者之比等於K,即:
同理,經二次萃取后,則有
即
因此,經n次提取后:
當用一定量溶劑時,希望在水中的剩餘量越少越好。而上式總是小於1,所以n越大,就越小。也就是說把溶劑分成數次作多次萃取比用全部量的溶劑作一次萃取為好。但應該注意,上面的公式適用於幾乎和水不相溶地溶劑,例如苯,四氯化碳等。而與水有少量互溶地溶劑乙醚等,上面公式只是近似的。但還是可以定性地指出預期的結果。

用四氯化碳萃取碘水中的碘
要求:萃取劑和原溶劑互不混溶。
萃取劑和溶質互不發生反應。
溶質在萃取劑中的溶解度遠大於在原溶劑中的溶解度。
相關規律:有機溶劑易溶於有機溶劑,極性溶劑易溶於極性溶劑,反之亦然。
1842年 E.-M.佩利若研究了用乙醚從硝酸溶液中萃取硝酸鈾醯。1903年L.埃迪蘭努用液態二氧化硫從煤油中萃取芳烴,這是萃取的第一次工業應用。
20世紀40年代後期,生產核燃料的需要促進了萃取的研究開發。
現今萃取通用於石油煉製工業,並廣泛應用於化學、冶金、食品和原子能等工業。如,萃取已應用於石油餾分的分離和精製,鈾、釷、鈈的提取和純化,有色金屬、稀有金屬、貴重金屬的提取和分離,抗菌素、有機酸、生物鹼的提取,以及廢水處理等。
向待分離溶液(料液)中加入與之不相互溶解(至多是部分互溶)的萃取劑,形成共存的兩個液相。利用原溶劑與萃取劑對各組分的溶解度(包括經化學反應后的溶解)的差別,使它們不等同地分配在兩液相中,然後通過兩液相的分離,實現組分間的分離。如碘的水溶液用四氯化碳萃取,幾乎所有的碘都移到四氯化碳中,碘得以與大量的水分開。
最基本的操作是單級萃取。它是使料液與萃取劑在混合過程中密切接觸,讓被萃組分通過相際界面進入萃取劑中,直到組分在兩相間的分配基本達到平衡。然後靜置沉降,分離成為兩層液體,即由萃取劑轉變成的萃取液和由料液轉變成的萃余液。單級萃取達到相平衡時,被萃組分B的相平衡比,稱為分配係數K,即:
式中和分別為B組分在萃取液中和萃余液中的濃度。濃度的表示方法需考慮組分的各種存在形式,按同一化學式計算。
若料液中另一組分D也被萃取,則組分B的分配係數對組分D的分配係數的比值,即B對D的分離因子,稱為選擇性係數α,即:
時,組分B被優先萃取;表明兩組分在兩相中的分配相同,不能用此萃取劑實現此兩組分的分離。
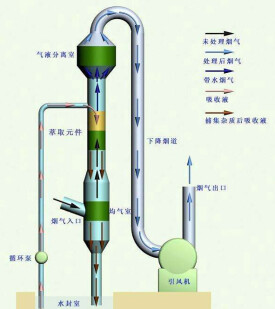
單級萃取對給定組分所能達到的萃取率(被萃組分在萃取液中的量與原料液中的初始量的比值)較低,往往不能滿足工藝要求,為了提高萃取率,可以採用多種方法:①多級錯流萃取。料液和各級萃余液都與新鮮的萃取劑接觸,可達較高萃取率。但萃取劑用量大,萃取液平均濃度低。②多級逆流萃取。料液與萃取劑分別從級聯(或板式塔)的兩端加入,在級間作逆向流動,最後成為萃余液和萃取液,各自從另一端離去。料液和萃取劑各自經過多次萃取,因而萃取率較高,萃取液中被萃組分的濃度也較高,這是工業萃取常用的流程。③連續逆流萃取。在微分接觸式萃取塔(見萃取設備)中,料液與萃取劑在逆向流動的過程中進行接觸傳質,也是常用的工業萃取方法。料液與萃取劑之中,密度大的稱為重相,密度小的稱為輕相。輕相自塔底進入,從塔頂溢出;重相自塔頂加入,從塔底導出。萃取塔操作時,一種充滿全塔的液相,稱連續相;另一液相通常以液滴形式分散於其中,稱分散相。分散相液體進塔時即行分散,在離塔前凝聚分層后導出。料液和萃取劑兩者之中以何者為分散相,須兼顧塔的操作和工藝要求來選定。此外,還有能達到更高分離程度的迴流萃取和分部萃取。

多級液液萃取器
例如,萃取實驗:將碘水與四氯化碳或苯混合,搖勻,之後蒸餾得碘晶體。