共找到2條詞條名為人工肝的結果 展開
- 中型肝炎、肝衰竭最重要和最常用的治療方法之一
- 生物醫學工程領域--人工肝臟
人工肝
中型肝炎、肝衰竭最重要和最常用的治療方法之一
各種原因所致的重型肝炎及肝臟功能衰竭臨床上十分常見,一般治療效果差,臨床死亡率一直居高不下,成為危及肝病患者生命的主要原因。中國國內肝臟移植病例數近3年幾乎以倍數增長,但因為價格昂貴、供肝短缺、文化觀念及技術因素的限制,還遠未普及。人工肝就是在此背景下逐步形成的一套以血液凈化為基礎的實用性很強的治療方法,目前在國內外迅速發展和普及,已經成為中型肝炎、肝衰竭及其它一些疾病最重要和最常用的治療方法之一。
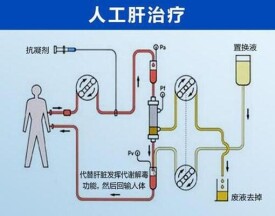
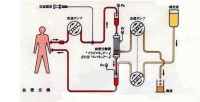
人工肝臟是藉助體外機械、化學或生物性裝置,暫時及部分替代肝臟功能,從而協助治療肝功能不全、肝衰竭或相關肝臟疾病的方法。人工肝與一般內科藥物治療的主要區別在於,前者主要通過“功能替代”治病,後者主要通過“功能加強”治病。由於人工肝以體外支持和功能替代為主,故又稱人工肝支持系統(artificialliver support system,alss)。目前根據其組成和性質主要可分為三類:
1、非生物型,又稱物理型,主要通過物理或機械的方法進行治療,包括血漿置換(plasmaexchange,pe)、血漿
人工肝
3、混合型,由生物與非生物型結合組成的具有兩者功能的人工肝支持系統。也有人認為,象血漿置換等方法,在去除有害物質的同時,補充了凝血因子等生物活性成分,可單獨歸為一類,即中間型或過渡型人工肝,但三型分類法可能更簡明和被普遍認可。
人工肝的用途歸納起來主要有以下幾個方面:
人工肝
2、為肝移植創造條件,是重型肝炎肝移植的橋樑;協助治療肝移植后的最初無功能狀態;
3、作為輔助措施有助於行肝極量切除術,或作為肝臟特殊或應激情況下的輔助治療手段。
人工肝
血液灌流的確切含義是血液吸附,即溶解在血液的物質被吸附到具有豐富表面積的固態物質上藉以從血液中清除毒物。血液灌流技術的缺點是不能有效的吸附一些小分子毒物,活性炭對與部分白蛋白結合的毒素吸附能力較差。因為使用非特異性的吸附劑,因此,除了毒性物質被清除外,也清除一些肝細胞生長因子和激素,如果吸附劑的生物相容性差,還可以激活補體系統引起系統炎性反應。血液濾過是將患者的血液引入具有良好通透性並與腎小球濾過面積相當的半透膜濾器中,模擬人體正常腎小球濾過原理,以對流的方式濾過清除血液中的水分和溶質,並以補充置換液的方法模擬腎小管的重吸收功能。血液濾過原先用於腎臟替代治療,但由於其能清除多餘的水分、中分子物質、一些炎性介質及細胞因子,而肝衰竭時常有水鈉瀦留、電解質酸鹼平衡紊亂、肝腎綜合症、肝性腦病、感染等多種併發症,因而血液濾過被越來越多的用於肝衰竭的治療。

人工肝
2、雙重濾過血漿凈化(dfpp)雙重濾過血漿凈化(double filtration plasmapheresis,dfpp)的原理是藉助血漿交換機等動力驅動,患者血液被引出體外,在持續抗凝下,全血不斷流經一級血漿分離器而分出血漿,後者再經過分子截留量在30nm左右的二級血漿分離器分離出病毒。濾過病毒后的血漿與患者血液細胞成分混合併返回體內。hcv屬於有包膜的正鏈rna病毒,病毒顆粒大小為30-80nm。丙型肝炎抗病毒治療最常用的藥物是干擾素(interferon),且干擾素的療效與治療開始前血液病毒載量有關,病毒載量與療效負相關。因此,如何在抗病毒藥物應用之前即快速降低血清病毒載量,可能是提高幹擾素效果的方法。有作者等進行了感染hcv黑猩猩的dfpp治療,進行了兩個循環的血漿量處理,實施過程安全,實施后hcv-rna數量減少了35%,提示血液凈化技術在肝病的應用具有更廣闊的前景。

人工肝
生物透析吸附治療系統(biologic-dt)將活性炭、樹脂和透析的方法結合起來,由專門配置的透析吸附液及其循環管路構成。透析液內除含有水、血液中主要電解質外,尚有精製粉末炭、葡萄糖等成分,有時還依據病情添加陽
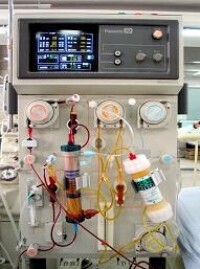
人工肝
4、其它非生物型人工肝方法的聯合應用 yoshiba將血漿置換與持續性血液透析濾過結合起來,治療了27位暴發性肝炎患者,取得較好效果。某學者採用緩慢式血漿交換,並用持續性血液透析濾過,對於嚴重肝功能不全病例的意識恢復是有效的,生存率亦有所提高,同時血漿膠體滲透壓的急劇變化及水鈉儲留等,血漿置換的副作用,會大幅度下降。此外,血漿置換 血漿灌流,血液濾過 血液灌流,膽紅素吸附 血漿灌流等方法也被國內外眾多學者採用。可以預見,把不同非生物型血液凈化技術結合構成的人工肝支持方法在臨床上的應用會愈加廣泛。
早期的生物型人工肝裝置因療效不肯定,副反應大及操作複雜等被逐漸放棄。
20世紀80年代後期,生物型人工肝一般專指人工培養的肝細胞為基礎構件的體外生物反應系統。它不僅具有肝臟的特異性解毒功能,而且具有更高的效能,如參與能量代謝,具有生物合成轉化功能,分泌促肝細胞生長活性物質等。因為肝衰竭患者血漿中毒性物質對體外的肝細胞有損害,因此目前的生物人工肝一般先用活性炭吸附或血漿置換去除患者血漿中的部分毒性物質,再與反應器中的肝細胞進行物質交換。這種把非生物型與生物型人工肝結合的裝置即所謂組合型生物人工肝。動物和初步臨床研究提示,這類人工肝裝置對暴發性肝衰竭有一定療效。
人工肝樣機
目前,國內已有生物型人工肝支持儀獲國家藥品監督管理局批准,可用於臨床的治療。該儀器由生物培養裝置和混合血漿池構成,形成血漿分離、血漿吸附、血漿置換等功能的混合型人工肝支持系統,具有自動化程度高,操作簡單,安全可靠的特點。其治療重型肝炎的臨床結果顯示,顯效率為36.7%,有效率為46.7%,總有效率為83.3%。國外的生物型人工肝治療儀除個別由人C3A細胞(人肝臟成纖維細胞癌等)組成外,其餘多以豬肝細胞為生物部分。目前這些生物人工肝正在進行Ⅱ/Ⅲ期臨床試驗,尚未獲得FDA批准。
一是使用體外培養的異種/異源肝細胞以及腫瘤細胞可能引起的異體排斥反應,並可能有潛在的人畜共患疾病及致癌的危險。二是體外培養細胞替代自然肝臟的能力有限,而且受肝細胞培養技術,大規模生產,保存和運輸的生物材料限制,使生物人工肝的臨床推廣受到一定限制。