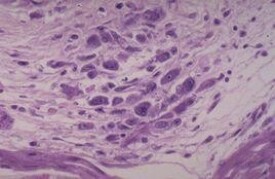
風濕細胞
體積大圓形多邊形的細胞
病灶部位的心臟組織細胞聚集、增生。當他們吞噬纖維素壞死物后,轉變成風濕細胞或阿少夫細胞(Aschoff cell)。風濕細胞體積大,圓形、多邊形,邊界清楚而不整。胞漿豐富均質而微嗜雙色。核大,圓形或卵圓形,核膜清晰,染色質集中於中央,橫切面呈梟眼狀,縱切面呈毛蟲狀,稍後則核變得濃染結構不清。
風濕細胞或阿少夫細胞(Aschoff cell):風濕性病變增生期或肉芽腫期,在心臟或其他組織間質中,巨噬細胞增生,聚積,吞噬纖維樣壞死物,轉變為Aschoff cell。風濕細胞體積大,圓形、多邊形,胞漿豐富均質,核大,圓或卵圓形,核膜清晰,染色體集中於中央並呈細絲狀向核膜放散,因而核的橫切面似梟眼狀,稱梟眼細胞(Owl-eye cell),其長形核的縱切面象毛蟲,稱其為:毛蟲細胞(caterpillar cell),Aschoff cell也可見雙核或多核者,有人稱其為Aschoff巨細胞。
【概述】
風濕病是一種因A組溶血性鏈球菌感染而引起的,反覆發作的急性或慢性全身結締組織炎症。病變主要損害關節、心臟,其次為皮膚、血管漿膜和腦組織等。以發熱,遊走、對稱及多發性大關節炎,環形紅斑,皮下結節,不同程度的心臟炎(即慢性風濕性心臟病,詳見心血管系統),舞蹈病為主要臨床特徵。
急性風濕熱常侵犯兒童及青少年,初次發作多在5~15歲,3歲以內嬰幼兒極為少見,男女罹病機會大致相等。複發多在初發后3~5年內。發作季節以寒冬、早春居多,寒冷和潮濕是本病的重要誘發因素。
【病因病理】
風濕病的病因有內因和外因兩方面:內因為幼年陽盛,或素體虛弱;外因為風寒濕等邪雜至,由表入里,郁於經絡,阻遏氣血,痹而成病。
病理變化為年少陽盛,內有蘊熱,復感風寒濕邪,里熱為外邪所郁,流注關節、肌肉,氣血不利,發為風熱痹。或素體氣虛,衛表不固,風夾寒邪或濕邪,侵虛襲入,留於關節,郁於筋脈,氣血凝滯,而致風寒痹或風濕痹。邪郁日久,則由表及裡,由淺及深,由經絡而臟腑。如邪郁肌膚筋脈測見皮下結節。侵入營血,損傷絡脈,則見皮下紅斑。痹阻心脈,則見心痹。
此外,邪郁化熱,耗氣傷陰,每致氣陰兩虛之候。
【診斷要點】
⒈遊走性、多發性及對稱性大關節酸痛或疼痛,可伴局部紅、腫、熱、痛及活動受限。關節外表現為發熱,環形紅斑,皮下結節,心臟炎,舞蹈症等。
⒉抗鏈球菌抗體(ASO)增高,血沉增快,黏蛋白增高,白細胞計數增高。
風濕病的細胞治療是近年來研究的熱點,在2008年6月召開的歐洲抗風濕病聯盟(EULAR)第七屆年會上,有多篇論文對細胞移植治療自身免疫性疾病和風濕病的療效進行了分析和評價。
法國Farge報告了EBMT/EULAR造血幹細胞移植(HSCT)治療自身免疫病(AD)最新資料,至2006年5月他們用HSCT治療AD共723例,其中10例進行了2次移植,2例3次移植,43例為異基因移植(6%)。所治療的疾病中多發性硬化(MS)最多,為228例,系統性硬化症(SSc)126例,系統性紅斑狼瘡(SLE)79例,類風濕關節炎(RA)76例,幼年特發性關節炎62例,餘152例為其他AD。近5年來,適應證的嚴格掌握及一些有效治療方法的問世(如生物製劑的廣泛應用),大大減少了難治性AD患者的HSCT治療。據有關資料顯示,1994-2000年HSCT治療的AD移植相關死亡率高達16%,而2001-2005年則減至3%。SLE和RA的HSCT治療療效相似,平均隨訪6個月,約2/3左右的患者移植后仍可保持緩解,約1/3患者複發,但病情較移植前輕,且較易控制。
荷蘭Vonk等報告,26例SSc患者接受自體外周血幹細胞移植,平均隨訪63(12~91)個月,23例患者仍生存,2例患者移植后18個月死於複發,1例死於肺癌,沒有觀察到移植晚期的毒性作用。84.6%(22/26例)患者在移植后6個月和73.1%(19/26例)患者在移植后12個月Rodnan皮膚評分明顯改善(>25%),93.8%(15/16例)患者改善持續5年,平均肺活量從76%增加至96%(移植后0~3年),肺彌散功能、肌酐清除率和左室射血分數移植前後沒有明顯變化。
荷蘭VanLaar等報告了歐洲20個中心正在進行的ASTIS試驗(自體幹細胞移植國際系統性硬化症試驗),比較HSCT和每月靜注環磷醯胺(CTX,750mg/m2)兩治療組的安全性和療效。至2006年1月,共納入65例SSc患者(男27例,女38例),平均肺活量75%,平均CO彌散率55%;其中29例入移植組,36例入CTX組,平均隨訪18個月(1~58個月),未觀察到兩組明顯的毒性反應及移植相關死亡,療效有待ASTIS試驗完成後得出。
荷蘭Van報告HSCT治療AD的療效與預處理時免疫摧毀的強度有關,以及回輸進入體內的自活化淋巴細胞數目有關。因此,明確在AD發病中起作用的自活化細胞數量,是制定自體HSCT治療AD預處理方案的依據。
德國Alexander等分析了SLE患者接受自體HSCT后胸腺功能活化的情況,7例患者移植后平均隨訪46個月,1例移植后17個月複發。預處理用CTX+兔抗胸腺球蛋白抗體,HSCT后1個月患者循環中的T輔助細胞(Th)主要是CD45RO+記憶細胞。T細胞受體(TCR)分析發現CD4+細胞TCRβ高表達,胸腺天然Th細胞(CD31+)絕對值在移植后6~12個月逐漸增加且保持在穩定的數量長達7年或更長時間。調節性T細胞(Treg)CD4+、CD25+細胞數在HSCT后恢復正常水平,移植后Treg細胞FoxP3表達較正常高,提示移植后胸腺功能有反跳(rebound)。他們推測HSCT治療SLE后,胸腺功能的恢復有助於新的免疫耐受的建立和參與抑制自活化克隆的形成,這種抑制作用可能是通過Treg細胞的產生而實現的。
間質幹細胞(MSC)有多向分化潛能及免疫調節作用,由於它們較大的可塑性使MSC有可能作為細胞治療AD的理想手段。
義大利學者進行SSc患者骨髓MSC分化為內皮樣細胞(EC)的研究,發現SSc患者MSC分化的EC血管內皮生長因子受體2(VEGFγ2)、趨化因子受體4(CXCR4)的陽性百分比顯著低於正常,且VEGFγ2+/CXCR4+也顯著下降。
比利時Lories報告,破壞和修復的分子信號傳導途徑決定炎性關節炎如RA的嚴重性和後果,關節疾病中胚胎分子信號途徑如骨形態形成蛋白(BMP)和Wnts活化,MSC分佈於滑膜,它們可能成為這些信號途徑的靶細胞,抑制BMP或增強Wnts途徑能幹擾小鼠強直性肌腱端炎。MSC在關節微環境中可能有免疫調節作用,不同關節炎患者的關節內MSC的作用可能不同。由於MSC能定向分化成骨細胞、肌細胞、脂肪細胞和內皮細胞等,它們對AD引起的組織損傷如SSc肺、狼瘡腎等病變組織的修復治療是今後值得進一步研究的課題。
德國柏林Hiege報告了歐洲細胞治療協作組2005年成立以來的工作,他們還報告,自活化的記憶性漿細胞在自身免疫病的維持和疾病複發中起了重要作用,CTX治療時漿細胞能持續存活,漿細胞有可能成為AD的靶向治療目標。