五水硫酸銅
化學類礦物質
五水硫酸銅(化學式:CuSO4·5H2O)也被稱作硫酸銅晶體,為了與“無水硫酸銅”區別,通常讀作“五水合硫酸銅”,相對分子質量為250。俗稱藍礬、膽礬或銅礬。具有催吐,祛腐,解毒;治風痰壅塞,喉痹,癲癇,牙疳,口瘡,爛弦風眼,痔瘡,腫毒的功效並且有一定的副作用。

硫酸銅晶體

五水合硫酸銅
膽礬是天然的含水硫酸銅,是五水硫酸銅(CuSO₄·5H₂O)的俗稱,為了與“無水硫酸銅”區別,通常讀作“五水合硫酸銅”,相對分子質量為250,是分佈很廣的一種硫酸鹽礦物。它是銅的硫化物被氧分解后形成的次生礦物。
膽礬產於銅礦床的氧化帶,也經常出現在礦井的巷道內壁和支柱上,這是由礦井中的水結晶而成的。
膽礬的晶體成板狀或短柱狀,這些晶體集合在一起則呈粒狀、塊狀、纖維狀、鍾乳狀、皮殼狀等。它們具有漂亮的藍色,但如果暴露在乾燥的空氣中會由於失去水而變成不透明的淺綠白色粉末。同時膽礬極易溶於水。
膽礬是顏料、電池、殺蟲劑、木材防腐等方面的化工原料。
來源 天然或人工製造的含水硫酸銅結晶體。形狀 為不規則的塊狀結晶體,大小不一,深藍色或淡藍色,半透明。置露於乾燥空氣中,緩緩風化。加熱燒之,即失去結晶水變成白色,遇水則又變藍。質脆,易碎,能溶於水。無臭,味苦、澀。性味 酸、辛,寒。有毒。功能主治 祛風痰,消積滯,燥濕殺蟲。用於風熱痰涎壅塞,癲癇;外用治口瘡,風眼赤爛,瘡瘍腫毒。用法用量 1~2分,多入丸、散劑。外用適量,研粉敷或泡湯洗患處。摘錄《全國中草藥彙編》性質
五水硫酸銅在常溫常壓下很穩定,不潮解,在乾燥空氣中會逐漸風化,加熱至45℃時失去二分子結晶水,110℃時失去四分子結晶水,稱作一水硫酸銅,200℃時失去全部結晶水而成無水物。也可在濃硫酸的作用下失去五個結晶水。無水物也易吸水轉變為水合硫酸銅。吸水后反應生成五水硫酸銅(藍色),常利用這一特性來檢驗某些液態有機物中是否含有微量水分(如對酒精是否含水進行鑒定,在待鑒定酒精中加入少許無水硫酸銅,如白色無水硫酸銅變藍色,則說明酒精中摻有水)。二者注意區分。
將無水硫酸銅加熱至650℃高溫,可分解為黑色氧化銅、二氧化硫及氧氣(或三氧化硫)。
膽礬是天然的含水硫酸銅,是分佈很廣的一種硫酸鹽礦物。它是銅的硫化物被氧分解后形成的次生礦物。
無水硫酸銅可檢驗其他物質中是否有水揣均的存在。
R22Harmful if swallowed.
吞食有害。
R36/38Irritating to eyes and skin.
刺激眼睛和皮膚。
R50/53Very toxic to aquatic organisms, may cause long-term adverse effects in the aquatic environment.
對水生生物有極高毒性,可能對水體環境產生長期不良影響。
Do not breathe dust.
切勿吸入粉塵。
This material and its container must be disposed of as hazardous waste.
該物質及其容器須作為危險性廢料處置。
Avoid release to the environment. Refer to special instructions / safety data sheets.
避免釋放至環境中。參考特別說明/安全數據說明書。
三斜晶系。晶體作扳狀或短柱狀,通常為緻密塊狀、鍾乳狀、被膜狀、腎狀,有時具纖維狀。顏色為天藍、藍色,有時微帶淺綠。條痕無色或帶淺藍。光澤玻璃狀。半透明至透明。斷口貝殼狀。硬度2.5。比重2.1~2.3。性極脆。常產於銅礦的次生氧化帶中。
為不規則的塊狀結晶體,大小不一。深藍或淺藍色,半透明。似玻璃光澤。質脆,易碎,碎塊呈稜柱形,斷面光亮。無臭,味澀。以塊大、深藍色、透明、無雜質者為佳。
露置乾燥空氣中,緩緩風化。加熱燒之,則失去結晶水,變成白色,遇水則又變藍色。易溶於水及甘油,不溶於乙醇。水溶液顯銅鹽及硫酸鹽的各種特殊反應。
主產於雲南、山西。
於江西、廣東、陝西、甘肅等地亦產。
利膽:膽礬 0.6g/kg十二指腸給葯對麻醉大鼠能明顯增加膽汁的流量。
膽礬中主要成分為硫酸銅,誤服、超量均可引起中毒。硫酸銅能刺激傳人神經的衝動經迷走及交感神經傳導至延髓的嘔吐中樞。由於反覆劇烈的嘔吐,可致脫水、和休克,同時損害胃粘膜,甚至造成急性胃穿孔。硫酸銅溶液局部有很強的腐蝕作用,能使口腔、食管、胃腸道的粘膜充血、水腫、潰瘍和糜爛。銅也是一種神經肌肉毒,當銅進入人體后,可有全身中毒癥狀,損害肝、腎,引起脂肪變性和壞死,對中樞神經先興奮後轉為抑制。
主要中毒表現為:噁心、嘔吐、流涎、頭痛、頭暈、口中有特殊金屬味,舌苔、牙齒、牙齦可被染為藍色,腹痛、腹瀉、嘔吐物和排泄物也呈藍色,黃疸、小便帶血、心動過速、心律失常、面色蒼白、肝區疼痛、血細胞減少,血壓下降、虛脫、昏迷不醒、呼吸困難等。中毒時間延長時,可造成肝損害,出現血尿、少尿、或無尿。嚴重時可有血管麻痹、血壓急劇下降、脈搏增快、狂躁、譫妄或昏迷抽搐,最後死於循環衰竭。
(1)中毒后立即口服含豐富蛋白質的食品,如蛋清、牛奶、豆漿等,形成蛋白銅鹽而沉澱,阻止胃腸道吸收,保護胃粘膜。而後用l%亞鐵氰化鉀洗胃解毒。
(2)解毒劑首選依地酸二鈉,成人每日1g,小兒每次15~25mg/kg,每日2次,加入10%葡萄糖溶液中靜滴,每個療程不超過5天。也可用青黴胺,成人每次口服0.3g,3~4次/日,小兒每日20~25mg/kg,分3~4次口服,也可用1~3g加入葡萄糖液中靜滴。二巰基丁二酸鈉2g加入20ml注射用水靜脈注射,以後每次1g,4~8小時1次,5天為一療程。
(3)內服通用解毒劑;硫酸鎂37g,硫酸氫鈉12.5g,氫氧化鈉1g,硫化氫4g,加水至1000ml,搖勻,每次50~100ml,口服;硫酸亞鐵飽和液100ml,碳酸鎂88g,藥用炭40g,加水至800ml,混勻,每次服50~100ml。
(4)對症治療:有溶血時可用氫化可的松、碳酸氫鈉,必要時輸血。血壓下降或心力衰竭時,給予抗休克治療。
(1)取本品約1g,加熱灼燒,變為白色,遇水則又變為藍色。(檢查結晶水)加熱硫酸銅晶體生成硫酸銅固體和水。
(2)取本品約0.5g,加水5ml使溶解,濾過,濾液照下述方法試驗。
①取濾液約1ml,滴加氨試液,即生成淡藍色沉澱;再加過量的氨試液,沉澱即溶解,生成深藍色溶液。(檢查銅鹽)
②取濾液約1ml,加亞鐵氰化鉀試液,即顯紅棕色或生成紅棕色沉澱。(檢查銅鹽)
③取濾液約1ml,加氯化鋇試液,即生成白色沉澱;分離,沉澱在鹽酸或硝酸中均不溶解。(檢查硫酸鹽)
預處理飼料級沙狀無水硫酸銅,除具有硫酸銅的功能外還具有在使用過程中,粉塵較少,大大地減少環境污染和對工人皮膚、呼吸道的刺激;同時更能保證預混料中銅的添加量。流動性較好,在生產過程中混合均勻度較好;同時不易出現結塊現象。本品在生產過程中,因為不添加任何載體,故不存在與其它物質接觸而產生的物理、化學變化。由於在預混合飼料、飼料中,與維生素、氨基酸等營養物質的接觸面較小,從而減少對上述營養物質的破壞。由於本品屬沙粒狀,與空氣接觸面小,故可以減少銅離子的氧化,從而提高其效價。遊離酸含量低。硫酸銅晶體中每一組銅離子、硫酸根離子與結晶水分子的個數是1:10,呈藍色,在加熱的條件下,結晶水可全部失去,硫酸銅晶體變成白色。
在製作較大的固體晶體時,由於無水硫酸銅在水中的溶解度受溫度影響較大,所以可以採用高溫溶解,降溫結晶的方法製作。可將較小晶體放在40度左右的飽和溶液中降溫結晶來得到較大晶體。
STEP1
首先我們需要這些東西,硫酸銅AR級,燒杯兩隻(一大一小),培養皿兩隻,玻璃棒一根,濾紙,以及水。
STEP2
沸水400g,(最好使用蒸餾水或去離子水)以及100g硫酸銅。
STEP3
將沸水倒入裝有硫酸銅的燒杯中,攪拌至不再溶解。此時可以看到溶液並不是十分純凈。
STEP4
過濾溶液。
很多人反映說溶液過濾到一半就開始結晶了。在這裡解釋下,有兩種可能:
1.溶液過飽和
2.溶液降溫過快
過濾后的溶液可以看得出非常純凈,透光非常好,呈深藍色。
此處這裡選用的是快速濾紙,如果你的溶液用快速濾紙依舊會結晶,請使用眼鏡布或者重新配置溫度高的接近飽和溶液。
STEP5
將溶液倒進培養皿中,靜置一天。
注意,建議將培養皿放在溫差不大的地方,且這個地方必須是不會有震動,灰塵少的地方。
靜置期間不要把任何東西伸進溶液中,切記!
如果溶液表面有灰,不用擔心,只需要耐心等待結晶即可。因為灰塵會浮在溶液表面。
STEP6
靜置一段時間之後,溶液中會自然降溫結晶出小的單晶,待它們長得符合你想要的大小之後,你就可以用鑷子取出了。注意,只能一次性全部取出,因為你把鑷子伸進溶液中之後,溶液就會在短時間內大量析出小晶粒,那時所有還在溶液中的晶體就都沒用了。
普通晶核大小一般在1-2cm左右.
這裡介紹眾所周知的【懸掛法】
對於懸掛法,這是一種新人很容易上手的培養單晶的方法。
但是缺點在於,晶體中的線會影響晶體的美觀,
以及在培養過程中,晶體很容易長出很多刺。
前者無法解決,後者與晶核的品質以及溶液的好壞有關。

綁線方法
STEP2
配置一杯飽和溶液,將綁好的晶核放進去,一天左右的時間單晶就可以出來了。
要注意的問題就是,溶液是不是飽和或者近飽和了。
如果濃度不夠,那麼晶核就會溶解於其中。
如果過飽和了,就會長成形狀雜亂的晶體。
硫酸銅是較重要的銅鹽之一,在電鍍、印染、顏料、農藥等方面有廣泛應用。無機農藥波爾多液就是硫酸銅和石灰乳混合液,它是一種良好的殺菌劑,可用來防治多種作物的病害。1878年在法國波爾多城,葡萄樹發生蟲病大部分死去,而大路兩邊的樹,怕行人摘吃,在樹榦上塗了生石灰與硫酸銅溶液,樹榦弄得花白,行人看了難受不敢摘吃,這些樹卻沒有死,進一步研究才知此混合液具有殺菌能力,因而名為波爾多液。配製波爾多液,硫酸銅和生石灰(最好是塊狀新鮮石灰)比例一般是1∶1或1∶2不等,水的用量亦由不同作物、不用病害以及季節氣溫等因素來決定。配製時最好用“兩液法”,即先將硫酸銅和生石灰分別跟所需半量水混合,然後同時傾入另一容器中,不斷攪拌,便得天藍色的膠狀液。波爾多液要現配現用,因放置過久,膠狀粒子會逐漸變大下沉而降低藥效。硫酸銅也常用來製備其他銅的化合物和電解精鍊銅時的電解液。無水硫酸銅可由氧化銅與硫酸或銅與濃硫酸作用后,濃縮結晶而製得。在實驗室中可用濃硫酸氧化金屬銅來製取無水硫酸銅。
在生物方面作雙縮脲試劑由0.1g/mL氫氧化鈉或氫氧化鉀、0.01g/mL硫酸銅和酒石酸鉀鈉配製。會遇到蛋白質顯紫色。斐林試劑質量分數為0.05 g/mL的硫酸銅水溶液·和斐林試劑A液反應生成斐林試劑
硫酸銅含量(以CuSO·5HO計)% ≥ 98.5
硫酸銅含量(以Cu 計)% ≥ 25
鉛(以Pb計)% ≤ 0.001
砷(以As計)% ≤ 0.0005
細度 30-80
相對分子質量約為250
| 溫度 ℃ | 10 | 20 | 30 | 40 | 50 | |
| 溶解度 g/100g 水 | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 |
| 溫度 ℃ | 60 | 70 | 80 | 90 | 100 | |
| 溶解度 g/100g 水 | 40.0 | 47.1 | 55 | 64.2 | 75.4 |
五水硫酸銅晶體結構:CuSO·5HO晶體結構中,Cu離子呈八面體配位,為四個HO和兩個O所圍繞。第五個HO與Cu 八面體中的兩個HO和[SO] 中的兩個O連接,呈四面體狀,在結構中起緩衝作用。
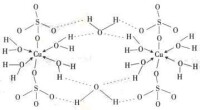
五水合硫酸銅結構
五水硫酸銅晶體失水分三步
上圖中兩個僅以配位鍵與銅離子結合的水分子最先失去,大致溫度為102攝氏度。
兩個與銅離子以配位鍵結合,並且與外部的一個水分子以氫鍵結合的水分子隨溫度升高而失去,大致溫度為113攝氏度。
最外層水分子最難失去,因為它的氫原子與周圍的硫酸根離子中的氧原子之間形成氫鍵,它的氧原子又和與銅離子配位的水分子的氫原子之間形成氫鍵,總體上構成一種穩定的環狀結構,因此破壞這個結構需要較高能量。失去最外層水分子所需溫度大致為258攝氏度。
差熱曲線分析:差熱曲線在185℃時出現顯著的吸熱谷。310℃時出現較小的吸熱谷,是由於脫水引起的。當加熱至805℃和875℃時出現兩個連續的吸熱谷是由於脫失硫酸根引起的。(註:實際操作時由於無水硫酸銅較易變質,加上雜質含量、儀器準確度等因素的干擾,實驗結果與理論值的差距比較大。)
