化學鍵理論
1949年Bjorksten等提出的理論
1949年,Bjorksten和Lyaeger共同提出化學鍵理論。關於分子(或晶體)內相鄰原子(或離子)間相互結合的理論。按照這種理論,原子(或離子)是以化學鍵的形式結合成分子(或晶體)的。形成化學鍵的物理機制是電磁相互作用。偶聯劑分子應至少含有兩種官能團,第一種官能團在理論上可於增強材料起化學反應,第二種官能團在理論上應能參與樹脂的固化反應,與樹脂分子鏈形成化學鍵結合,於是,偶聯劑分子像“橋”一樣,將增強材料與基體通過共價鍵牢固地連接在一起了。
原子間相互作用力
原子是由帶電粒子組成的,我們推測原子間相互作用力大多是靜電相互作用,主要取決於兩個方面:一是原子的帶電狀態(中性原子或離子);二是原子的電子結構,按原子最外價電子層全滿狀態(閉殼層)或未滿狀態(開殼層)來分類。
閉殼層包括中性原子,如稀有氣體He、Ne、Kr等及具有稀有氣體閉殼層結構的離子如Li、Na、Mg、Cl、F等。開殼層則包括大多數中性原子,如H、Na、Mg、F、C等。顯然,閉殼層原子(或離子)與開殼層原子之間的相互作用很不相同。
原子間相互作用大致可分為以下幾類:
(1)兩個閉殼層的中性原子(如He-He),它們之間是 van der Waals引力作用。
(2)兩個開殼層的中性原子,如H一H,它們之間共用電子對結合,稱為共價鍵。
(3)一個閉殼層的正離子與一個閉殼層的負離子,如Na-Cl,它們之間是靜電相互作用,稱為離子鍵。
(4)一個開殼層離子(一般是正離子)與多個閉殼層離子(或分子),如過渡金屬配合物M(X)m,它們之間形成配位鍵(屬共價鍵範圍)。
(5)許多金屬原子聚集在一起,最外層價電子脫離核的束縛,在整個金屬固體內運動——金屬鍵。
討論這些成鍵原理的理論稱為化學鍵理論。
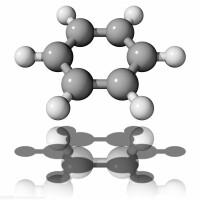
苯分子的多種共振結構
從20世紀初發展21世紀已形成三大流派:分子軌道( molecularorbital,MO)理論、價鍵( valence bond,VB)理論和密度泛函理論( density functional theory,DFT) 。
20世紀30年代初,由Hund、 Mulliken、倫納德-瓊斯( Lennard-Jones)開創了分子軌道理論,Slater、休克爾( Huckel)、波普爾( Pople)等發展至21世紀。該方法的分子軌道具有較普遍的數學形式,較易程序化。60年代以來,隨著計算機的發展,該方法得到了很大的發展。以後我們將主要介紹該方法。
分子軌道理論要點:
(1)分子軌道採用原子軌道線性組合,如CH4分子,C原子有1s、2s、2p等5個軌道,加上4個H原子1s軌道,共有9個原子軌道,可組合成9個分子軌道。分子軌道的表達式如下:
式中:為分子軌道;為原子軌道。
(2)分子中每個電子看成是在核與其他電子組成的平均勢場中運動,每個電子在整個分子中運動——稱為單電子近似。
(3)分子軌道按能級高低排列,電子從低至高兩兩自旋反平行填入分子軌道。
價鍵理論是20世紀30年代由海特勒倫敦( Heitler London)創立、Pauling .Slater等發展的化學鍵理論。價鍵理論很重視化學圖像。
這是描述電子空間軌道運動的鍵函數,還有描述電子自旋運動的鍵函數。從這些結構的鍵函數出發,通過各種近似計算,可得到體系的波函數與能量。鍵函數形式因不同分子而異,很難用一個統一的公式表示,因此給價鍵理論的程序化帶來很大的困難。 20世紀 30年代,化學家都傾向用價鍵理論來解釋分子結構,但到了50年代,價鍵理論發展緩慢;到了80年代,又有人對價鍵理論方法進行改進,張乾一教授的課題組也在價鍵方法程序化方面取得了突破性的進展。
密度泛函理論基於霍恩伯格-科恩(Hohenberg-Kohn)定理,將體系的能量表達為電子密度的泛函。其基本思想是將複雜的多電子體系先簡化成沒有相互作用的電子在有效勢場中運動,而將電子相互作用歸入交換關聯的泛函中。Kohn和沙姆(Sham)提出了實用的能量泛函表達形式,因而在計算精度和時間之間達到了較好的平衡,在物理,化學,生物等領域得到了廣泛應用。
分子中元素原子的電子從一個原子轉移到另一個原子而形成正負離子,由電荷相反的正負離子通過其過剩電荷的庫倫力彼此吸引形成分子,這種靜電庫倫力稱為離子鍵;原子間以共享電子對的方式形成分子,這種化學鍵稱為共價鍵;在通常情況下,共價鍵共享的電子對分別由兩個原子提供,有時共享的電子對則是由一個原子提供的,這樣的共價鍵稱為配位共價鍵;聯結金屬原子的鍵稱為金屬鍵,金屬鍵的最顯著特點是成鍵電子的流動性,它使金屬表現出高度的導電性和導熱性;由極性很強的化合物 H-X鍵上的氫原子與另一個鍵中電負性很大的原子 X上的孤立電子相互吸引而形成的分子之間的一種結合力叫氫鍵。氫鍵不是化學鍵,氫鍵屬於分子間作用力。氫鍵的作用力比范德華力強而比化學鍵弱。氫鍵在生理學和蛋白質結構化學上具有重要的意義。
人類對物質結合方式的認識源遠流長。在古希臘,恩培多克勒用愛和恨說明物質間的結合和分離,德謨克利特則用原子的漩渦運動說明原子的聚集和分散。中世紀的J.R.格勞伯(1604~1670)提出了物質同類相親、異類相斥的思想。其後還出現了關於物質結合的親和力說,認為物質的微粒具有親和力,由此互相吸引而結合在一起。19世紀初,瑞典化學家 J.J.貝采利烏斯(1779~1848)提出了一種建立在正負電相互吸引的觀念基礎上的電化二元說,從而使親和力說更加系統化。闡明分子中原子相互作用的經典價鍵理論是在原子概念基礎上形成的。1852年,英國化學家E.弗蘭克蘭(1825~1899)提出了原子價概念。1857年,德國化學家F.A.凱庫勒(1829~1896)提出碳四價和碳鏈的概念;1865年,他又揭示出苯的環狀結構。1874年,荷蘭化學家J.H.范霍夫(1852~1911)等提出了碳原子的四個價鍵向正四面體頂點取向的假說。這是有機化合物的結構理論。
20世紀20年代,在N.H.D.玻爾的原子結構理論的基礎上,對價鍵的實質有了新的認識,形成了原子價的電子理論。該理論包括離子鍵理論和共價鍵理論。離子鍵理論是1916年由美國化學家W.科塞爾(1888~1956)提出的。同年,G.N.劉易斯(1875~1946)提出共價鍵理論。但這個理論不能解釋共價鍵的方向性、氧分子的順磁性等,也無法解釋兩個原子為什麼共享一對電子時能相互結合。
1927年,W.H.海特勤和F.倫敦(1900~1954)提出氫分子成鍵理論。該理論認為兩個氫原子結合成一個氫分子由於電子密度的分佈集中在兩個原子核之間而形成化學鍵。現代價鍵理論是將這一成果推廣到其他分子體系而形成的。它認為共價鍵由一對自旋反平行的耦合電子組成,並根據原子軌道最大重疊原理,認為分子中的電子只處於與化學鍵相連接的兩個原子之間的區域內。L.鮑林進而提出共振論對此作了補充。該理論認為分子在若干價鍵結構間共振。1928年,美國化學家R.S.穆利肯和F.洪德等人提出分子軌道理論,將分子看作一個整體,認為形成化學鍵的電子在整個分子區域內一定的分子軌道上運動。現代化學鍵理論是在量子力學的基礎上形成的,它使電價理論不能解釋的問題獲得滿意的解釋。這種理論還在進一步發展中。