消除反應
有機化合物失去部分原子的現象
消除反應是指使反應物分子失去兩個基團(見基)或原子,從而提高其不飽和度的反應。
使反應物分子失去兩個基團(見基)或原子,從而提高其不飽和度的反應。
按失去的兩個基團在分子中的相對位置進行分類。
消除 或稱β-消除。為處於相鄰原子上的兩個基團失去后在這兩個原子之間生成π 鍵的反應。兩原子都是碳原子時就發生成烯消除反應:
消除等 為分別連在或更遠的相對位置上的兩個基團消除后得到環狀產物的反應。這些反應也可看為分子內取代反應。
在離子型1,2-消除反應中,帶著成鍵電子對一起從反應物分子的1位或α碳原子上斷裂下來的基團稱為離去基團(L),另一個失去的基團往往是連在2位或β碳原子上的氫,稱β氫原子。例如,1-溴丁烷與氫氧化鉀在乙醇中共熱,溴帶著鍵合電子對斷裂下來成為溴負離子,β氫原子以質子形式斷裂下來與鹼中和,同時在1和2位之間形成烯鍵:
消除反應
二級和三級鹵代烷分別有二和三個β碳原子,如其結構不相同,雖有可能得到幾個不同的消除產物,但主要得到雙鍵上取代基最多的取代乙烯。這是Α.М.扎伊采夫於1875年總結出的規律,稱為扎伊采夫規則。醇在酸性條件下加熱失水生成烯烴,也以得到扎伊采夫產物為主。
為四級銨鹼加熱分解生成烯烴的反應,主要得到雙鍵上取代基最少的取代乙烯。這是A.W.von霍夫曼於1881年提出的規律,稱為霍夫曼規則。
在離子型反應中,按有關價鍵發生變化的先後順序不同,可分三種反應機理。
反應物先與鹼作用,失去β氫原子,生成反應物的共軛鹼負碳離子,然後從這個負碳離子失去 L並生成π鍵。在生成π鍵的步驟中只有共軛鹼負碳離子參加。也分兩步進行,反應速率不僅與反應物濃度成正比,也與鹼的濃度有關,其關係較複雜,在多數情況下也成正比。一般說來,只有β碳原子上連有硝基、羰基或氰基等足以穩定負碳離子的強吸電子基團的反應物,才能按機理進行反應。
反應一步完成,L的斷裂、β氫原子與鹼中和、π 鍵的生成三者協同進行(見協同反應),反應物和鹼同時參加反應。的速率與反應物濃度和鹼濃度都成正比。上述三種機理以最普遍,但並非所有都完全協同。有些中,β氫的斷裂稍先於L的離去,情況在一定程度上與相似,稱為“接近的E2”;另一些E2的情況剛好相反,L的離去稍先於β氫的斷裂,在一定程度上與E1相似,稱為“接近的”。一般的、“接近的”和典型的等反應都以發生扎伊采夫消除為主,而和“接近的”卻以發生霍夫曼消除為主。
在和中,反應均分兩步進行,各自的活性中間體正碳離子和負碳離子都具平面結構,一般不存在立體選擇性問題。但在中,只有L、α和β碳及β氫四者處於共平面的空間位置,才有利於協同反應的進行,而符合這種要求的空間排列有兩種:L和β氫在α、β碳同一邊時,發生順式消除;L和β氫在α、β碳的兩邊時,發生反式消除。在大多數情況下,E2為反式消除,但不排除順式消除的可能性,甚至有些反應物由於結構的限制,只能發生順式消除。
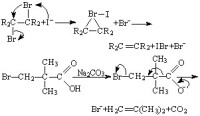
有些反應物在 β碳原子上連有比氫更容易被路易斯鹼(見酸鹼理論)作用的基團或者根本沒有β氫,它們就有可能發生不涉及失去 β氫的消除。連二鹵代烷在碘離子或鋅的作用下發生的脫鹵反應和 α,α-二烷基β-鹵代酸的脫羧反應都屬於這種情況:
消除反應
一般在氣相進行,是不需要酸或鹼催化的單分子反應。反應物通過環狀過渡態直接把 β氫轉移到L上,同時生成π鍵,因此是順式消除,並主要得到霍夫曼產物。羧酸酯加熱至約,便發生熱消除:
黃原酸酯可在約發生熱消除,稱為楚加耶夫反應:
羧酸酯和黃原酸酯都容易由醇製得,所以這些熱消除是醇類間接失水成烯的方法,可藉以防止醇在酸催化直接失水中常伴有的重排。三級胺氧化物加熱約至 左右也發生熱消除,稱為科普反應: