HSP70
HSP70
HSP70是用於協同免疫作用的一種蛋白質。
是熱休克70kDa蛋白 Heat shock 70 kDa protein
HSP70家族蛋白分子量相近,等電點PH5.2-6.3之間和相似的胰蛋白酶肽譜,在幾乎所有生物的應激細胞中常被高度誘導,具有保護機體和細胞的功能。
分子量70KD的熱休克蛋白(誘導型)在正常細胞中水平較低,在應激狀態下可明顯升高,是熱休克蛋白研究中最多的一種。尤其是對HSP70家族的結構、功能以及表達調控機理的研究較多,正常情況下HSP70位於胞漿內,受到熱休克刺激時,核內HSP70迅速增加,漿內只有少量存在,細胞處於恢復階段時,核內的HSP70消失,漿內仍有低水平HSP70表達。
HSP-70由兩個結構域組成:一個結構域(蛋白質編號1dkg)是ATP的結合位點,並且控制ATP的結合過程,(分子結構如圖A所示)
另一個結構域(蛋白質編號1dkz)是富含碳的肽鏈的結合位點(分子結構如圖B所示)
圖中以粉色表示的小肽段是蛋白質結合的縫隙
圖底部的水母狀結構的前摺疊因子(蛋白質編號1fxk)也執行類似的功能,即包裹摺疊過程中的蛋白質鏈。
高度的保守性,不同生物來源的HSP70氨基酸序列有50%-90%的相似性,而且HSP70氨基酸序列的N端2/3部分較C端1/3部分還要保守得多。
正常情況下HSP70位於細胞漿內,當細胞遭受應激作用時,HSP70迅速移入細胞核內並包圍核仁,細胞漿內只有少量存在;而應激消除后細胞處於恢復階段時,細胞核內HSP70又返回胞漿,在細胞漿6內呈低水平表達,再次應激又重新返回細胞核。
1962年Ritossa發現,將果蠅的培養溫度從25℃提高到30℃ (熱休克環境溫度升高),30分鐘后就可在多絲染色體上看到 蓬鬆現象(或稱膨突puff),提示這些區帶基因的轉錄加強並可能有某些蛋白質的合成增加。
1974年Tissieres研究證實該現象的產生是因為溫度高增強了這一區域的基因轉錄,相應生成了一系列分子量為70kDa和26kDa的蛋白質這些蛋白質被命名為熱休克蛋白質(HSP)。
1992年Horwitz提出HSP是一種分子伴侶的理論。HSP的作用和功能已經引起世界各國學者的廣泛關注,尤其是對HSP70的研究最為深入。
在正常生理條件下,如細胞的增生和分化、胚胎的生長和發育、激素的刺激等,熱休克蛋白即呈基礎表達。正常生長條件下,所有細胞中,熱休克蛋白佔總蛋白量的5%-10%。
在應激條件下,熱休克蛋白表達明顯增加,且可發生移 位。這些應激包括:
體內病理生理應激:基因損傷、組織創傷、微生物感染等。
Flynn等的研究表明,HSP70的氨基酸的一級結構可分為3個功能域:
近N端為45kDa大小結構上高度保守的氨基酸序列,具有ATPase活性區,比羧基端部分具有更高的保守性,與不同生物的HSP70所共有的生化特性有關;
緊接著為18kDa大小相對保守的氨基酸序列,是多肽的結合部位;
近C端有約10kDa結構上多變的氨基酸序列,其結構尚不明,可能與特定的一組蛋白底物相互作用有關。
HSP100家族
HSP90家族(分子量約83-90kDa)
HSP70家族(分子量約66-78kDa)
HSP60家族和小分子量smHSP家族(分子量約12-43kDa)
泛素
分子伴侶功能:
協同免疫作用
單克隆抗體問世以來,由於其獨有的特徵已迅速應用於醫學很多領域。
主要表現在以下幾個方面。
1.檢驗醫學診斷試劑
2.蛋白質的提純
單克隆抗體是親和層析中重要的配體。將單克隆抗體吸附在一個惰性的固相基質(如Speharose 2B、4B、6B等)上,並製備成層析柱。當樣品流經層析柱時,待分離的抗原可與固相的單克隆抗體發生特異性結合,其餘成分不能與之結合。將層析柱充分洗脫后,改變洗脫液的離子強度或pH,欲分離的抗原與抗體解離,收集洗脫液便可得到欲純化的抗原
3. 腫瘤的導向治療和放射免疫顯像技術
將針對某一腫瘤抗原的單克隆抗體與化療藥物或放療物質連接,利用單克隆抗體的導向作用,將藥物或放療物質攜帶至靶器官,直接殺傷靶細胞,稱為腫瘤導向治療。另外,將放射性標記物與單克隆抗體連接,注入患者體內可進行放射免疫顯像,協助腫瘤的診斷。
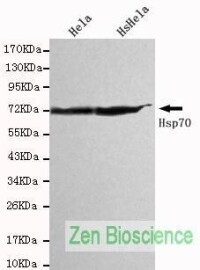
HSP70
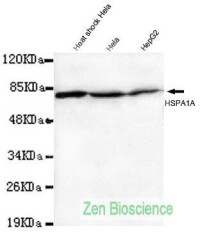
HSP70
HSP70
熱休克蛋白(heatshockproteins,HSPs)又稱應激蛋白(stressprotein,sp),是生物體細胞在熱誘導下合成的一組具有高度保守性的蛋白質。HSPs被發現與惡性腫瘤的發生、發展、複發及預后關係密切。
