粘附分子
粘附分子
粘附分子(adhesion molecules ,AM)是指由細胞產生、存在於細胞表面、介導細胞與細胞間或細胞與基質間相互接觸和結合的一類分子。粘附分子大多為糖蛋白,少數為糖脂,分佈於細胞表面或細胞外基質(extracellular matrix,ECM)中。
細胞粘附分子(cell adhesion molecules,CAM)是眾多介導細胞間或細胞與細胞外基質(extracellular matrix,ECM)間相互接觸和結合分子的統稱。
發揮作用的形式:以受體—配體結合的形式。
命名:粘附分子與CD分子是根據不同角度的命名。粘附分子是以粘附功能來歸類,CD分子是用單抗識別、歸類而命名,範圍十分廣泛,其中包括了粘附分子組,因此大部分粘附分子已有CD的編號,但也有部分粘附分子尚無CD編號。
粘附分子是介導細胞或細胞間相互接觸和結合分子的統稱,位於細胞表面或細胞基質中的糖蛋白,並以受體和配體結合的形式發揮作用。粘附分子使細胞與細胞間,細胞與基質間發生粘附,參與細胞的識別,活化和信號傳導,細胞增值與分化,細胞的伸展與運動,使免疫應答,炎症發生,凝血,腫瘤轉移,創傷癒合等一系列重要生理和病理過程的分子基礎。
粘附分子以配體一受體相對應的形式發揮作用,導致細胞與細胞間、細胞與基質間或細胞-基質-細胞之間的粘附,參與細胞的信號轉導與活化、細胞的伸展和移動、細胞的生長及分化、炎症、血栓形成、腫瘤轉移、創傷癒合等一系列重要生理和病理過程。
對於細胞間相互接觸、粘附的現象人們早有認識。由於單克隆抗體技術和分子生物學技術的發展和應用,極大地推動了對粘附分子的研究,使人們得以從分子水平上提出粘附分子的概念,並逐漸認識其作用機理。已基因克隆成功的粘附分子有幾十種,形成一個龐大的粘附分子大家族。由於粘附分子所具有廣泛、重要的生物學功能功能,在細胞生物學、分子生物學、免疫學、病理生理學、腫瘤學以及其它生命科學領域裡已受到人們普遍的關注,1993年第五屆人白細胞分化抗原國際專題討論會上,已將粘附分子單獨列為一組新抗原。
在體內,一種細胞可能同時表達多種粘附分子,一種粘附分子也可以表達於多種不同的組織細胞,而細胞間的相互粘附作用又可能由多對粘附分子受體/配體共同參與,單從某一對粘附分子的作用難於了解細胞粘附作用的全過程。
粘附分子根據其結構特點分
1、整合素家族
2、選擇素家族
選擇素分子的基本結構
選擇素分子為穿膜的糖蛋白、可分為胞膜外區、穿膜區和胞漿區。選擇素家族各成員胞膜外部分有較高的同源性,結構類似,均由三個功能區構成:①外側氨基端(約120個氨基酸殘基)均為鈣離子依賴的外源凝集素功能區(calcium dependent lectin domain),可以結合碳水化合物基團,是選擇素分子的配體結合部位;②緊鄰外源凝集素功能區的表皮生長因子樣功能區(epidermal growth factor like domain, EGF樣區),約含35個氨基殘,EGF樣功能區雖不直接參加與配體的結合,但對維持選擇素分子的適當構型是必需的;③靠近膜部分是數個由約60個氨基本酸殘基構成的補體結合蛋白(complement binding protein)重複序列。各種選擇素分子的穿膜區和胞漿沒有同源性。選擇素分子的胞漿區與細胞內骨架相聯。
選擇素家族的組成
目前已發現選擇素家族中有三個成員:L-選擇素、P-選擇素和E-選擇素,L、P和E分別代表白細胞、血小板和內皮細胞。這三種細胞是最初發現相應選擇素分子的細胞,故得名。
選擇素家族組成,分子量(kD),分佈,配體和功能
L-選擇素(CD62L)(LAM-1,LECAM-1) 9p75~80 白細胞 CD15s(S-Lewis)在外周淋巴結HEV上PNAd 白細胞與內皮細胞粘附,向炎症部位遊走,淋巴細胞歸巢到外周淋巴淋巴結
P-選擇素(62P)(GMP-140,PAGEM) 9p140 貯存於巨核細胞、血小板α顆粒和血管內皮細胞,Weibel Palade小體,凝血酶和組胺誘導后表達於細胞表面 CD15a(S-Lewisx)CD15 白細胞與內皮細胞和血小板粘附
E-選擇素(CD62E)(ELAM-1) 9p115 細胞因子活化血管內皮細胞 中性粒細胞CD15s(S-Lewis)、淋巴細胞上CLA 白細胞與內皮細胞粘附,向炎症部位遊走
註:LAM:白細胞粘附分子;ELAM:內皮細胞白細胞粘附分子;LECAM:白細胞內皮細胞粘附分子:PNAd:外周淋巴結定居素;GMP:顆粒蛋白:Slewis:唾液酸化的路易斯寡糖;PADGEM:血小板活化依賴的顆粒外膜蛋白 CLA:皮膚淋巴細胞相關抗原
選擇素分子識別的配體
與其它粘附分子不同,選擇素分子識別的配體都是一些寡糖基團,主要是具有唾液酸化的路易斯寡糖(Sialyl-Lewis)或類似結構的分子。與蛋白質分子抗原不同,直接決定細胞表面某種寡糖表達的因素,主要是與某些特的糖基轉移酶或碳水化合物修飾酶的作用有關。這些酶的作用可能與細胞的生長與代謝狀態有密切關聯。一種寡糖基團可以存在於多種糖蛋白或糖脂分子上,並分佈於多種細胞表面,因此選擇素分子的配體在體內的分佈較為廣泛。已發現然白細胞、血管內皮細胞、某些腫瘤細胞表面及血清中某些糖蛋白分子上都存在有選擇素分子識別的碳水化合物基因。
3、鈣離子依賴的粘附分子家族即鈣粘蛋白家族
最初發現一種介導細胞間相互聚集的粘附分子,在有Ca2+存在時可以抵抗蛋白酶的水解作用。以後又發現另外兩種作用和特性與其類似的粘附分子,它們的氨基酸組成也有同源性,因此將其命名為鈣離子依賴的粘附分子家族(Ca2+ dependent cell adhesion molecule family,Cadherin家族)。鈣離子依賴的粘附分子家族的粘附分子對於生長發育過程中細胞的選擇性聚集具有至關重要的作用。
(1)Cadherin分子結構
Cadherin分子均為單鏈糖蛋白,約含723-748個氨基酸殘基,不同的Cadherin分子在氨基酸水平上有43%-58%的同源性。Cadherin分子由胞漿區、穿膜區和胞膜外區三部分組成,其胞膜區有數個重複功能區,並含有由3-5個氨基酸殘基組成的重複序列。近膜部位含有4個保守的半胱氨酸殘基,分子外側N端的113個氨基酸殘基構成Cadherin分子的配體結合部位。此外胞膜外部分具有結合鈣離子的作用。Cadherin分子的胞膜內部分高度保守,並與細胞內骨架相連。
(2)Cadherin家族的組成和分佈
目前已知Cadherin家族共有3個成員,E-Cadeherin、N-Cadherin和P-Cadherin。不同的Cadherin分子在體內有其獨特的組織分佈,它們的表達隨細胞生長發育狀態的不同而改變。Cadherin分子以其獨特的方式相互作用,其配體是自身相同的Cadherin分子。
表6-6 Cadherin家族的組成、分佈及其配體
Cadherin家族成員 分子量(kD)分佈 配體 E-Cadherin 124 上皮組織 E-Cadherin N-Cadherin 127 神經組織、橫紋肌、心肌 N-Cadherin P-Cadherin 118 胎盤、間皮組織、上皮組織 P-Cadherin
4、免疫球蛋白家族
在參與細胞間相互識別、相互作用的粘附分子中,有許多分子具有與lgV區或C區相似的摺疊結構,其氨基酸組成也有一定的同源性,屬於免疫球蛋白超家族(immunoglobulin superfamily,IGSF)的成員。免疫球蛋白超家族粘附分子的種類、分佈及其配體見表6-4。免疫球蛋白超家族粘附分子的配體多為免疫球蛋白超家族中的粘附分子或粘合素超家族的粘附分子,在這種情況下,相互識別的一對IGSF分子或粘合素免疫球蛋白超家族粘分子實際上是互補配體的關係。
5、其他尚未歸類的粘附分子
除了上述四為類粘附分子外,還有一些粘附分子目前尚未歸類,包括一組作為selectin分子的配體的CD15、CD15s(s-Lewis),此外,還有CD44、MAd、MLA等粘附分子。
粘附分子參與機體許多重要的生理和病理過程,主要包括:①通過表達於白細胞粘附分子CD11a/CD18、CD11b/CD18、CD11c/CD18、VLA-4、L-selectin、CD15、CD15s、和P-selectin相互粘附,參與炎症的發生;②通過表達於淋巴細胞上的歸巢(Iymphocyte homing receptor,LHR)、L-selectin、CLA、LFA-1、VLA-4、CD44、LPAM-2分別與表達於血管內皮細胞上的定居素(addressin)PNAd、E-selectin、ICAM-1、ICAM-2、VCAM-1、MAd、CAM相互粘附使淋巴細胞向外周淋巴器官,皮膚炎症部位或粘膜相關淋巴組織的回歸;③通過CD/MHCⅡ類分子非多態部分、CD8/MHC1類分子非多態部分、LFA-1/ICAM-1、LFA-2/LFA-3、CD28/B7的相互作用參與免疫應答中APC呈提抗原、抗原識別、免疫細胞相互協作以及CTL殺傷靶細胞等多個環節;④通過Cadherin、N-CAM、CD31等分子的自身粘附,以及某些粘附分子與細胞外基質的粘附,參與細胞的發育、分化、附著及移動;⑤E-Cadherin、家庭些成員以及CD44分子等與腫瘤的浸潤、轉移有關;⑥通過血小板表達的粘附分子參與動脈、靜脈中血栓形成以及其它形式的凝血過程。
粘附分子的功能:
參與機體多種重要的生理功能和病理過程。
(一)免疫細胞識別中的輔助受體和協同活化信號:協同T細胞的粘附分子常見的有CD86 、 CD4/MHCⅡ類分子、CD8/MHCⅠ類分子、 CD28/ CD80 或CD2/ CD58 、 LFA-1/ICAM-1等。
(二)參與炎症過程中白細胞與血管內皮細胞粘附:如LFA-1/Mac-1等。
(三)淋巴細胞歸巢(lymphocyte homing)
定義:是淋巴細胞的定向遊動,包括淋巴幹細胞向中樞淋巴器官歸巢,成熟淋巴細胞向外周淋巴細胞歸巢,淋巴細胞再循環,以及淋巴細胞向炎症部位遷移。其分子基礎是稱之為淋巴細胞歸巢受體( lymphocyte homing receptot,LHR)的粘附分子與內皮細胞上相應的地址素(adressin)粘附分子的相互作用。
參與淋巴細胞歸巢常見的粘附分子及其功能見表4-2-2。
(四)參與組織細胞間的附著
(五)參與細胞的移動
(六)參與腫瘤的浸潤與轉移
(七)參與各種細胞內信號的傳導
細胞粘附分子不僅具有多種生理功能,在一定條件下也與病理過程的發生密切相關。在細胞因子、炎症介質以及其它因素的作用下,細胞表面粘附分子表達的水平和構型可以發生改變,導致細胞粘附能力的變化。體內某些粘附分子的表達是組成性(constitutive)的,即通常狀態下細胞表面就有一定水平的表達,如CD11/CD18、ICAM-1、ICAM-2和L-selectin等粘附分子在相應細胞的靜止狀態下有一定水平的表達,在某些因素的作用下,這些粘附分子的表達也可發生上調或下調(up-regulation or down-regulation)。另外一些粘附分子的表達可以是非組成性(non-constitutive)的,即通常狀態下這些粘附分子在細胞表面表達很少或不表達,但在某些因素的作用下可誘導表達,如E-selectin、VCAM-1在內皮細胞的表達即屬此類。對粘附分子表達的調節有構型調節和表達數量調節兩種方式,關於粘附分子表達調節的資料大多來自於對白細胞與內皮細胞粘附作用的研究。
除了通過增加或降低粘附分子表達水平來調節細胞粘附能力外,某些因素還可以通過改變粘附分子的構型影響其與配體結合的親和力,從而調節細胞的粘附能力,這使得對細胞粘附作用的調節更為精細和複雜。
(一)LFA-1分子構型改變對其粘附作用的影響
淋巴細胞在受到外來抗原,PMA,抗CD2、CD3、CD44、CD43或抗MACⅡ類分子單克隆抗體的刺激作用活化后,可發生相互凝集,這種凝集作用依賴於LFA-1/ICAM-1的相互作用,而這兩種粘附分子在活化淋巴細胞的表達水平並沒有顯著增加。靜止淋巴細胞即表達一定水平的LFA-1和ICAM-1,NK細胞和某些CTL細胞系更是表達較高水平的LFA-1/ICAM-1分子,但它們並不發生凝集作用。在淋巴細胞活化后,粘附分子可能通過構型變化的方式,提高LFA-1/ICAM相互作用的親和力,從而提高活化淋巴細胞的粘附能力。
1.NKI-L16和活化狀態的LFA-1分子NKI-L16是一種抗LFA-1的單克隆抗體,其識別的表位在靜止淋巴細胞暴露的水平很低。當NKI-L16McAb與淋巴細胞表面的LFA-1作用后,不僅不阻斷LFA-1介導的粘附作用,反而可以誘導靜止淋巴細胞的相互粘附而使細胞發生凝集。這種誘導粘附作用的機理部分是由NKI-L16McAb改變了LFA-1分子的構型,誘導了NKI-L16識別的表位在靜止淋巴細胞的表達。NKI-L16識別表位的表達是粘附作用發生的重要條件,但並不是唯一的,因為CTL細胞雖表達高水平的NKI-L16表位卻並不發生自發凝集。目前研究認為,LFA-1分子至少以三種形式存在:(1)靜止淋巴細胞表達的LFA-1分子,暴露很少的NKI-L16表位,與ICAM-1分子結合的親和力(affinity)低;(2)中間狀態的LFA-1分子,暴露出大量的NKI-L16表位,但與ICAM-1結合的親和力仍較低;(3)活化狀態的LFA-1分子,暴露出大量高親和力的NKI-L16表位。不同狀態的LFA-1分子在淋巴細胞表面的分佈方式是不同的,靜止淋巴細胞的LFA-1分子分佈分散,而活化的外周血淋巴細胞、CTL克隆、效應T淋巴細胞以及活化的CTL克隆細胞的LFA-1分子呈集中分佈,在局部形成高密度的LFA-1分子區域,這可能與NKI-L16表位的暴露有關。LFA-1分子在局部形成高密度狀態可以提高其與配體結合時的親合力(avidity)。
在integrin家族中,這種精細的構型調節作用並不僅限於LFA-1分子,已發現VLA-4分子同樣存在著靜止、部分活化和活化三種要構型,活化的VLA-4分子可與VCAM-1和纖粘連蛋白相結合,部分活化的VLA-4分子僅結合VCAM-1分子,而靜止狀態的VLA-4分子則失去結合任何配體的能力。
2.Ca2 、Mg2 與LFA-1分子活化狀態的關係Ca2 和Mg2 的存在對LFA-1分子與配體的結合是必需的,在粘附試驗系統中加入金屬離子螯合劑(EDTA或EGTA)去除反應系統中的Ca2 和Mg2 可以完全抑制LFA-1與其配體的結合。採用單克隆抗體對LFA-1分子表位的表達進行檢測,發現Ca2 與Mg2 與LFA-1分子某些表位的表達有關,而這些表位的表達是LFA-1分子活化構型的標誌。如上述NKI-L16識別表位的表達需要有Ca2 存在;另外一株單克隆抗體24(McAb24)識別的表位在LFA-1、Mac-1和gp150、90均有表達,但依賴Mg2 的存在。PMA或抗細胞表面分子的單克隆抗體作用引起的細胞凝集有一過性持續性兩種,一過性的作用在半小時之內消失,而持續性的作用可維持2小時以上。這種現象與離子依賴種類有一定的關係,PMA、NKI-L16、抗CD2和CD44單克隆抗體可以引起持續性的LFA-1分子的活化,它們的作用只依賴Mg2 的存在;而抗CD3、CD43和MHC-Ⅱ類分子的單克隆抗體所引起的凝集是一過性的,它們的作用則依賴Ca2 與Mg2 的同時存在。
3.LFA-1分子構型改變的機理對於淋巴細胞活化后導致LFA-1分子構型改變的機制還不十分明了。實驗表明,PMA作用於淋巴細胞后,通過激活蛋白激酶C(PKC)使LFA-1分子β鏈發生磷酸化,很可能與LFA-1分子構型的改變有關。抗CD2或CD3單克隆抗體可以通過影響磷酸肌磷酸肌醇代謝途徑導致PKC的激活,但兩種McAb影響淋巴細胞粘附分子活化的過程是不同的,抗CD2單克隆抗體誘導持久的LFA-1分子活化,而抗CD3單克隆抗體只能誘導短暫的、一過性的LFA-1分子的活化。這種對粘附分子表達的負反饋調節機制,對於體細胞粘附作用的調節過程可能有重要的意義。體內對粘附作用的負調節意味著細胞可以與相互作用的靶細胞脫離,再作用於其它靶細胞,從而最大限度地發揮作用。前面曾提到McAb24識別的表位表達在活化狀態的LFA-1分子,McAb24並不阻斷LFA-1分子和Mac-1分子與配體的結合,但卻可以明顯抑制單核細胞向T細胞的抗原提呈作用、LAK細胞對靶細胞的殺傷作用以及中性粒細胞的趨化移動,這些過程均依賴LFA-1和Mac-1分子與其配體的相互作用。單獨CD3單克隆抗體只引起一過性的LFA-1分子的活化,而同時加入McAb24則造成持續性LFA-1分子的活化,提示McAb24可能阻止LFA-1分子由活化狀態轉變為非活化狀態。
(二)其它粘附分子構型的改變對粘附作用的影響
除LFA-1分子外,在integrin家族中其它一些粘附分子構型的改變也可以影響細胞的粘附能力。PMA、抗CD2或CD3單抗可以誘導或增強淋巴細胞的VLA-4(CD49d/CD29)、VLA-5(CD49e/CD29)和VLA-6(CD49f/CD29)與其配體(層粘連蛋白或纖粘連蛋白)的粘附作用,提示上述粘附分子可能通過與LFA-1相類似的機制發生構型變化,導致與配體結合的親和力升高。Mac-1分子(CD11b/CD18)及血小板糖蛋白GPⅡbⅢa(CD41/CD61)分子在細胞活化后可以暴露新的表位,是其分子構型發生改變的直接證據。
獲得selectin家族粘附分子構型變化影響粘附能力的直接證據,但某些抗L-seletin或抗E-selectin分子EGF結構域的單抗非但不阻斷L-selectin分子或E-selecti分子與相應配體的結合,反而具有促進作用,提示selectin家族粘附分子中同樣存在著分子構型變化對粘附能力調節的可能性。
粘附分子表達數量的改變是粘附作用調節的另一個重要方面。粘附分子構型改變與表達數量的增減並不是截然分開的兩個過程,兩者可能同時存在,共同完成對粘附作用的調節。如淋巴細胞活化后不僅粘附分子構型改變導致親和力增加,同時也伴有粘附分子數量的增加。
1.調節細胞表面粘附分子表達數量的方式 細胞表面粘附分子表達數量的調節方式主要有誘導貯存在細胞內的粘附分子轉移到細胞表面和誘導粘附分子的重新合成兩種方式。轉移形式的過程發生迅速,只需數秒鐘,但維持時間短暫。如凝血酶和組胺作用於內皮細胞可以誘導內皮細胞內貯存在CD62分子迅速轉移到細胞表面,然後又很快被內吞而消失;又如CD11b/CD18、CD11c/CD18貯存在中性粒細胞的胞漿顆粒內,在PMA、TNF、IL-1刺激后迅速轉移到細胞表面。重新合成過程發生較為遲緩,一般需數小時,但維持時間較長。IL-1、TNF-α作用於血管內皮細胞則可以誘導E-selectin、VCAM-1分子的重新合成與表達,誘導后4小時達到高峰,並可維持24小時以上。
2.細胞因子、炎症介質對粘附分子表達的調節細胞因子IL-1、IL-3、IL-4、IL-8、PAF、GM-CSF、TNF-α、TNF-β和IFN-γ以及炎症介質白三烯、組胺和凝血酶等可作用於白細胞或/和血管內皮細胞,調節白細胞與血管內皮細胞的粘附作用。在體內可能有多種調節因素同時存在,相互影響,並可能有更多的未知的因素參與細胞間粘附的調節過程。
3.細胞的生長、發育狀態對粘附分子表達的影響 除了上述細胞因子、炎症介質可以調節細胞粘附分子的表達外,細胞本身的生長、發育、分化及代謝狀態也可以影響粘附分子的表達。在胚胎髮育過程中,組織細胞粘附分子的表達接一定的規律發生改變,使得不同細胞得以按一定的規律組合在一起,形成不同的組織或器官。腫瘤細胞與其起源的正常組織細胞相比其表達的粘附分子可有很大差異,這可能是某些腫瘤細胞易發生浸潤、轉移等現象的分子基礎。此外,處於不同分化和發育狀態的淋巴細胞表達粘附分子也有明顯改變,如與未經抗原刺激的T細胞(naive T cell)相比,記憶性T細胞(memory T cell)表達更多的CD2、LFA-1、CD44、VLA-4等粘附分子,而L-selectin在naive T細胞表達水平要明顯高於記憶T細胞。
不同粘附分子在粘附過程不同階段所起的作用
炎症過程的一個重要特徵就是白細胞粘附、穿越血管內皮細胞,向炎症部位滲出。這一過程一個重要的分子基礎是白細胞與血管內皮細胞粘附分子的相互作用,表2-7例舉了參與這一過程的粘附分子。不同白細胞的滲出過程或滲出過程的不同階段所涉及的粘附分子不盡相同。
不同粘附分子在粘附過程不同階段所起的作用 在體內由於血液處於不斷流動狀態,白細胞與血管內皮細胞的粘附作用是在血液流動產生的切力作用下進行的,因此白細胞與血管內皮細胞的相互粘附作用有其特殊性。體內白細胞與血管內皮細胞的粘附作用包括白細胞沿血管壁流動的最初粘附作用,以及隨後的加強粘附和穿越內皮細胞的過程。為了模擬體內血液流動狀態,在體外研究白細胞與血管內皮細胞的粘附作用時,採用了特殊的實驗裝置,使培養液中的中性粒細胞不斷流動通過培養狀態的單層內皮細胞。實驗表明,在流體產生的切力作用下,CD11/CD18與其配體ICAM-1對於中性粒細胞與血管內皮細胞的最初粘附幾乎不起作用。相比之下,L-seletin分子與其配體E-selectin的結合則發揮重要的作用,抗L-selectin分子的單克隆抗體可明顯阻斷這種最初的粘附作用。在隨後發生的中性粒細胞與血管內皮細胞加強粘附並穿越血管內皮細胞的過程中,L-selectin分子與其配體的結合則幾乎不起任何作用,而CD11/CD18與其配體的相互作用上升到關鍵地位。已經粘附於血管內皮細胞的中性粒細胞L-selcetin分子表達水平顯著下降,在趨化因子(如膜結合IL-8)的誘導下,CD11/CD18表達水平則明顯升高。事實上,L-selectin分子表達下降可減少對已粘附中性粒細胞的牽拉作用,有利於CD11/CD18介導的中性粒細胞的穿越血管內皮細胞過程。
在白細胞與血管內皮細胞粘附過程中的作用
膜結合細胞因子在白細胞與血管內皮細胞粘附過程中所起的作用 調節上述白細胞粘附分子表達的細胞因子有血管內皮細胞膜表面結合的IL-8、GM-CSF、PAF等對中性粒細胞具有趨化作用的細胞因子,血管內皮細胞所合成的上述細胞因子主要以膜結合(membrane-bound)的形成表達於血管內皮細胞表面。中性粒細胞與血管內皮細胞的粘附過程是在血管內皮細胞膜結合細胞因子調節作用下多種粘附分子按順序協調作用的複雜過程。
在中性粒細胞粘附、穿越血管內皮細胞的過程中,IL-8、GM-CSF和PAF等細胞因子發揮著關鍵的調節作用,沒有上述細胞因子的作用,最初粘附到血管內皮細胞的中性粒細胞可能重新回到血流中去。膜結合細胞因子的存在作用其特殊意義,它可以使細胞因子的作用局限化,促進白細胞的粘附、滲出、遊離的細胞因子(IL-8等)作用於白細胞減少其L-selectin分子的表達,反而抑制白細胞的粘附、滲出。血管內皮細胞表面不同的膜結合細胞因子不同白細胞粘附作用的選擇性激活可能是選擇白細胞粘附、滲出過程的因素之一。
淋巴細胞的粘附、滲出過程可能採取相似的方式,只是所涉及的粘附分子及粘附激活機制有所不同。即最初是由seectin分子介導的淋巴細胞與血管內皮細胞的不穩定的粘附,隨後血管內皮細胞的膜結合細胞因子作用於淋巴細胞激活其integrin分子,導致加強粘附及穿越血管內皮細胞的過程。
粘附分子在白細胞滲出過程中的重要作用在先天性白細胞粘附缺陷症(leukocyte adhesion deficiency,LAD)發病機理中得到了證實。該病的臨床特徵是反覆發生難以治癒的感染。LAD可分為LAD-1和LAD-2兩型。LAD-1型患者白細胞CD11/CD18分子表達缺陷,因此不能與FN和C3bi結合,喪失非特異的調理作用;此外,雖然白細胞可以沿血管壁流動,由於不能與血管內皮細胞表面粘附分子ICAM-1結合,白細胞不能滲出到炎症部位。LAD-2型患者白細胞S-Lewisx(CD15s)表達缺陷,不能有效的與E-selectin分子結合,白細胞沿血管壁的流動能力顯著低於正常人,同樣也不能向炎症部位滲出。因此阻斷白細胞與血管內皮細胞的粘附和白細胞的滲出有可能成為預防和治療性疾病的一種新的手段。
細胞因子在白細胞選擇性滲出過程中的作用
細胞因子在白細胞選擇性滲出過程中的作用:不同炎症具有不同類型的炎細胞浸泣,如急性炎症以中性粒細胞滲出和浸潤為主,慢性炎症往往以淋巴細胞浸潤為主,Ⅰ型超敏反應的變態反應性炎症以嗜鹼性粒細胞的選擇性滲出為主,遲髮型超敏反應性炎症則以單核細胞、T細胞浸潤為特徵。雖然對白細胞選擇性滲出的機理還不完全明了,但已有的證據顯示粘附分子在不同類型白細胞表達的差異以及細胞因子對粘附分子表達的不同調節作用可能是重要的因素。如IL-4和IFN-γ作用於血管內皮細胞可以選擇性地誘導粘附性粒細胞表達,在中性粒細胞不表達,因此IL-4和IL-4和IFN-γ可以選擇性的促進除中性粒細胞以外的白細胞的粘附作用。IL-4和IFN-γ是由活化T淋巴細胞產生的細胞因子,炎症局部活化T淋巴細胞可能通過產生IL-4和IFN-γ等細胞因子作用於局部血管內皮細胞,促進白細胞的滲出,因此IL-4和IFN-γ可能在免疫介導的炎症性疾病中發揮重要作用。此外,IL-8、GM-CSF和PAF等膜結合細胞因子也可能是導致白細胞選擇性滲出的重要因素。
是淋巴細胞遷移的一種特殊形式
淋巴細胞
T細胞前體向胸腺的歸巢
對於骨髓產生的T細胞前體(Pro-Tcell)向胸腺歸位的機理尚缺乏深入的研究。已知T細胞祖細胞表達CD44與L-selectin分子,它們可能與T細胞祖細胞的歸巢有關。此外,胸腺血管內皮細胞表達一種被稱為EA1的分子,可能起到地址素的作用參與T細胞的歸巢過程。認為integrin中α6β1、α6β4對T細胞前體的粘附起重要作用。
淋巴細胞向外周淋巴器官的歸巢
淋巴細胞向外周淋巴器官的歸巢主要有淋巴細胞向外周淋巴結、派伊爾小結(Peyre's Patch)及脾臟的選擇性歸巢等幾種不同的途徑。
1.淋巴細胞向外周淋巴結的歸巢 L-selectin是決定淋巴細胞向外周淋巴結選擇性歸巢的歸巢受體,其相應配體為特異性表達於外周淋巴結血管地址素(perpheral lymphonodevascular addressin PNAd)。L-selectin分子與PNAd相結合介導了淋巴細胞與外周淋巴結血管內皮細胞最初的粘附,隨後參與粘附與穿越過程的粘附分子主要有LFA-1/ICAM-1、ICAM-2及CD44/MAd分子。
2.淋巴細胞向派伊爾小結的歸巢 integrinα4β7分子是淋巴細胞向派伊爾小結定向歸巢的特異歸巢受體,抗α4β7的抗體可特異性地阻斷淋巴細胞向派伊爾小結的歸巢過程,而對淋巴細胞向外周淋巴結的歸巢過程無明顯影響。integrinα4亞單位可與β1、β2、βρ等β亞單位結合,分別組成α4β1、α4β7和α4βρ,並表達在不同的淋巴細胞表面,可能與特定淋巴細胞群或亞群的定向歸巢有關。派伊爾小結的靜脈高內皮細胞專一的、高水平表達粘膜血管地址素(mucosal vascular addressin MAd)。MAd是一種分子量為60kDa的糖蛋白,其對應的淋巴細胞歸巢受體是integrin α4β7,兩者的相互作用構成了特定淋巴細胞群向派伊爾小結定向歸巢的基礎。CD44及LFA-1分子作為淋巴細胞歸巢受體與其配體MAd和ICAM-1、ICAM-2的相互作用也參與淋巴細胞向派伊爾小結的歸巢過程,但它們與α4β不同,除參與淋巴細胞向派伊爾小結歸巢外,還參加向其它外周淋巴器官的歸巢。
淋巴細胞向非淋巴組織的歸巢
正常的非淋巴組織沒有或只有少量淋巴細胞,但在炎癥狀態下,淋巴細胞可以大量浸潤。淋巴細胞向非淋巴組織的歸巢可以區分為以下兩種情況:(1)正常的皮膚及消化、生殖道粘膜組織中有特定表達γδ型T細胞受體(TCRγδ)的淋巴細胞群存在,它們可能直接來自中樞淋巴器官,這些淋巴細胞的歸巢過程所涉及的粘附分子還不清楚。此外,正常皮膚或粘膜等組織中經常存在有少量記憶淋巴細胞,可能是少量抗原持續刺激的結果。(2)淋巴細胞向炎癥狀態下的非淋巴組織的歸巢。在炎症組織中浸潤的淋巴細胞多為記憶性T細胞,這些T細胞表達較高水平的CD45RO,此外,LFA-1、ICAM-1,α4-integrin、LFA-3,CD44等粘附分子的表達也明顯高於天然(naive)T淋巴細胞。上述粘附分子相對高表達可能與記憶T細胞向炎症部位的選擇性滲出有關。
淋巴細胞向非淋巴組織的歸巢過程除了具有記憶T細胞的選擇性外,還有組織特異性,也就是就特定的淋巴細胞群選擇性的定向歸巢到皮膚、粘膜或滑膜等組織。
1.淋巴細胞向皮膚炎症部位的歸巢 皮膚炎症部位的血管內皮細胞表達高水平的E-selectin分子,而向皮膚炎症部位定位歸巢的記憶T細胞則表達皮膚淋巴細胞相關抗原(cutaneous lymphocyte associated antigen, CLA),E-selectin與CLA的相互作用是CLA陽性記憶T細胞向皮膚炎症部位定向歸巢的分子基礎。此外,VLA-4與VCAM-1,LFA-1與ICAM-1/ICAM-2的相互作用也與淋巴細胞向皮膚炎症部位的歸巢過程有關。
2.淋巴細胞向腸道粘膜炎症部位的歸巢 目前關於這一過種的研究資料還不多。粘膜組織中的淋巴細胞表達一種稱為MLA(mucosal lymphocyte antigen)的表面抗原,由integrin分子β7鏈與另一條不同於α4鏈的多肽鏈組成,可能與淋巴細胞向腸道粘膜的歸巢過程有關。
3.淋巴細胞向滑膜炎症部位的歸巢 目前已知LFA-1/ICAN-1、VLA-4/VCAM-1及CD44/MAd都參與淋巴細胞向滑膜組織的歸巢過程,但還不能解釋淋巴細胞向滑膜組織歸巢過程的選擇性。推測可能還有未被發現的決定淋巴細胞向滑膜組織定向歸巢的粘附分子。
淋巴細胞歸巢過程中激活粘附作用的分子
前已述及,淋巴細胞的歸巢與中性粒細胞滲出的過程是相似的。同樣,淋巴細胞歸巢過程中最初粘附后粘附作用的激活機制也與中性粒細胞的滲出過程類似。
1.具有趨化作用的多肽 巨噬細胞炎症蛋白-1(macrophage inflammatory protein-1,MIP-1)可以膜結合的形式存在於淋巴結或炎症組織血管內皮細胞表面,通過作用於CD8 T細胞使其與血管內皮細胞粘附作用增強,這種粘附作用的增強是由T細胞VLA-4與血管內皮細胞VCAM-1分子相互作用介導的。此外,趨化因子家族的RANTES對記憶T細胞具有選擇趨化作用。不同的趨化多肽對特定淋巴細胞群粘附作用的激活可能與淋巴細胞的選擇性歸巢有關。
2.粘附分子介導的粘附激活作用 抗CD2和抗CD3單克隆抗體作用於T淋巴細胞可使T細胞表面integrin分子構型改變而使其與配體結合的親和力增加。此外,淋巴細胞其它表面分子在與配體結合后可能通過相同或不同的機制影響粘附分子間相互結合的親和力。可能具有上述作用的粘附分子有CD15、CD31和VLA-4。(1)抗CD15單克隆抗體與結合於LFA-1分子的CD15結合后,通過LFA-1分子構型的改變使其與ICAM-1粘附作用增強。血管內皮細胞表達的E-selectin分子可能模擬抗CD15單克隆抗體的作用,與CD15結合后導致淋巴細胞LEA-1與其配體ICAM-1粘附作用的激活。(2)抗CD31的單克隆抗體作用於CD8 T細胞可激活VLA-4/VCAM-1介導的粘附作用,淋巴細胞CD31分子與其血管內皮細胞配體的作用可能導致相同結果。(3)VLA-4與其配體VCAM-1結合對其自身的粘附具有正反饋調節作用。由於表達CD31的細胞多為天然T細胞,VLA-4的表達局限於部分T細胞,因此CD31和VLA-4對粘附作用的激活可能與不同的淋巴細胞群的定向歸巢有關。
淋巴細胞的歸巢是一個多種粘附分子參與並受各種因素調節的複雜過程,對於這一過程還缺乏系統的、確切的認識。隨著免疫生物學和分子免疫學研究的進展,必將推動這一重要領域的深入研究,並為某些疾病的診斷、預防和治療提供一條嶄新的途徑。

細胞
粘附分子參與細胞間的附著
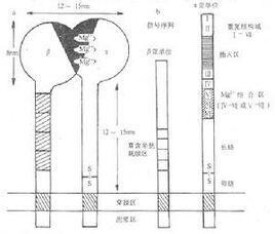
在胚胎髮育過程中,不同類型的細胞按著既定的規律形成細胞與細胞之間及細胞與細胞外基質的附著,有序地組合在一起構成不同的組織和器官。在這一過程中,粘附分子發揮著重要作用。
粘附分子參與細胞發育
粘附分子參與細胞與基質的附著
細胞與細胞間基質的附著是細胞生存與增殖所必需的,這種附著主要由integrinpe家族的粘附分子來介導。除β2組外,integrin分子識別的配體大都是細胞外基質的成分,包括FN(fibronectin,纖粘連蛋白)、LM(lamnin,層粘連蛋白)、VN(Vitronecin,玻璃粘連蛋白)、CA(collagen,膠原蛋白)等。integrin分子廣泛表達於各種組織細胞,而其配體廣泛存在於細胞外基質中。細胞與基質的附著主要有以下兩種情況:(1)間葉細胞,以成纖維細胞為代表,細胞的周圍均與細胞外基質附著;(2)上皮細胞,細胞的周圍部分與細胞外基質附著,而細胞側面則是細胞之間的附著,在這種情況下細胞粘附分子的分佈存在著極性,細胞癌變過程往往伴隨著這種極性的喪失。
粘附分子參與細胞的移動
在細胞發育、分化以及創傷修復過程中都需要細胞的移動,迄今為止對這一過程的確切機制還沒有明確的認識,但可以肯定的是細胞粘附分子是這一過程的重要參與者,而且這些粘附分子的表達得到精細的調控。已經發現E-Cadherin、N-Cadherin、NCAM,CD31及FN和FN受體都與細胞移動有關。(1)在胚胎髮育過程中,視神經軸突要沿著視束生長到達中腦頂蓋建立突觸聯繫,處於生長狀態的軸突在神經表皮細胞表面移動,兩者均表達N-Cadherin分子。如將胚胎的視網膜組織種植在單層不表達N-Cadherin的Neuro2a細胞上,神經軸突不能生長;如果將Neuro2a細胞轉染N-Cadherin分子,則可以看到神經軸突的生長;抗N-Cadherin分子的抗體可以抑制軸突的生長。(2)FN及其受體的相互作用同樣參與了胚胎髮育中細胞的移動過程,含有RGD序列的多肽可以干擾胚胎髮育中器官的發生。此外,FN及其受體還參與創傷修復過程中細胞的移動,FN可促進創面的癒合。(3)CD31則對細胞的移動具有抑制作用。
細胞粘附分子對細胞的移動具有促進與抑制兩種作用,粘附分子在細胞表面分佈的極性可能與其作用的差異有關。如CD31和E-Cadherin都分佈在細胞的側面與鄰近細胞接觸的部位,它們對細胞的移動具有抑制作用。
粘附分子與腫瘤的的關係主要包括對腫瘤浸潤和轉移的影響,對殺傷細胞殺傷腫瘤的影響,以及輔助腫瘤的診斷。
惡性腫瘤一個重要生物學特徵是其對鄰近正常組織的浸潤及遠處轉移。目前已知腫瘤的浸潤與轉移與其粘附分子表達的改變有關。一方面腫瘤細胞某些粘附分子表達的減少可以使細胞間的附著減弱,腫瘤細胞脫離與周圍細胞的附著,這是腫瘤浸潤及轉移的第一步;另一方面,腫瘤細胞表達的某些粘附分子使已入血的腫瘤細胞得以粘附血管內皮細胞,造成血行轉移。
1.E-Cadherin與腫瘤浸潤的關係 包括大腸癌、乳腺癌等在內的多種腫瘤細胞E-Cadherin分子表達明顯減少或缺失,E-Cadherin分子表達水平降低與腫瘤細胞惡性程度顯著相關。E-Cadherin分子在惡性程度低的乳腺癌細胞的表達水平明顯高於惡性程度高的腫瘤細胞,而且其表達水平與腺小管形成成正比。體外實驗更明確地證實了E-Cadherin分子與腫瘤浸潤能力的關係。在培養狀態下表達E-Cadherin分子的腫瘤細胞不侵入基附著的基質,但如加入抗E-Cadherin分子的抗體,則腫瘤細胞獲得浸潤能力;不表達E-Cadherin分子的腫瘤細胞在培養時表現浸潤能力,但如將E-Cadherin分子的cD-NA轉染腫瘤細胞使其表達E-Cadherin分子后,則腫瘤細胞喪失其浸潤能力。
腫瘤細胞除粘附分子表達水平改變外,粘附分子在其表面的分佈往往也有改變。E-Cadherin分子在正常的上皮組織中只分佈於細胞相鄰的側面。而在某些上皮組織起源的腫瘤細胞E-Cadherin分子可以表達在細胞頂部。儘管某些腫瘤細胞可以表達一定水平的E-Cadherin分子,但分佈的異常使其難以發揮細胞間附著的作用,這也可能與腫瘤的浸潤與轉移有關。
2.integrin家族與腫瘤浸潤和轉移的關係 integrin家族粘附分子在腫瘤細胞的表達水平也明顯改變,既可表達數量減少或缺失,也可以表達升高,分佈在極性亦可能不同於正常細胞。integrin分子在腫瘤細胞表達變化的不一致性可能與integrin分子的不同作用有關。同一種粘附分子可以在轉移和附著兩個不同的過程中發揮作用,因此integrin分子表達的增加或減少都可能與腫瘤細胞浸潤及轉移有關。
3.CD44和其它粘附分子對腫瘤轉移的影響 與E-Cadherin分子對腫瘤浸潤與轉移的抑制作用相反,腫瘤細胞表達的某些粘附分子作為血管內皮細胞表面粘附分子、細胞外基質的相應受體可使已進入血流的腫瘤細胞粘附血管內皮細胞或基質,促進腫瘤細胞的轉移。對腫瘤血行轉移的研究多採用小鼠尾靜脈注射黑素瘤細胞造成肺轉移的模型,已知黑素瘤細胞表達的CD44分子、層粘連蛋白受體等都可以促進黑素瘤細胞有肺部形成轉移灶,用相應粘附分子的抗體或可溶性配體則可減少黑素瘤的肺部形成轉移灶。此外體內慢性炎症部位往往是腫瘤轉移灶的好發部位,可能與炎症產物、細胞因子作用於局部血管內皮細胞促進其粘附分子表達而有利於腫瘤細胞的粘附有關。
不同的CD44分子在腫瘤浸潤與轉移過程中的作用可能是不同的,正常組織細胞或非轉移的癌細胞主要表達CD44S,而具有轉移能力的癌細胞主要表達CD44V。
殺傷細胞與腫瘤細胞的接觸由兩種細胞表面粘附分子的相互作用來介導,LFA-1/ICAM-1的相互作用具有重要地位。多種腫瘤細胞表達ICAM-1分子,腫瘤細胞ICAM-1分子的表達可能與腫瘤組織內淋巴細胞的浸潤有關。細胞因子如IFN-γ、IFN-α、IL-4、TNF-α可促進某些腫瘤細胞ICAM-1分子的表達,從而增加其對殺傷細胞作用的敏感性。毛細胞白血病細胞不表達LFA-1和ICAM-1分子,使其對CTL的殺傷作用更為敏感。腫瘤患者血清中可溶性ICAM-1水平往往高於正常人,可能抑制NK對腫瘤細胞的殺傷作用。
不同integrin分子在不同的組織、細胞有其特定的分佈方式,雖然在腫瘤組織integrin分子的表達不同於正常組織,但仍在一定程度上保留了這種特定的分佈方式,從而可以作為腫瘤分型診斷的參考依據。由於分化程度低的惡性腫瘤細胞在組織學上難以區分其組織來源,因此對其integrin分子表達的檢測可以作為腫瘤診斷的一個有效的輔助手段。
正常的肝細胞表達VLA-α1和VLA-β1,而膽管上皮細胞表達VLA-α2、VLA-α3、VLA-α6和VLA-β4。肝癌包括肝細胞癌和膽管癌兩種組織類型,分化良好的肝細胞癌和膽管癌表達integrin分子與其來源組織基本相似,但低分化的肝細胞癌可以表達VLA-α2、VLA-α3、VLA-α6。低分化的膽管癌細胞表達integrin分子的種類雖然與正常膽管相同,但表達數量明顯減少。由於肝細胞癌不表達VLA-β4,而膽管癌細胞不表達VLA-α1,因此上述兩種integrin分子可以作為區分兩型肝癌的標誌。
細胞粘附分子(圖1)
動脈中形成的血栓主要由血小板組成,稱為白血栓。動脈中血栓的形成過程包括最初血小板與血管壁損傷部位的接觸、粘附及隨後的活化、伸展和聚集。血小板與血管壁損傷部位的接觸由血小板表面糖蛋白複合物GPIb-IX與管壁上的vWF因子(vonWillebrandfacfor)的結合介導。GPIb-IX或vWF的遺傳缺陷都可以導致病人凝血機能的障礙,在臨床上分別被稱為Bernard-Soulier綜合征(Bernard-Souliersyndrome,BSs)和vonWillebrand病(vonWillebrand'sdisease,vWd)。
GPIb由一兩條多肽鏈通過二硫鍵連接所組成,兩條鏈分別稱為GPIba(135kDa,CD42b)和GPIbβ(22kDa,CD42c),GPIb與另一個糖蛋白分子GPIX(23kDa,CD42a)按1:1的比例通過非共價鍵結合構成GPIb-IX複合物。GPIbα、GPIbβ和GPIX的共同特點是都含有不同數目的由24個氨a基酸構成的富含亮氨酸糖蛋白的重複序列段(leucine-rechglycoprotein,LRG)。BSs病人的血小板除缺乏GPIbα、GPIbβ、GPIX三種分子外,同時還缺乏另一條稱為GPV的肽鏈。GPV同樣含有LRG序列,其功能還不清楚。GPIb-IX複合物與vWF結合的部位在GPIbα鏈上,位於其N端的第7個LRG重複序列及近膜部分的富含碳水化合物區域之間。vWF可由血管內皮細胞和血小板合成,單體分子量為220kDa。血管內皮細胞可向其附著面分泌vWF,結合於基底膜的膠原纖維。
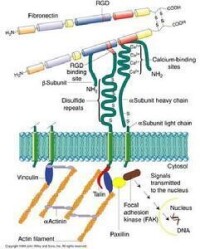
細胞粘附分子(圖2)
GPIb-IX與vWF的結合導致血小板的活化,使血小板糖蛋白GPⅡb-Ⅲa(αⅡbβ3)的構型發生改變,得以與血漿中vWF、FB、FN等配體結合,構成後續血小板的結合部位,觸發血小板的聚集過程。另一種血小板糖蛋白GPⅠaⅡa(α2β1)可能也參與此過程。
靜脈血栓形成過程中血小板起著較為次要的作用,血栓主要含有紅細胞和纖維蛋白,稱為紅血栓,此過程與GPIb-IX和vWF的相互作用無關。血小板與血管壁的粘附可能由GPIaⅡa(α2β1)、GPIcⅡa(α5β1)αvβ3、GPⅡbⅢa(αⅡbβ3)等粘附分子共同介導,上述粘附分子的作用是切力非依賴性的。
粘附分子與細胞內酪氨酸磷酸化
細胞間或細胞-基質間粘附分子相互作用並不僅限於細胞的粘附和附著,對參與粘附細胞的活化、分化、生長和分泌等也有顯著的影響,並有賴於粘附分子將胞外粘附分子相互作用的信號向細胞內的傳導。粘附分子所傳導的信號可能作為一種輔助因素,協同其它刺激因素的作用,如α3β1、α4β1、α5β1、α6β1和αLβ2與配體的作用可以協同TCR/CD3介導的淋巴細胞增殖和細胞因子產生,提示淋巴細胞與胞外基質的作用可能影響其活化狀態。此外單核細胞及中性粒細胞表面integrin分子與配體的作用也參與誘導細胞產生炎症因子的過程。
酪氨酸磷酸化是細胞內信號傳導的一個重要途徑,而integrin分子與某些細胞內的酪氨酸磷酸化發生有關。血小板活化過程伴隨著廣泛的細胞內蛋白酪氨酸磷酸化,integrin分子αⅡbβ3的表達是血小板內酪氨酸磷酸化過程發生的必要條件,αⅡbβ3不表達或其與配體的作用被阻斷均可阻礙血小板內的酪氨酸磷酸化過程。但αⅡbβ3單獨作用並不足以引起酪氨酸磷酸化,而只是作為其它刺激活化因素的必要輔助條件。對其它細胞進行的研究結果同樣提示integrin分子參與細胞內酪氨酸磷酸化的過程,如使KB細胞(一種癌細胞系)表達的α3β1分子發生交聯后可以發現細胞內一種分子量為115-130kDa的分子發生酪氨酸磷酸化;NIH3T3細胞粘附干纖粘蛋白分子或用抗integrin抗體刺激,可以導致細胞內一種蛋白髮生酪氨磷酸化。
某些細胞(如成纖維細胞、內皮細胞)粘附於纖粘連蛋白后胞漿的pH值升高。胞漿中pH值升高是integin分子與配體作用後向細胞內傳導信號的結果,與細胞的伸展和生長有關。
粘附分子與細胞膜磷脂醯肌醇代謝
吞噬細胞表達的integrin分子與纖粘連蛋白或層粘連蛋白等配體作用后可以導致細胞吞噬作用的增強,研究表明這一現象與integin分子結合配體后影響細胞膜磷脂醯肌醇代謝過程有關。
一種稱之為白細胞應答整合素的integrin分子(leukocyteresponseintegrin,LRI),與integrinβ3存在交叉反應,但不同於已知的任何一種integrin分子。LRI介導的吞噬增強作用可被蛋白激酶C抑製劑H7和Staruosporin所阻斷,也可被百日咳毒素、鈣離子螯合劑MAPTAM及結合磷脂醯肌醇的新黴素所抑制,因此推測LPI與配體的作用可能引起G-蛋白依賴的磷脂酶C的活化,導致細胞內PKC的活化和Ca2 濃度升高。此外還發現一種與LPI共沉澱的被稱作整合素相關蛋白(integrinassociatedproteinIAP)的5kDa分子,可能屬於一種多次跨膜細胞表面分子家族。抗IAP的抗體可以抑制LRI介導的吞噬增強作用,推測IAP可能與LRI結合配體的親和力有關或參與LPI的信號傳導過程。