SBA15
SBA15
SBA15是屬於介孔分子篩的一種,它的合成是近年來興起的又一項重要化工技術,其在催化、分離、生物及納米材料等領域有廣泛的應用前景,而其水熱穩定性高等優勢為催化、吸附分離以及高等無機材料等學科開拓了新的研究領域。可以預見的是,隨著對於SBA15的研究不斷深入,這項成果必然在化工領域有著新的突破。
介孔分子篩SBA-15典型的合成過程是:在35-40℃的條件下,將三嵌段表面活性劑P123(Aldrich,EO20PO70EO20,Ma=5800)溶於適量去離子水,向其中加入正硅酸乙酯(TEOS)、鹽酸(HCl),持續劇烈地攪拌24h以上,裝入聚四氟乙烯瓶內晶化24h以上,過濾、洗滌並乾燥,最後在550℃煅燒5h以上除去模板劑或者用溶劑迴流洗去模板劑,然後過濾、洗滌並乾燥,得到的白色粉末即為SBA-15。實驗所用各原料的摩爾比約為1TEOS:0.017P123:5.88HCl:136H2O。

SBA-15示意圖
介孔分子篩SBA-15的合成符合中性模板機理(S0I) :用中性表面活性劑P123(S0),和中性無機硅物種(I0)通過氫鍵鍵合,不存在強的靜電作用,並隨硅烷醇的進一步水解、縮合導致短程六邊形膠粒的堆積和骨架的形成。
SBA-15的合成條件溫和,表面活性劑易除去,且不易引起結構坍塌;中性表面活性劑與中性無機前驅體間的排斥力比離子表面活性劑與帶電荷的無機前驅體間的排斥力小得多,能夠形成較厚的孔壁,進而提高了分子篩骨架結構的熱及水熱穩定性。
影響介孔分子篩SBA-15結構的因素很多,主要有以下幾個方面:Templin M,franck A等研究表明,有機共聚物作模板劑可以通過改變其本身的化學結構、鏈長、官能團,達到調節產物尺寸、機械性能和熱性能的目的。
趙東元等用一種新的方法-共溶劑法來控制介孔材料顆粒外貌和形狀。如以N,N-二甲基甲醯胺(DMF) 為共溶劑可得到高度有序、大孔徑、“麵包圈”狀的介孔分子篩SBA-15。通過控制所加共溶劑的量、極性大小等也可以改變SBA-15的形貌,如以四氫呋喃為共溶劑可以合成“雞蛋腸”狀的SBA-15。
通過選擇硅源,添加助劑來控制SBA-15形貌。如選擇用正硅酸已脂為硅源得到的是“麥穗狀”SBA-15;選擇用正硅酸甲脂為硅源得到的是“腰果狀”SBA-15;加入電解質,如K2SO4,將得到圓片狀SBA-15。
Kohji Miyazawa和Shinji Inagaki通過改變合成的溫度和硅源與模板劑的比率來控制SBA-15孔容和孔率,他們指出溫度高於100℃時不能合成介孔分子篩SBA-15,增大硅源與模板劑的比是增加孔容的有效方法。Y Bennadja,P Beaunier等人也觀察到無機前驅體和有機前驅體之間關係非常緊密,對SBA-15合成有很大的影響。
Ye Wang,Masato Noguchi等合成的SBA-15孔徑在3.6-12nm之間可調,他們是加入了三甲基苯作為擴容劑及利用后合成熱處理的辦法增大孔徑。
介孔分子篩SBA-15在分離、催化及納米組裝等方面具有很大的應用價值,可是由於存在化學反應活性不高等內在的缺點,大大限制了它的實際應用範圍。為實現介孔分子篩SBA-15的潛在應用價值,依靠化學改性來提高它的水熱穩定性和化學反應活性成為現在面臨的主要研究課題。
化學改性包括對材料骨架的修飾以及對孔道表面的功能化。由介孔材料的表面化學性質研究可知,介孔氧化硅材料表面的硅醇鍵具有一定的化學反應活性,這是表面化學改性的基礎。通過對SBA-15表面有意識地進行各種不同的修飾,來滿足現實應用中的不同要求。
袁興東等利用含磺酸基的有機基團Si-(CH2)3-SO3H中的硅與SBA-15骨架上的氧通過Si-O鍵結合,直接形成穩定的有機/無機組成,在SBA-15一SO3H表面含有質子酸中心-SO3H具有較大的比表面積、孔容和孔徑,孔大小是單一的,孔分佈是高度有序的.催化油酸甲酯的酪化反應結果表明,直接法合成的催化劑既具有較高的穩定性,又具有簡便、快捷和高效的優點。
朱金華,沈偉等採用鈦酸丁酯和已醯丙酮作用后的產物作為鈦的前驅體,水熱一步法合成Ti-SBA-15,用鈦原子成功取代硅原子而不改變原SBA-15高度有序的二維六角結構。一步法合成Ti-SBA-15分散度較好,添加量高,對催化氧化環乙烯有較高的催化活性。
聶聰,孔令東等採用后鋁化的方法合成出Al-SBA-15,將鋁原子引入到SBA-15的骨架當中,在800℃水蒸氣中處理8h,比表面和孔容的減小要比Si-SBA-15小很多;在pH=2的酸溶液和PH=11的鹼溶液中處理后,比表面、孔容、孔徑、壁厚變化很小甚至幾乎沒有變化,進一步說明了Al-SBA-15有較高的熱及水熱穩定性和酸鹼溶液穩定性。
迄今為止,精細化工、藥物合成等方面主要使用微孔沸石或氧化物為載體的鹼催化劑,隨著原料油中重質油份的增多,石油煉製和石油化工迫切需要具有較大孔徑的催化劑,研製固體鹼新材料是發展環境友好鹼催化新工藝的關鍵。魏一倫,曹毅等分別採用浸漬、浸漬-微波、微波輻射等方法將醋酸鎂高分散在SBA-15上面成為MgO改性介孔固體鹼材料。結果顯示:使用不同負載方法以及含鋁SBA-15為載體,均能使MgO均勻分散。實驗表明負載的MgO在載體上形成了多層重疊結構,產生較多的中強鹼位,而在介孔分子篩中引入A1原子則有利於鹼位的形成。
我們利用酸性和酸量調節合成的Si-SBA-15在水熱穩定性方面有了較大的提 高,從沸水中考察100小時后的XRD圖來看,仍然具備SBA-15典型的特徵峰和規整的孔道結構。
介孔分子篩SBA-15比表面大,均一的孔道直徑分佈,孔徑可調變,壁厚且水熱穩定性很高,所以SBA-15在催化、分離、生物及納米材料等領域有廣泛的應用前景。
SBA-15大的孔徑有利於反應物在孔道內的運輸,有利於反應的進一步進行,隨著反應物引入量的提高,具有一維結構的各種材料的納米線相繼在孔道中合成。Yang等在SBA-15一維有序的管道內高溫分解AgNO3,製得直徑為5-6nm的Ag納米線。採用類似方法,Stucky利用SBA-15合成了Pt,Ag和Au的納米線。
固定和分離蛋白質的傳統方法是溶膠-凝膠法,它主要是利用溶膠-凝膠的分子篩性質,由於這種方法所得的材料的孔徑不均一,造成對蛋白質的分離效果不佳。而介孔材料在孔徑分佈上有其獨特的優越性,因此將在蛋白質分離上有其潛在的應用價值。 Stucky等首先利用經過氨基化的不同孔徑的介孔分子篩SBA-15(孔徑為5.9nm) 及MCF(孔徑為16nm),通過調節溶液的離子強度,達到對不同大小的蛋白質的分離。另外,在柱層析和高效液相色譜分析中很重要的一個因素是填柱材料。由於介孔分子篩材料孔徑可調,表面可官能團化為疏水或親水環境,且比較容易製備為較理想的球形材料,因此可以作為較理想的色譜填柱材料。趙東元等利用C18修飾過的介孔SBA-15材料作為色譜填柱材料,分別實現了對不同大小的生物分子(包括多肽和蛋白質)的色譜分離。另外,介孔分子篩SBA-15可以結合酶底物化學、抗體注FL原化學等,通過測定電流或電位,構成不同的生物感測器,以及在生物晶元、藥物的包埋和控釋等方面有重要的應用前景。
傳統的沸石類分子篩由於其孔徑太小難以滿足一些反應的需要,因此迫切需要具有較大孔徑的分子篩催化材料。這就要求採用介孔分子篩來作為新的催化劑材料或催化劑載體,利用其較大的孔徑增加擴散速度。因此,研究和開發介孔分子篩材料已成為當代分子篩和催化領域的研究熱點。通過元素取代等方法對介孔材料進行表面改性,不僅可以提高介孔材料的水熱穩定性,還可以通過改變表面修飾的組分來設計和改造介孔材料,合成新型的催化劑材料。張雪崢,樂英紅,高滋將-Fe2O3負載SBA-15作為催化劑,研究了負載量、預還原溫度和反應溫度對乙酸選擇加氫制乙醛反應的活性和選擇性的影響,結果表明負載催化劑上乙醛的產率要比純-Fe2O3催化劑高。
鄭欣梅,齊彥興,張小明,索繼栓將手性Salen Mn(III) 配體固載到SBA-15上來催化苯乙烯的不對稱環氧化反應,結果表明SBA-15為載體的催化劑可以得到與均相催化劑同樣甚至更好的催化效果。在反應過程中,沒有出現催化劑被氧化劑破壞的現象,它比以MCM-41為載體的催化劑有更好的不對稱誘導效果,說明SBA-15很適合用作手性催化劑的載體。
以上這些材料都克服了一般材料孔徑太小,離子交換能力小,酸含量及酸強度低,水熱穩定性不高等缺點,顯示出了優良的催化性能。
介孔碳是最近發現一類新型的非硅基介孔材料,由於它具有巨大的比表面積(可高達2500m2/g) 和孔體積(可高達2.25cm3/g),非常有望在催化劑載體、儲氫材料、電極材料等方面得到重要的應用,因此受到人們高度重視。合成介孔碳的通常的方法是硬模板法,利用MCM-48,SBA-15等介孔分子篩為模板,選擇適當的前驅物,在酸的催化下使前驅物碳化,沉積在介孔材料的孔道內,然後用NaOH或HF等溶掉介孔SiO2,就得到介孔碳。Ry-oo等以SBA-15為模板劑合成出CMK-3等。另外一種僅僅在介孔SBA-15的孔道內壁沉積上一定厚度的碳,除去介孔SiO2后,得到同樣是二維六方陣列的碳納米空心管。
介孔分子篩SBA-15的研究在過去短短的幾年中取得了很大的進步,同時也為催化、吸附分離以及高等無機材料等學科開拓了新的研究領域。在介孔硅基分子篩製備研究中發現的基於表面活性劑超分子組裝技術也將是該領域的主要研究方向之一,關於反應物和溶劑分子在分子篩SBA-15孔道內的擴散行為和存在狀態及其對催化反應的影響、分子篩在催化反應體系中的機械與化學穩定性,分子篩在
反應后的回收及再活化等方面的研究也會引起普遍重視。可以設想,有關新組成或新結構中介孔硅基分子篩SBA-15的合成及其骨架形成機理以及各骨架元素之間的化學配位關係的研究,仍將繼續深入。隨著以上各方面工作的進一步開展,介孔分子篩SBA-15理論研究和應用方面必將走上新台階。
利用吸附法將假絲酵母脂肪酶(candida rugosa lipase,CRL)固定在介孔分子篩SBA-15上,對比了由單波長紫外分光光度法、雙波長紫外分光光度法和二辛可寧酸法(bicinchoninic acid method, BCA)法測定的酶蛋白濃度及酶蛋白固定量。結果表明: SBA-15對紫外吸收有明顯干擾,單波長紫外法測定結果遠大於雙波長紫外法和BCA法,雙波長紫外法和BCA法測定結果較接近。利用BCA法測定了不同濃度CRL在介孔分子篩上的固定量,考察了固定化酶的泄漏量。在編號分別為Lu001和LLSD1的介孔分子篩SBA-15上的載酶量分別為16.6和114.12 mg/g。在緩衝溶液中SBA?15固定化酶的泄漏率只約為0.5%,可作為良好的酶固定化載體。
介孔分子篩SBA?15,脂肪酶,酶蛋白固定量,紫外分光光度法,二辛可寧酸法
介孔材料孔徑介於微孔與大孔之間,具有大的表面積和多維孔道結構,介孔硅基分子篩SBA-15具有高度有序的六邊形直孔結構,孔徑在5~50 nm範圍,對酶分子具有較強吸附能力,是固定化酶的新材料[1]。將酶固定於介孔分子篩上有利於保持酶活穩定性,便於酶的重複利用。高的酶固定量和低的酶泄露量是固定化效果的重要指標。介孔分子篩載體的酶固定量測定方法有紫外分光光度法[2,3]、BCA(bicinchoninic acid method)法[4]、Bradford法[5,6]、凱氏定氮法[7]及Lowry法[8]等。針對不同分析方法的酶固定量測定結果差異以及介孔分子篩干擾未見報道,無法判斷不同分析方法所測結果的可比性。為此,本研究分別採用常見的單波長紫外分光光度法、雙波長紫外分光光度法和BCA法考察了CRL在介孔分子篩SBA-15上的固定量和介孔分子篩對紫外吸收的影響,分析了不同SBA-15的固定量差異,考察了固定化酶的泄露量,為將介孔分子篩固定化脂肪酶用於催化反應的後續研究奠定了基礎。
2.1 材料與儀器
TG16高速離心機(19310 g,長沙英泰儀器有限公司);UV?2000紫外可見分光光度計(尤尼柯上海儀器廠); vertex 70型紅外光譜儀(德國Bruker公司);AM-3250B型磁力攪拌恆溫器(天津奧特賽恩斯儀器有限公司)。
介孔分子篩SBA-15的合成利用表面活性劑Pouronic P123(EO20PO70EO20, 美國Aldrich公司)為模板劑,以濃HCl( 35%~37%)為催化劑,通過對正硅酸乙酯(Si(OC2H5)4, TEOS, 95.0%,日本Junsei Chemical公司)的分解和硅縮聚反應后而得到。編號Lu001和LLSD1的介孔分子篩合成方法基本相同,原料量略有不同,二者的BET比表面積762 m2/g,孔容0.87 cm3/g,孔徑7.18 nm,壁厚3.55 nm。柱狀假絲酵母脂肪酶(candida rogusa lipase, CRL)購自日本Amano酶技術公司;BCA蛋白定量試劑盒購自美國Pierce公司。實驗用水為二次蒸餾水。
2.2 傅立葉變換紅外(FT?IR)測試
樣品和KBr在115 ℃下抽真空烘乾10 h。將300 mg KBr和2.2 mg樣品在研缽中混合研磨成細粉后壓片,乾燥后立刻置於紅外光譜儀的石英原位池中測試。儀器解析度為2 cm-1,掃描波數範圍4000~400 cm-1,掃描128次。
2.3 CRL在SBA?15上的固定化
將CRL磷酸鹽緩衝溶液(pH 7.0)以3000 r/min離心15 min,收集上清液,得原酶溶液。將適量SBA-15放入原酶溶液中,在15 ℃水浴和150~200 r/min下攪拌吸附21 h,再以10000 r/min下離心15 min,收集上清液為吸余液。用磷酸鹽緩衝溶液清洗分子篩4次以洗脫疏鬆附著的酶,洗脫液再以10000 r/min離心15 min,取出上清液為清洗液。測定原酶溶液、吸余液和清洗液的酶蛋白含量,根據物料衡計算得出酶蛋白固定量(immobilized amount of enzyme protein, mg),取單位質量分子篩的酶蛋白固定量為載酶量(enzyme loading, mg/g)。
2.4 固定化CRL的泄漏
將上述載酶SBA-15移入70 mL磷酸鹽緩衝溶液中,在15 ℃水浴、以150~200 r/min攪拌並定時取樣,樣品再以10000 r/min離心15 min,分析上清液中的酶蛋白泄漏量。
2.5 蛋白質定量方法
分別用單波長紫外分光光度法、雙波長紫外分光光度法和BCA法測定樣品蛋白質含量。單波長紫外法公式為:C(protein)(g/L) =F×A280×D/d,式中A280為280 nm波長處吸光度,D為溶液稀釋倍數,d為石英比色皿厚度(cm),F為校正因子。雙波長紫外法Warburg-Christian公式為:C(protein)(g/L)=1.55A280-0.76A260; Lowry-Kalckar公式為:C(protein)(g/L)=1.45A280-0.74A260,式中A260和A280分別為260 和280 nm紫外波長下的吸光度。BCA法參照美國Pierce公司蛋白定量方法測定。分析化學第37卷第8期尚雁等:介孔分子篩SBA-15的脂肪酶固定量分析測定。
3.1 蛋白質定量方法對比
圖1表明不同濃度CRL溶液在260~280 nm均有一個較強的吸收峰,該吸收峰為蛋白質芳香族氨基酸的特徵峰,用於蛋白質含量測定。將粗酶濃度為6 g/L的CRL溶液進行不同倍數稀釋,得到一系列相對濃度已知的酶溶液,分別用單波長和雙波長紫外法以及BCA法測定酶濃度,驗證所測濃度比例關係是否符合其相對濃度,由此得出各檢測方法的準確度。圖2結果說明BCA法測定結果與樣品稀釋后的相對濃度最接近,雙波長紫外法測定值與BCA法接近,單波長法測定結果遠高於BCA法和雙波長紫外法。由表1中的相對濃度計算結果可知,BCA法的相對誤差最小,單波長和雙波長紫外法的相對誤差較大。這是因為BCA法的原理是以工作試劑CuSO4中的Cu2+螯合蛋白質分子,發生顯色反應測試吸光度,因此抗干擾能力較強,準確度較高。紫外分光光度法操作步驟少,簡單快捷,不用顯色試劑,不消耗樣品。但是,直接檢測光密度值受溶液中雜質干擾影響較大,誤差較大。
為考察介孔分子篩對吸光度的影響,分別在3 mL蒸餾水中加入0.1, 0.6和0.9 mg SBA-15(編號Lu001),以蒸餾水為參比樣,測定其吸光度,並計算出可能對蛋白質測定產生的濃度值偏差。表2說明SBA-15有明顯紫外吸收。為此,本實驗的樣品溶液以10000 r/min離心,以消除介孔分子篩對吸光度的干擾。表1 不同方法測定蛋白質濃度的結果表2 SBA-15對吸光度的影響 表3為不同定量方法測定的 SBA-15(編號為Lu001)對CRL的固定量,3次平行實驗的初始粗酶濃度均為6 g/L,SBA?15載體用量均為0.36 g,雙波長紫外法測定結果略高於BCA法; 單波長紫外法測定結果遠高於雙波長法和BCA法。表3還說明BCA法的精密度高於單波長與雙波長紫外法,這是因為BCA法靠顯色反應測試吸光度,靈敏度較高,且介孔分子篩不參與顯色反應,抗干擾能力較強,重現性好,更適合介孔分子篩載體的酶固定量和酶泄露量的測試;紫外分光光度法受溶液中雜質和殘留介孔分表3 SBA-15上的CRL固定量及載酶量
◆: 固定量(amount of immobilized protein); ◇: 載酶量(enzyme loading).子篩干擾較大。由於雙波長紫外法測定的酶固定量結果與BCA法較接近,若實驗條件有限或者為了不消耗樣品且干擾因素較少,可使用雙波長紫外法來代替BCA法測定酶固定量,每個樣品中的介孔分子篩干擾可通過物料衡算而抵消。
3.2 不同初始酶濃度時BSA?15載體上的酶固定量
利用BCA法測定不同初始酶濃度條件下LLSD1對CRL的固定量,圖3表明當酶濃度較低時,SBA-15載體對CRL的固定量和載酶量隨酶濃度的增加而線性增加,但是當酶蛋白濃度達到約0.29 g/L(粗酶濃度約1 g/L)時固定量和載酶量達到平穩,最大載酶量為114.2 mg/g。
3.3 兩種SBA?15載體的酶固定量
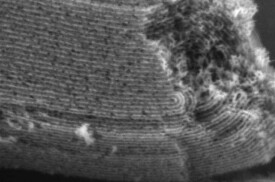
在初始酶濃度均為2 g/L、分子篩用量均為0.12 g相同條件下,LLSD1和Lu001對CRL的固定圖4 LLSD1(a)和Lu001(b)的SEM電鏡照片
Fig.4 SEM images of LLSD1(a) and Lu001(b)量分別為13.70和2.00 mg;載酶量分別為114.2和16.6 mg/g。可見,LLSD1的固定量及載酶量遠大於Lu001。圖4為LLSD1和Lu001的SEM電鏡照片,可見二者外觀形狀基本相同,均屬於SBA-15的傳統形狀[9],二者大小也無明顯區別。圖5是LLSD1和Lu001的FT-IR譜圖,從圖中可看出LLSD1表面上的羥基基團數量大於Lu001。由於酶的吸附是酶和介孔材料表面上的羥基通過氫鍵作用完成的,介孔分子篩表面上的羥基通過氫鍵作用可以促進對酶的吸附[10]。因此,圖5 Lu001(1)和LLSD1(2)的FT-IR譜圖
Fig.5 FT-IR spectra of Lu001(1) and LLSD1(2)兩種介孔分子篩對酶固定量差異很可能與介孔分子篩的羥基含量有關,具有較高羥基含量有利於固定更多的CRL。
3.4 SBA?15固定化酶的泄漏量
固定化酶容易“脫落”到水相中成為遊離酶,即“泄漏”[11]。圖6表明Lu001固定化CRL在緩衝溶液中100 h后的泄漏率為0.56%,LLSD1的泄漏率為0.53%,泄露量均較低,說明SBA-15是良好的酶固定化載體。泄露率較低可能與SBA-15孔徑大小有關。研究[3,12]表明, 當介孔材料的孔徑與酶分子大小相適應時,固定化酶的穩定性較好。Lu001和LLSD1的孔徑均為7.18 nm,假絲酵母脂肪酶的動力學直徑約為5 nm,二者大小較匹配,使酶分子恰好固定於孔內而不易發生泄露。
◆,■,▲,● 為泄露量(leakage); ◇,口,△,○為泄露率(leakage rate),其中◆, ◇ : 0.12 g LLSD1,載酶量(enzyme loading) 114.2 mg/g; ■,口: 0.24 g LLSD1,載酶量(enzyme loading) 111.3 mg/g;▲, △: 0.36 g Lu001,載酶量(enzyme loading) 14.2 mg/g;●,○: 0.36 g Lu001,載酶量(enzyme loading) 16.6 mg/g。
1 Lei C, Shin Y, Liu J, Ackerman E J. Journal of the American Chemical Society, 2002, 124: 11242~11243
2 Lei J, Fan J, Yu C Z, Zhang L Y, Jiang S Y, Tu B, Zhao D Y. Microporous and Mesoporous Materials, 2004, 73: 121~128
3 Essa H, Magner E, Cooney J, Hodnett B K. Journal of Molecular Catalysis B: Enzymatic, 2007, 49: 61~68
4 Rosales?Herńandez M C, Mendieta?Wejebe J E, Correa?Basurto J, Vázquez?Alcantara J I, Terres?Rojas E, Trujillo?Ferrara J. International Journal of Biological Macromolecules, 2007, 40: 444~4485 Gao Bo(高 波), Zhu Guang?Shan(朱廣山), Fu Xue?Qi(付學奇), Xin Ming?Hong(辛明紅), Chen Jing(陳 靜), Wang Chun?Lei(王春雷), Qiu Shi?Lun(裘式綸). Chem. J. Chinese Universities(高等學校化學學報), 2005, 26(10): 1852~1854
6 Humphrey H P Y, Wright P A, Botting N P. Microporous and Mesoporous Materials. 2001, 44?45: 763~768
7 He J, Xu Y, Ma H. Journal of Colloid and Interface Science, 2006, 298: 780~786
8 Xu Jian(徐 堅), Yang Li?Ming(楊立明), Wang Yu?Jun(王玉軍), Luo Guang?Sheng(駱廣生), Dai You?Yuan(戴猷元). Journal of Chemical Industry and Engineering(China)(化工學報), 2006, 10(57): 2407~2410
9 Zhao D Y, Feng J L, Huo Q S, Nicholas M, Fredrickson G H, Chmelka B F, Stueky G D. Science, 1998, 279: 548~552
10 Zheng L Y, Zhang S Q, Zhao L F, Zhu G S, Yang X Y, Gao G, Cao S G. Journal of Molecular Catalysis B:Enzymatic, 2006, 38: 119~125
11 Zhu Y F, Shen W H, Dong X P, Shi J L. Journal of Materials Research, 2005, 20: 2682~2690
12 Diaz J F, Balkus K J. Journal of Molecular Catalysis B: Enzymatic, 1996, 2: 115~126