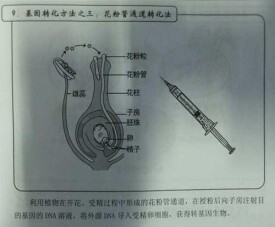
花粉管通道法
花粉管通道法
花粉管通道法:在授粉後向子房注射含目的基因的DNA溶液,利用植物在開花、受精過程中形成的花粉管通道,將外源DNA導入受精卵細胞,並進一步地被整合到受體細胞的基因組中,隨著受精卵的發育而成為帶轉基因的新個體。該方法於80年代初期由我國學者周光宇提出,我國目前推廣面積最大的轉基因抗蟲棉就是用花粉管通道法培育出來的。該法的最大優點是不依賴組織培養人工再生植株,技術簡單,不需要裝備精良的實驗室,常規育種工作者易於掌握。
花粉管通道法的主要原理是授粉后使外源 DNA 能沿著花粉管通道形成的途徑滲透,經過珠心進入胚囊,最終轉化尚不具備正常細胞壁的合子或早期胚胎細胞。這一技術原理可以應用於任何開花植物。水稻是自花授粉作物,因此這種方法同樣適用於水稻。圍繞著花粉管通道的形成是一個發生在植物花器結構中的傳粉授精的過程。從狹義上理解就象字面表明的那樣,授粉是指從花粉被送到柱頭上到在柱頭上萌發的過程,實際上應該是一個以狹義授粉為中心的包括這一過程的非常複雜的生理現象,即包括花粉形成、傳粉、花粉萌發、花粉管伸長以及繼花粉管伸長之後的受精問題,甚至還包括拒絕受精現象。
被子植物的花器結構已研究得比較清楚,最外面的是子房,子房中有胚珠,它由外胚珠、內胚珠及珠心、珠孔、珠柄組成。珠心內有 8 核,近珠孔端有 3 個核,一個分化為卵細胞, 2 個分化為助細胞。助細胞和卵細胞組合成卵器。這三個細胞排列成三角形,各細胞都呈梨形,尖部朝著珠孔端。近合點端的 3 個核分化為反足細胞。胚囊的中央有兩個極核,並和周圍細胞質組成一個中央細胞。因此典型的被子植物胚囊為 8 核 7 細胞胚囊,亦稱為雌配子體,卵細胞稱為雌配子。雄配子體由含有大量澱粉的營養核和具有微管的兩個精細胞、此外還有多糖類、線粒體組成。
植物開花以後,落在柱頭上的花粉粒,被柱頭分泌的粘液所粘住,以後花粉的內壁在萌發孔處向外突出並繼續伸長,形成花粉管,這一過程,稱作花粉粒的萌發。花粉落在柱頭上以後,首先向周圍吸收水分,吸水后的花粉粒呼吸作用迅速增強,多聚核糖體數量增多,蛋白質的合成也有顯著的提高。吸水的二細胞花粉粒,其營養細胞的液泡化增強,細胞內部物質增多,細胞的內壓增加,這就迫使花粉粒的內壁向著一個(或幾個)萌發孔突出,形成花粉管。禾本科作物中,當花粉粘著在柱頭上以後,就會引起柱頭的萎縮現象,從粘著部分開始逐漸擴大到相鄰細胞,最終使得整個柱頭的乳突細胞萎縮。這種萎縮是由於已授粉的柱頭的細胞的滲透性增大並脫水所致。花粉一粘到柱頭上就立刻從花粉中滲出某種液體;同時在花粉粒表面產生瘤狀膨起而改變形狀。其後,在 30-60 秒內花粉又恢復到原來的球形。隨之,花粉伸入乳突細胞開始萌發。
花粉管的細胞學結構花粉管實際上是一種有多個核的單細胞結構。以麝香百合花粉管的電子顯微鏡像結構為例。在不進行生長的部分,即尖端稍後的基部細胞質中含有豐富的線粒體、高爾基小體、小泡體、脂質體以及囊狀結構。與此形成對照,在進行生長的尖端只有囊狀結構,而沒有其他小體。細胞化學研究證明,花粉管尖端富含 DNA 、蛋白質、碳水化合物( Rosen , 1964 )。 Sassen 觀察了矮牽牛花粉粒和花粉管的細微結構。發現在被稱為生殖核的外周具有真正的細胞壁。它是由兩層構成的,內層含有纖維素微絲,外層含有某種耐酸的物質。生殖核周圍的細胞質中含有各種細胞器。這種細胞質與營養核周圍的細胞質被某種結構分離出來。營養核是分葉狀的,被具有孔穴的核膜包圍著。高爾基器產生囊狀結構,聚集在花粉管的尖端(加藤幸雄和佐志誠, 1987 )。
助細胞在花粉管伸長過程中的作用花粉管必須伸長才能進入胚囊,花粉管進入囊胚的方法有多種。
1、從卵細胞與一個助細胞之間進入。
2、從胚囊壁和一個助細胞之間進入。
3、直接進入一個助細胞等。
在某些種植物中,花粉管進入兩個助細胞中的一個,在這一助細胞中釋入出精核。用電子顯微鏡也確證了這種觀察( Schulz 等, 1968 )。助細胞對於精核的進入是極為重要的。棉花中,一個助細胞在花粉管到達胚囊之前就開始退化。細胞器膜和液泡發生變化,細胞發生退化。在花粉管的頂端與助細胞的細胞質接觸之前,花粉管不會開裂。
從其細胞質的結構來看,認為花粉管的內含物需要在壓力之下方能注入。受精前,各個助細胞的核及細胞質是正常的。但是一旦受精,其中一個助細胞的核及細胞質便發生變性,花粉管進入這一變性的助細胞之中。精核的釋放不是在花粉管的尖端,而是在稍稍靠後的部位,管壁破裂而釋放出精核。在這一瞬間,助細胞發生變化。助細胞的細胞壁消失,液泡縮小(Jensen , 1968 )。
然後,花粉管將其中的營養核、兩個精子和澱粉釋放到助細胞中,被釋放出的精子立即移動到已退化的助細胞的合點端。此後,精核進入卵細胞和中央細胞的細胞質,於是形成合子和胚乳核。已退化的營養核和助細胞核,在受精后仍殘留在助細胞內。
已知在花粉中有這樣的情況,即在不分裂的細胞中也發生 DNA 的合成與運轉。花粉管核不分裂,但是具有合成 DNA 的能力。其次是已知在花粉管這樣迅速生長的細胞中,伴隨著它的生長,形成大量酶類。為此必須進行大量的 遺傳物質複製( Stanley 和 Young , 1962 )。雜交授粉的場合,花粉管頂端是複雜而積極地攝入物質,這說明花粉管是異養的。在花藥裂開后,當花粉管到達胚囊的尖端時,助細胞的代謝活性變得最高。 Jensen ( 1965 )用電子顯微鏡研究了棉花的助細胞,他發現助細胞的作用是從珠心吸收物質,並且可以貯藏和轉運出去。根據這種作用,認為它供給卵、胚和胚乳以物質,另外,它可能與花粉管在胚囊中的生物合成也有關。
鈣離子在花粉管伸長中的作用萌發的花粉進入柱頭是靠向水性( hydrotropism )進行的。而此後的伸長,有人認為是靠向電性( electrotropism )。其根據是,在柱頭和子房之間可以觀察到電位差,並且觀察到電場可以決定花粉管伸長的方向。業已查明,越是靠近子房越與這種特性有關( Welk , 1965 )。與這種向電性有關的是熱不穩定的水溶性物質,特稱其為向化性物質。向化性物質廣泛地、組成性分佈於植物各組織中。在受精的時候花粉管朝向胚珠的向化性是重要的,鈣離子對此起重要作用。據認為,除了鈣離子是向化性因子外,鉀離子、多肽、胺和糖等可能都是與向化性有關的物質。一般來說可以認為從柱頭到胚珠存在一個鈣離子的濃度梯度( Jona , 1967 )。
Kwack ( 1967 )以文殊蘭( Crinum asiaticum )為材料用 45 Ca 研究了鈣離子是在細胞的哪一部位起作用從而影響到花粉管生長的。發現在花粉管壁的果膠質中,鈣離子的結合最為顯著。因而壁的強度增加,滲透性被調節,而大部分阻抑劑的作用都與滲透壓有關係。大多數情況由於滲透性減小而促進了花粉管的伸長。如有鈣離子存在,其促進效果可以提高一倍以上。而且,鈣離子可以使花粉免受各種化學物質及物理處理之害。另外,鈣的影響可因陽離子特別是鎂、鉀和鈉離子的存在而加強。根據 45 Ca 放射自顯影、果膠酶消化和甲硫氨酸處理等查明,鈣離子是與花粉管壁的果膠質物質結合著的。同時,他研究了鈣離子對 46 種園藝植物花粉生長的影響( 1965 ),發現鈣離子促進每種植物的花粉萌發和花粉管伸長。在沒有鈣離子的情況下,需要鎂離子。在蔗糖促進花粉管生長的場合,對鈣離子的要求最為顯著。可以推想,在花粉管生長時,鈣離子和各種水溶性無機及有機物質的相互作用發生在生長著的花粉管壁中。在花柱中,花粉管從中心部位的花柱腔吸取各種物質而伸長,它是依靠花柱組織的營養進行的,在花柱中,由於生長持續時間長,因此從消耗花粉粒內的物質的自養轉換更替為吸收花柱吸取營養物質。為了保持細胞壁的強度(完整性),在培養基中加入鈣離子是必要的。在沒有鈣離子的情況下,碳水化合物會從花粉中滲透出來。當有鈣離子存在時就基本沒有這種滲透。
其它影響花粉管伸長的因素花粉管尖端的伸長受使細胞壁變軟的酶的影響。 Vander Pluijin 和 Linskens ( 1966 )了解到花粉管(矮牽牛花柱內花粉管的細微結構)是在花柱的輸導組織中層的緻密的基層內生長的。由於酶的溶解作用,在正對著花粉的尖端形成一管狀通路,因而花粉管才能順利地在花柱內伸長。當在試管內花粉萌發的初期加入 b -1 、 3- 葡聚糖酶時,花粉管伸長增加。蛋白質分解酶抑制花粉管的生長和萌發。這些結果表明,纖維素酶和果膠酶對花粉管壁的伸長是重要的。
花粉管通道法國內外研究概況在國內,最早見諸報道的利用花粉管通道法直接導入外源 DNA 的技術是由周光宇等人建立並發展起來的,並且在棉花、小麥和水稻中都得到了變異子代(段曉嵐和陳善葆, 1985 ;黃駿麟等, 1981 ;曾君祉等, 1993 )。 1979 年,周光宇發表了“遠緣雜交的分子基礎—— DNA 片段雜交的一個論證”。他認為,從分子水平上看,雖然就整個染色體基因組而言,親緣關係較遠的生物間的染色體和染色體外 DNA 的結構愈不親合,則愈互相排斥,但從局部 DNA 片段來看,兩種植物的部分結構卻可能保持一定的親合性。因而,當遠緣 DNA 片段在母本 DNA 複製過程中有可能被重組,而使子代出現變異。這種參與雜交的 DNA 片段可能帶有可親合遠緣物種的結構基因、調控基因、甚至是斷裂的無意義的 DNA 片段。后兩種 DNA 片段如果整合到母本基因組中,將同樣可能影響母本基因表達而變異。根據這種看法,周光宇等曾提出常規遠緣雜交中存在著 DNA 片段雜交的假設。並認為從分子水平來看,能取得成功的遠緣雜交的大多數是 DNA 片段的雜交,即染色體水平以下的遺傳分子的雜交。用 3 H 標記的棉花大分子 DNA 進行了花粉管通道的驗證。棉花自花受粉 24 小時后,將外源 3 H-DNA 從頂部注入子房。從 3 H-DNA 自顯影,清楚地看到 DNA 經由珠孔進入開放的珠心到達胚囊。 30 分鐘后即觀察到胚囊中 3 H-DNA 顯影, 2-4 小時之間, 80% 以上的胚囊中均有外源 DNA 進入。在花粉管中沒有找到 3 H-DNA ,說明 DNA 不是進入花粉管后再進入胚囊,而是經過花粉管所經過的通道進入胚囊的(龔蓁蓁等, 1988 )。
經過許多學者嘗試后的結果,花粉管通道法實施的最佳時機集中在植物傳粉受精后的一段時間,這是有其根據的。一方面,早期胚細胞不具有正常細胞壁,因此易於 DNA 轉化;另一方面,受精后的細胞 DNA 複製活躍,易於 DNA 整合。早期的花粉管通道法所用的外源 DNA 是種間或屬間帶有目的基因的供體總 DNA 片段,以後有學者將以質粒為載體帶有目的基因片段的重組 DNA 分子配以一定的濃度和純度來轉化受體的種質細胞,並得到目的性狀得到表達的變異的後代(謝道昕等, 1991 ) 。在國外,直接運用同樣方法最早見諸報導的是 Hess ,經過多年的努力,他利用花粉萌發時吸收種內或種間 DNA 技術,將外源 DNA 導入矮牽牛中,獲得來自外源 DNA 的花色變異子代。運用 Hess 的技術。 Dewet 等 1983 年培育出玉米抗大小葉斑病品種。 Ohta ( 1985 )在美國科學院院報上報道合用玉米種間外源總 DNA 片段和玉米花粉混合受粉,在當代得到高頻率的胚乳基因的轉移。
直接建立在這種方法之上並可視為對其進一步發展的方法是 in planta 轉化方法( Feldmann 和 Marks , 1987 )。到今天,運用 in planta 轉化方法在擬南芥( Arabidopsis thaliana )中利用 T-DNA 插入產生大規模突變群體已經得到十分成功的應用( Krysan 等, 1999 ; Speulman 等, 1999 )。相對於前者, in planta 轉化方法最大的創新之處是藉助農杯菌 Ti 質粒這一天然轉化系統而非裸露 DNA 來轉化植物的種質系統。 Feldmann ( 1987 )首次報道成功運用這種方法將外源 DNA 片段轉移到受體基因組中並可穩在 T2 和 T3 代穩定遺傳。具體做法是將外源基因片段與卸甲載體整合在一起 , 擬南芥種子萌發期間,將農桿菌菌液與擬南芥種子浸泡在一起。 Chang ( 1990 )發展了另一種 in planta 轉化方法,擬南芥花期,將擬南芥花序從根部剪去,然後用農桿菌菌液感染創傷部位。 Bethtold 等( 1993 )嘗試了另一種轉化方法,同樣是在擬南芥開花期將整個植株浸泡在一定濃度的農桿菌菌液中,採用真空滲透( Vacuum infiltrafion )的方法達到轉化目的。以後, Clough ( 1998 )對這種方法作了修改,在農桿菌菌液中加入表面活性劑和蔗糖等有利於農桿菌轉化的保濕性物質,即使不用真空滲透的方法,而直接將植物的地上部分浸到農桿菌菌液中也可達到同等轉化頻率。到今天,對擬南芥植物運用這種直接的轉化方法,在選擇最合適的轉化時機、最佳的轉化部位、最優化的轉化條件等方面已經到達相當成熟的地步。