萃取劑
應用於冶金行業的化學試劑
能與被萃取物形成溶於有機相的萃合物的化學試劑。在濕法冶金中,萃取劑的作用是與被萃取的金屬通過配合化學反應生成萃合物萃入到有機相,又能通過某種化學反應使被萃取的金屬從有機相反萃取到水相,由此而達到金屬提純與富集的目的。萃取劑是影響萃取工藝成敗的最關鍵因素。
選用的萃取劑的原則:
① 和原溶液中的溶劑互不相溶;
② 對溶質的溶解度要遠大於原溶劑;
③ 易於揮發;
分液漏斗萃取
以上的萃取劑主要為物理萃取劑,在現在工業中,特別是冶金工業中,大量使用的是化學萃取劑,它廣泛應用於除雜凈化、分離、產品製備等過程中。
工業中的萃取劑,大多溶解於有機溶劑,常見的有機溶劑是磺化煤油。因為它易得廉價,並且對萃取劑有協萃作用,因為裡面含有少量的芳香烴。溶於有機溶劑還能提高萃取劑的萃取能力、增強其金屬萃合物的溶解性、降低粘度,降低其揮發性能、降低其在水中溶解性。
萃取劑主要在有色金屬濕法冶金行業應用廣泛,比如銅、鋅、鈷鎳、鎘、金銀、鉑系金屬、稀土等行業。
萃取與其他分離溶液組分的方法相比,優點在於常溫操作,節省能源,不涉及固體、氣體,操作方便。萃取在如下幾種情況下應用,通常是有利的:
②低濃度高沸組分的分離,用精餾能耗很大,如稀醋酸的脫水;
③多種離子的分離,如礦物浸取液的分離和凈制,若加入化學品作分部沉澱,不但分離質量差,又有 過濾操作,損耗也大;
④不穩定物質(如熱敏性物質)的分離,如從發酵液製取青霉素。萃取的應用,目前仍在發展中。元素周期表中絕大多數的元素,都可用萃取法提取和分離。萃取劑的選擇和研製,工藝和操作條件的確定,以及流程和設備的設計計算,都是開發萃取操作的課題。
萃取劑的種類繁多,沒有統一的分類方法。鑒於它是一類有機化合物,因此,通常根據質子理論按有機化合物酸鹼性的劃分,分為中性萃取劑,酸性萃取劑和鹼性萃取劑;此外,有一類萃取劑多數為質子酸,通常具有螯合劑的性質故歸屬為螯合萃取劑。
螯合萃取劑是一類在萃取劑分子中同時含有兩個或兩個以上配位原子(或官能團),可與中央離子形成螯環的有機化合物。如羥肟類化合物的分子中同時含有羥基(-OH)和肟基(=NOH)。再如8-羥基喹啉及其衍生物(Kelex100等)的分子中,同時含有酸性的酚羥基和鹼性的氮原子。
萃取劑的性能是由其結構決定的,作為萃取劑的有機試劑必須具備兩個條件:(1)萃取劑分子中至少有一個功能基,通過它與金屬離子結合生成萃合物,常見的萃取功能基是O、N、P、S等原子。這些原子都有孤對電子,是電子給予體,也叫做配位原子。在萃取劑中以氧原子為功能基的最多;(2)萃取劑分子中必須有相當長的碳鏈或苯環,長的碳鏈或苯環使萃取劑及萃合物具有易溶於有機相而難溶於水相的性質。但碳鏈過長,會使萃取劑的粘度增大或成為固體,而不宜用作萃取劑。萃取劑的相對分子質量 一般在350~500的範圍內。
中性萃取劑可細分為中性含氧萃取劑、中性含磷萃取劑、中性含硫萃取劑及醯胺類萃取劑。
中性含氧萃取劑
中性含氧萃取劑主要是指醇(ROH)、醚 (ROR′)、酮 (RCOR′) 和酯 (RCOOR′)類化合物。萃取劑配位體氧原子的電子密度和分子的偶極矩是決定這類萃取劑萃取能力的主要因素。因此,它們的萃取能力隨著其路易斯鹼性的增強而增大。在醇、醚、酮、酯四類化合物中,只有醇分子中含有-OH。由於-OH的存在,使得醇分子間生成氫鍵而發生自身的締合作用,具有比其他三類中性萃取劑都高的沸點。中性含氧萃取劑都含有氧原子,故它們可以與水分子發生氫鍵締合作用,在水中有 一定的溶解度。醇、醚、酮和酯在濃的強酸中能生成鹽,這類鹽陽離子不僅可與無機酸根結合,也可以與金屬配陰離子結合,使其能萃取許多物質。這類萃取劑能萃取金屬的更主要原因是它們可與金屬生成配合物進入有機相而被萃取。
中性含磷萃取劑
中性含磷萃取劑是指正磷酸分子中 三個羥基完全被酯化或被取代后的化合物。凡是烴基直接與磷原子相連者,即凡具有碳磷鍵 (C-P)的稱為膦某,而凡不含碳磷鍵者,則稱為磷某。在這類萃取劑上含有磷醯基(≡P=O),它是起萃取作用的官能團。
中性含磷萃取劑與水分子締合而生成締合物,又因磷醯基氧原子也能提供孤對電子與質子結合生成鹽。中性含磷萃取劑形成的離子能與金屬配陰離子結合成為鹽而萃取進入有機相。這類萃取劑還可通過磷醯基的氧原子與金屬配位,形成中性配合物而被萃取入有機相。因為磷酸酯的穩定性比膦酸脂差,當這類萃取劑長時間與無機酸接觸時會發生水解反應。各類無機酸對中性含磷萃取劑水解反應影響的大小順序是HI>HBr>HCl>HNO3>H2SO4;此外,隨著溫度及溶液中酸的濃度增高,這類萃取劑的水解速度變大。在中性含磷萃取劑中,隨著分子中烷氧基的減少,烷基的增加,萃取能力增加的次序為: (RO)3PO
中性含硫萃取劑
中性含硫萃取劑對一些貴金屬有很強的萃取能力,而對它們的選擇萃取性能也較好。根據皮爾遜(Pearson)的硬軟酸鹼原理,萃取劑中作為電子給予體的硫是軟鹼,而汞、鉑、鈀、金、銀、鉈、碲等作為電子接受體則是軟酸,按硬軟酸鹼原則中硬親硬,軟親軟的規律,含硫類萃取劑可與貴金屬形成穩定的配合物而被萃取入有機相。因此,中性含硫萃取劑為貴金屬分離的特效萃取劑。
醯胺類萃取劑
這類萃取劑最重要的是取代醯胺。醯胺分子中氨基—NH2上氫原子被烴基取代后的化合物稱為取代醯胺。取代醯胺中的氨基不呈鹼性,這是由於分子中氮原子孤電子對與羰基=C=O中的π電子形成一個p-π共軛體系;加之氧的負電性較大,從而使氮原子的電荷密度降低,而羰基氧原子的電荷密度升高,因此,這類有機化合物都是中性的化合物。
取代醯胺分子中的羰基氧原子對氫離子或金屬離子具有較強的配位能力,因此,其配位能力比酮強,比中性含磷萃取劑弱。氧原子上電荷密度增加的順序是RCOR
酸性萃取劑在水中可電離出氫離子而得名。因在萃取中氫原子和水中的金屬陽離子進行交換,故也稱為液體陽離子交換劑。根據電離常數Ka的大小,可將酸性萃取劑分為強酸性萃取劑(離解常數Ka>1),中強酸性萃取劑(Ka≈10)。和弱酸性萃取劑(Ka≈10)。羧酸和酸性含磷萃取劑是最重要的酸性萃取劑。
羧酸
羧酸是一類重要的酸性萃取劑,由於分子間產生締合作用,通常以二聚體形式存在。因K2是二聚反應產生的常數,故稱為二聚常數。羧酸通常都是弱酸,其酸性小於一般無機酸而大於碳酸,它可與鹼反應生成羧酸鹽(金屬皂)。隨著水溶液的pH值升高,羧酸在水中的溶解度增大,萃取時羧酸與金屬離子進行陽離子交換反應。
酸性含磷萃取劑
酸性含磷萃取劑也是主要的酸性萃取劑,可把這類萃取劑看成是磷酸分子中一個或兩個羥基被酯化或被烴基取代后的產物。這類萃取劑與羧酸一樣,分子間也能發生締合作用,呈二聚體存在。它的酸性較強,屬強酸性萃取劑,萃取金屬時也發生陽離子交換反應。烷基磷(膦)酸的萃取過程比較複雜,隨萃取條件不同存在四種形式:(1)當水相金屬離子濃度低、有機相負載很小時,二聚體烷基磷酸分子中僅一個氫離子參加反應;(2)若水相金屬離子濃度較高,則烷基磷酸以單體形式與金屬離子發生交換;(3)當水相中某種陰離子對金屬離子具有很強的配合能力時,萃取劑陰離子可與這種陰離子一道和金屬陽離子形成混合型的配合物而被萃取;(4)由於烷基磷酸的酸式電離與溶液酸度有關,因此,在高酸度的條件下,烷基磷酸電離受到抑制,這時烷基磷酸主要以磷醯基起作用,與中性含磷萃取劑相似。
含有=P (O) OH基的磷(膦)酸萃取劑與羧酸相同,隨著它的酸性增強,萃取能力增大,萃取能力的順序是:(RO)2POOH>(R) (RO) POOH>R2POOH。隨著這類萃取劑分子中碳-磷鍵的增加,烷氧基減少,吸電子效應隨之削弱,導致pKa增大,酸性降低,萃取能力隨之下降。
鹼性萃取劑的萃取反應機理是陰離子交換機理。屬於這類萃取劑的主要有伯胺、仲胺、叔胺和季胺鹽。伯胺、仲胺分子中含有N—H鍵,分子間可通過形成N—H……N氫鍵而締合,但叔胺分子間不發生締合。在有相同碳原子數的胺中,它們的沸點和熔點按伯胺、仲胺、叔胺依次降低。伯、仲、叔胺都能與水形成氫鍵N……H—O—H,因此,小分子量的胺易溶於水。隨著胺分子中所含碳原子數目增加,水溶性降低。相對分子量為250~600的大分子量的胺在水中溶解度很小,能很好地溶於某些有機溶劑中,適宜於作萃取劑;分子量大於600的烷基胺大都是固體,在稀釋劑中溶解度小,不宜作萃取劑。
在胺類萃取劑中由於存在氫鍵,分子間會發生締合作用,通常發生的不是雙分子締合而是多分子締合。
各類鹼性萃取劑的締合程度既與萃取劑的結構有關,也和稀釋劑的性質有關。脂肪胺鹽對硫酸鹽以外陰離子的締合易難順序為伯胺鹽<仲胺鹽<叔胺鹽<季胺鹽。烴基具有支鏈的仲胺,由於支鏈妨礙形成氫鍵,故締合能力較小。稀釋劑的極性對鹼性萃取劑締合程度的影響規律是,稀釋劑極性愈小,締合程度愈大。胺與酸生成胺鹽后,如果水相酸濃度高,便會發生胺鹽與酸生成1/1的離子締合體的反應,這種反應稱為胺鹽的加合反應。
脂肪胺的鹼性比無機氨鹼性強,這是由於烷基取代脂肪胺的氫后,烷基給電子的誘導效應使氨基氮原子上的電荷密度增大的結果。在水溶液中叔胺鹼性小於仲胺,這是由於空間位阻效應影響造成的,因三個烷基對氨基氮原子的屏蔽效應增大,從而阻礙了質子和氮原子的接近。
長鏈胺的鹼性強弱順序是伯胺>仲胺>叔胺,對萃取金屬配陰離子的選擇能力大小的順序是叔胺>仲胺>伯胺。因胺是弱鹼,只能在酸性溶液中萃取,而季胺鹽屬強鹼性萃取劑可在酸性、中性乃至鹼性溶液中進行萃取。
濕法冶金中所使用的螯合萃取劑主要是酸性螯合萃取劑,主要有羥酮類萃取劑、羥醛類萃取劑和喹啉類萃取劑。
羥酮類萃取劑和羥醛類萃取劑屬羥肟類化合物。羥肟分子中含有羥基(—OH)和肟基(=C=NOH),由於羥肟分子結構中具有不能自由旋轉的碳-氮雙鍵(C=N),故存在著順反式異構體。兩個羥基在雙鍵同側的為順式,在異側的則為反式。順、反二式的含量 一般為1/7左右。羥肟萃取金屬是通過羥基氧原子及肟基氮原子與金屬離子的螯合作用實現的。因此只有反式異構體才能萃取金屬離子。順式異構體中兩個—OH在同側,由於形成分子內氫鍵而不能萃取金屬。
羥肟苯環上的羥基能電離出氫離子而顯示酸性,而肟基上的羥基電離出氫離子的能力很弱。含有酚羥基的羥肟的酸性會增強。羥肟類化合物對銅金屬離子有較強的螯合能力,因此是銅的萃取劑。Lix63、Lix64N、Lix65N、Lix70N、Lix984等羥酮肟萃取劑對銅離子有高的選擇性,是銅的特效萃取劑。羥醛肟萃取劑也是銅的特效萃取劑,5-壬基水楊醛肟是這類萃取劑的重要萃取劑,簡稱為P1或P50,它萃取銅的性能比羥酮肟類萃取劑好。
用反萃取劑使被萃取物從負載有機相返回水相的過程。為萃取的逆過程。反萃取劑主要起破壞有機相中被萃組分結構的作用,使被萃組分生成易溶於水的化合物,或生成既不溶於水也不溶於有機相的沉澱。反萃取過程具有簡單、便於操作和周期短的特點,是溶劑萃取分離工藝流程中的一個重要環節。反萃取可將有機相中各個被萃組分逐個反萃到水相,使被分離組分得到分離;也可一次將有機相中被萃組分反萃到水相。經過反萃取及所得反萃液經過進一步處理后,便得到被分離物的成品。反萃后經洗滌不含或少含萃合物的有機相稱再生有機相,繼續循環使用。濕法冶金常用的反萃取劑主要有無機酸如H2SO4、HNO3、HCl及無機鹼如NaOH、、Na2CO3等。
環境科學
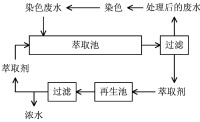
萃取過程中所用的溶劑。要求對液體或固體混合物中的組分具有選擇性的溶解能力。如果是液液萃取,則還要求不溶或僅稍溶於被萃取的溶液中。萃取常用作廢水處理物理化學方法之一。將萃取劑投到廢水中,通過混合傳質過程,水中的溶質 (污染物) 即溶於萃取劑中,藉助比重的不同,將萃取劑與廢水分離,廢水得到一定程度的凈化,而溶質 (污染物) 可從萃取劑中分離出來回收利用,萃取劑得到再生可重複使用。如含酚廢水中的酚和洗毛廢水中的羊毛脂均用萃取劑處理回收。常用的萃取劑有苯、二甲苯、輕焦油、醋酸丁酯、三甲酚磷酸酯、異丙醚等。
土木建築
實現萃取分離所用的溶劑。可以是單組分溶劑,也可以用多組分混合溶劑。廢水處理所用萃取劑的條件有:①對被萃取物有較高的分配係數,以節省萃取劑用量,提高萃取效率;②不溶於水或難溶於水,以減少萃取劑的流失;③與水的物理、化學性質有較大區別,如與水有一定的密度差,通過重力分離,便於把萃取劑與水分離開;或溶劑-水-溶質之間的沸點差別大,便於用蒸餾或蒸發的方法回收溶劑等;④易於回收與再生;⑤化學穩定性好;⑥無毒,以免流失的少量萃取劑產生新的有毒廢水。
化工過程
指能夠與被 萃取物質結合,使後者轉入其中的化學試劑。一般要求萃取劑對混合物中的欲萃組分有較高的萃取能力(即有較高的分配係數值),有較好的萃取選擇性(即有較大的分離係數值),不溶或極少溶於被萃溶液,較高的沸點和閃點,有較高的熱穩定性和化學穩定性,較小的腐蝕性和毒性以及價廉和容易取得等。萃取劑可用單組分溶劑,也可用多組分混合溶劑。例如用四乙二醇醚、N-甲基吡咯烷酮、環丁碸等作萃取劑,從催化重整生成油或加氫精製裂解汽油中提取芳烴;用二(2-乙基己基磷酸)作萃取劑,用煤油作稀釋劑,用磷酸三丁酯作調節劑,從鈾礦石的硫酸浸出液中提取鈾;用三氯乙烯作萃取劑從咖啡中去除咖啡因等。萃取劑按性能可分為:中性萃取劑,如醇、酮、醚、酯、醛 及烴類;酸性萃取劑,如羧酸、酸性 磷酸酯等;螯合萃取劑也是酸性萃取劑,與被萃取離子生成螯環化合物,釋放出氫離子;胺類萃取劑,如叔胺、季胺鹽。反萃取所用的溶劑,稱為反萃劑,對有機液的反萃取,通常用純水或酸、鹼、鹽的水溶液。
目錄
