肌動蛋白
微絲的結構蛋白
肌動蛋白,是微絲的結構蛋白,以兩種形式存在,即單體和多聚體。單體的肌動蛋白是由一條多肽鏈構成的球形分子,又稱球狀肌動蛋白(globularactin,G-actin),外形類似花生果。肌動蛋白的多聚體形成肌動蛋白絲,稱為纖維狀肌動蛋白(fibrosactin,F-actin)。在電子顯微鏡下,F-肌動蛋白呈雙股螺旋狀,直徑為8nm,螺旋間的距離為37nm。肌動蛋白是真核細胞中最豐富的蛋白質。在肌細胞中,肌動蛋白佔總蛋白的10%,即使在非肌細胞中,肌動蛋白也占細胞總蛋白的1~5%。
肌動蛋白是一種中等大小的蛋白質,由375個氨基酸殘基組成,並且是由一個大的、高度保守的基因編碼。單體肌動蛋白分子的分子量為43kDa,其上有三個結合位點。一個是ATP結合位點,另兩個都是與肌動蛋白結合的結合蛋白結合位點。
肌動蛋白至少表達成6種異構形式,分為α、β、γ三種類型根據等電點的不同可將高等動物細胞內的肌動蛋白分為3類,α分佈於各種肌肉細胞中,β和γ分佈於肌細胞和非肌細胞中。有三種α肌動蛋白(骨骼肌、心肌和平滑肌)、一種β肌動蛋白和兩種γ肌動蛋白(γ平滑肌和γ非平滑肌)。
真核細胞需要肌動蛋白纖維網路來控制並維持其形態及內部構造,而形成這些網路的第一步是新肌動蛋白纖維的成核。多種細胞因子都具備形成新肌動蛋白纖維的能力,並且每種因子都能形成一種特定的網路。其中研究最多的是肌動蛋白相關蛋白2/3複合物(Arp2/3),Arp2/3通過在已經存在的纖維周圍聚集新纖維來形成網路。為了產生運動力,並移動細胞膜,Arp2/3需要其它蛋白的協助,其中包括加帽蛋白(cappingprotein,CP)。
加帽蛋白是成核Arp2/3網路的重要組成成分,肌動蛋白網路能驅動運動發生。傳統理論認為,快速的運動需要肌動蛋白纖維快速增長,因此,CP能通過在細胞中大部分的肌動蛋白纖維快速生長的鉤端加帽,從而增加穩定狀態肌動蛋白單體的濃度。而增加的單體濃度能導致剩餘的少量未加帽肌動蛋白纖維更快速延長,從而形成更快速的運動。然而以上理論從未得到實驗的驗證。
為了驗證以上假說,並更好了解Arp2/3複合體及CP之間的相互作用,來自美國的一組科學家進行了詳細的研究,並在2008年5月30日出版的《細胞》(Cell)上發表了他們的實驗結果。實驗中,科學家利用純化的組分再造了肌動蛋白運動。研究人員將外層鍍有ActA(從單核細胞增多性李斯特氏菌Listeria monocytogenes中得到的一種Arp2/3活化蛋白)的聚苯乙烯小球和五種純化的因子混合,這五種因子包括:細胞質肌動蛋白、Arp2/3複合體、CP、絲切蛋白cofilin、以及單體結合蛋白profilin。Cofilin通過水解ATP分解肌動蛋白纖維,而profilin催化肌動蛋白單體間的核苷交換。
在實驗中,科學家發現復蓋有ActA的小球首先球狀聚集肌動蛋白外殼,2-5分鐘後分解,研究小組通過變化濃度研究了Arp2/3與CP間的關係,並分析了它們對肌動蛋白網路的形態、運動以及生物化學組成的作用。最終,科學家得到兩個重要結論:首先,CP作用是使肌動蛋白單體遠離鉤端,並趨向於Arp2/3複合體,因此,CP並非傳統理論描述的那樣,是通過增加纖維長度來促進運動。相反的,CP通過Arp2/3複合體使更多纖維成核來促進運動。其次,運動的速度與肌動蛋白網路的組裝速度可能是無關的,運動速度很大程度上取決於CP和Arp2/3,但肌動蛋白組裝速度卻對這兩者的變化不敏感。換言之,通過重構結構,枝狀肌動蛋白網能在同樣的組裝動力學條件下支持不同的運動速度。
肌動蛋白是肌肉結構蛋白的一種。在肌肉運動中起重要作用。存在於橫紋肌肌原纖維的細絲中,也存在於平滑肌中。它也是細胞中一個重要的司運動的蛋白質。
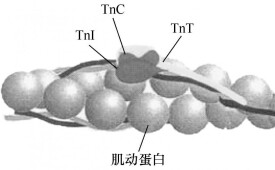
肌動蛋白是球狀的蛋白質,分子量約為42000一48000,分子直徑約為5納米。一個肌動蛋白分子結合一個腺苷三磷酸分子。球狀肌動蛋白可以締合成纖維狀肌動蛋白。後者兩股絞合在一起,形成骨架,再嵌上原肌球蛋白及肌鈣蛋白,即成肌肉中肌原纖維的細絲。
它的氨基酸序列也是最高度保守的蛋白質之一,因為它在進化過程中幾乎沒有變化,在藻類和人類等多種物種中的差異不超過20%。它有兩個顯著特徵:它是一種緩慢水解 ATP的酶,是生物過程的“通用能量貨幣”。但是,ATP是必需的,以保持其結構完整性。其高效的結構由幾乎獨特的摺疊過程形成。此外,它能夠比任何其他蛋白質進行更多的相互作用,這使得它在幾乎所有細胞生命水平上都能比其他蛋白質發揮更廣泛的功能。肌球蛋白是與肌動蛋白結合的蛋白質的一個例子。另一個例子是絨毛蛋白,它可以根據周圍培養基中鈣陽離子的濃度將肌動蛋白編織成束或切割長絲。
肌動蛋白是真核生物中最豐富的蛋白質之一,在整個細胞質中發現它。事實上,在肌肉纖維中,它占細胞總蛋白質的20%,在其他細胞中佔1%-5%。然而,不僅有一種肌動蛋白,編碼肌動蛋白的基因被定義為基因家族(植物中含有超過60種元素的家族,包括基因和假基因,在人類中超過30種元素)。這意味著每個個體的遺傳信息都包含產生肌動蛋白變體(稱為同種型)的指令,這些變體具有略微不同的功能。反過來,這意味著真核生物表達不同的基因,這些基因產生:α-肌動蛋白,存在於收縮結構中;β-肌動蛋白,發現於細胞的擴展邊緣,使用其細胞結構的投射作為其移動手段;γ-肌動蛋白,存在於應力纖維的細絲中。除了生物體異構體之間存在的相似性之外,甚至在不同真核生物結構域中包含的生物體之間也存在結構和功能的進化保守性:在細菌中已經鑒定出肌動蛋白同源物 MreB,其是一種蛋白質。能夠聚合成微絲。在古生菌中,同系物Ta0583甚至更類似於真核動物。
細胞肌動蛋白有兩種形式:稱為G-肌動蛋白的單體小球和稱為F-肌動蛋白的聚合物長絲(即,由許多G-肌動蛋白單體組成的長絲)。F-肌動蛋白也可以描述為微絲。兩條平行的F-肌動蛋白鏈必須旋轉166度才能正確地位於彼此的頂部。這產生了在細胞骨架中發現的微絲的雙螺旋結構。微絲的直徑約為7nm,螺旋每37nm重複一次。每個肌動蛋白分子都與三磷酸腺苷(ATP)或二磷酸腺苷(ADP)分子結合,後者與Mg2+陽離子相關。與所有可能的組合相比,最常見的肌動蛋白形式是ATP-G-肌動蛋白和ADP-F-肌動蛋白。
結構蛋白的主要相互作用是基於鈣粘蛋白的粘附連接。肌動蛋白絲通過紐 蛋白與α- 肌動蛋白和膜連接。紐蛋白的頭部結構域通過α-連環蛋白, β-連環蛋白和γ-連環蛋白與E-鈣粘蛋白結合。紐蛋白的尾部結構域與膜脂質和肌動蛋白絲結合。
儘管大多數酵母僅具有單個肌動蛋白基因,但是高等真核生物通常表達由相關基因家族編碼的幾種肌動蛋白同種型。哺乳動物至少有6種肌動蛋白異構體由不同的基因編碼,根據它們的等電點分為三類(α, β和γ)。一般來說,α肌動蛋白存在於肌肉中(α-骨骼,α-主動脈平滑,α-心臟),而β和γ同種型在非肌肉細胞中很突出(β-細胞質,γ1-細胞質,γ2-腸道平滑)儘管同種型的氨基酸序列和體外特性高度相似,但這些同種型在體內不能完全相互替代。
典型的肌動蛋白基因具有約100個核苷酸的5'UTR,1200個核苷酸的翻譯區和200個核苷酸的3'UTR。大多數肌動蛋白基因被內含子打斷,在19個特徵明確的位置中有多達6個內含子。家族的高保守性使肌動蛋白成為比較內含子-早期和內含子-晚期內含子進化模型的研究的優選模型。
所有非球形原核生物似乎都具有編碼肌動蛋白同源物的基因如MreB;這些基因是維持細胞形狀所必需的。質粒衍生的基因ParM編碼肌動蛋白樣蛋白,其聚合形式是動態不穩定的,並且似乎在細胞分裂期間通過類似於真核有絲分裂中微管所用的機制將質粒DNA分配到其子細胞中肌動蛋白存在於光滑和粗糙的內質網中。
肌動蛋白形成細絲('F-肌動蛋白'或微絲),其是真核細胞骨架的必需元件,能夠經歷非常快速的聚合和解聚動力學。在大多數細胞中,肌動蛋白絲形成更大規模的網路,這對於細胞中的許多關鍵功能是必不可少的:
各種類型的肌動蛋白網路(由肌動蛋白絲製成)為細胞提供機械支持,並提供通過細胞質的運輸途徑以幫助信號轉導肌動蛋白網路的快速組裝和拆卸使細胞能夠遷移(細胞遷移)。
在後生肌肉細胞中,作為肌球蛋白產生力以支持肌肉收縮的支架
在非肌肉細胞中,成為貨物運輸肌球蛋白(非常規肌球蛋白)的軌道,如肌球蛋白V和VI。非常規肌球蛋白使用ATP水解以定向方式運輸貨物(例如囊泡和細胞器)比擴散快得多。肌球蛋白V走向肌動蛋白絲的帶刺末端,而肌球蛋白VI走向尖端。大多數肌動蛋白絲被布置成帶倒鉤的末端朝向細胞膜,尖端朝向細胞內部。這種安排使肌球蛋白V成為出口貨物的有效馬達,肌球蛋白VI成為進口的有效馬達。
肌動蛋白在細胞質和細胞核中都有發現。其位置受細胞膜信號轉導途徑的調節,所述細胞膜信號轉導途徑整合細胞受到的刺激,刺激肌動蛋白網路的重建作為響應。在盤基網柄菌中,已發現磷脂酶D介入肌醇磷酸途徑。肌動蛋白絲是特別穩定和豐富的肌肉纖維。在肌節內(肌纖維的基本形態和生理單位)肌動蛋白存在於I和A帶中;肌球蛋白也存在於後者中。
有許多毒素可以通過阻止肌動蛋白聚合(latrunculin和細胞鬆弛素D)或通過穩定它(鬼筆環肽)來干擾肌動蛋白的動力學:
Latrunculin是一種由海綿產生的毒素,它與G-肌動蛋白結合,阻止它與微絲結合。
細胞色素D是由真菌產生的生物鹼,其與F-肌動蛋白的(+)末端結合,阻止添加新單體。已發現Cytocalasin D可破壞肌動蛋白的動態,激活動物體內的蛋白質p53。
鬼筆環肽(Phalloidin)是一種從死亡蘑菇傘形毒蕈(Amanita phalloides)中分離出來的毒素。它與F-肌動蛋白聚合物中相鄰肌動蛋白單體之間的界面結合,阻止其解聚。