蛋白質代謝
蛋白質在細胞內的代謝途徑
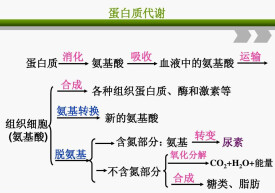
蛋白質代謝指蛋白質在細胞內的代謝途徑。各種生物均含有水解蛋白質的蛋白酶或肽酶,這些酶的專一性不同,但均能破壞肽鍵,使各種蛋白質水解成其氨基酸成分的混合物。食物中的蛋白都要降解為氨基酸才能被機體利用,體內蛋白也要先分解為氨基酸才能繼續氧化分解或轉化。合成蛋白是主要用途,約佔75%,而蛋白質提供的能量約佔人體所需總能量的10-15%。
1、蛋白質代謝以氨基酸為核心,細胞內外液中所有遊離氨基酸稱為遊離氨基酸庫,其含量不足氨基酸總量的1%,卻可反映機體氮代謝的概況。食物中的蛋白都要降解為氨基酸才能被機體利用,體內蛋白也要先分解為氨基酸才能繼續氧化分解或轉化。
2、遊離氨基酸可合成自身蛋白,可氧化分解放出能量,可轉化為糖類或脂類,也可合成其他生物活性物質。合成蛋白是主要用途,約佔75%,而蛋白質提供的能量約佔人體所需總能量的10-15%。蛋白質的代謝平衡稱氮平衡,一般每天排出5克氮,相當於30克蛋白質。
3、氨基酸通過特殊代謝可合成體內重要的含氮化合物,如神經遞質、嘌呤、嘧啶、磷脂、卟啉、輔酶等。磷脂的合成需S-腺苷甲硫氨酸,氨基酸脫羧產生的胺類常有特殊作用,如5-羥色胺是神經遞質,缺少則易發生抑鬱、自殺;組胺與過敏反應有密切聯繫。
蛋白質合成代謝是蛋白質由氨基酸形成的過程。它依賴於五個過程:氨基酸合成,轉錄,翻譯,翻譯后修飾和蛋白質摺疊。蛋白質由氨基酸製成。在人類中,可以使用已經存在的中間體合成一些氨基酸。這些氨基酸被稱為非必需氨基酸。必需氨基酸需要人體中不存在的中間體。這些中間體必須攝入,主要是攝食其他生物。
1.轉錄
在轉錄中,RNA聚合酶讀取DNA鏈併產生可以進一步翻譯的mRNA鏈。為了啟動轉錄,要轉錄的DNA片段必須是可接近的(即它不能緊密包裝)。一旦DNA片段可及,RNA聚合酶就可以通過將RNA核苷酸與模板DNA鏈配對來開始轉錄編碼DNA鏈。在初始轉錄階段期間,RNA聚合酶在DNA模板鏈上搜索啟動子區域。一旦RNA聚合酶與該區域結合,它就開始以3'至5'方向“讀取”模板DNA鏈。RNA聚合酶附著與模板DNA鏈互補的RNA鹼基(將使用尿嘧啶代替胸腺嘧啶)。新的核苷酸鹼基共價鍵合。新鹼基最終與DNA鹼基分離,但保持相互連接,形成新的mRNA鏈。該mRNA鏈以5'至3'方向合成。一旦RNA到達終止子序列,它就會從DNA模板鏈解離並終止mRNA序列。
通過轉錄因子在細胞中調節轉錄。轉錄因子是與DNA鏈中的調節序列結合的蛋白質,例如啟動子區域或操縱子區域。與這些區域結合的蛋白質可以直接停止或允許RNA聚合酶讀取DNA鏈,或者可以指示其他蛋白質停止或允許RNA聚合酶讀取。
2.翻譯
在翻譯過程中,核糖體將mRNA序列(信使RNA)轉化為氨基酸序列。每個3鹼基對長的mRNA區段是對應於一個氨基酸或終止信號的密碼子。氨基酸可以具有與其對應的多個密碼子。核糖體不直接將氨基酸連接至mRNA密碼子。他們也必須利用tRNA(轉移RNA)。轉移RNA可以與氨基酸結合併含有可與氫結合mRNA密碼子的反密碼子。將氨基酸與tRNA結合的過程稱為tRNA充電。這裡,氨基醯基-tRNA合成酶催化兩個反應。在第一個中,它將AMP分子(從ATP切割)附著到氨基酸上。第二反應裂解氨醯基-AMP產生能量以將氨基酸連接至tRNA分子。
核糖體有兩個亞基,一個大,一個小。這些亞基圍繞mRNA鏈。較大的亞基含有三個結合位點:A(氨基醯基),P(肽基)和E(出口)。在翻譯起始后(其在原核生物和真核生物中不同),核糖體進入延長期,其遵循重複循環。首先,具有正確氨基酸的tRNA進入A位點。核糖體將肽從P位點的tRNA轉移到A位點的tRNA上的新氨基酸。來自P位點的tRNA將被轉移到E位點,在那裡它將被彈出。這種情況持續發生,直到核糖體到達終止密碼子或接收到停止的信號。A.肽鍵與P位點中與tRNA連接的氨基酸和與A位點中的tRNA連接的氨基酸形成。肽鍵的形成需要能量輸入。兩個反應分子是一個氨基酸的α氨基和另一個氨基酸的α羧基。這種鍵形成的副產物是水的釋放(氨基提供質子,而羧基提供羥基)。
翻譯可以下調的miRNA的(微RNA)。這些RNA鏈可以切割它們互補的mRNA鏈,從而停止翻譯。翻譯也可以通過輔助蛋白進行調節。例如,稱為真核起始因子-2(eIF-2)的蛋白質可以與核糖體的較小亞基結合,開始翻譯。當elF-2被磷酸化時,它不能與核糖體結合併停止翻譯。
3.翻譯后修飾
一旦肽鏈合成,它仍然必須被修飾。翻譯后修飾可以在蛋白質摺疊之前或之後發生。翻譯后修飾肽鏈的常見生物學方法包括甲基化,磷酸化和二硫鍵形成。甲基化通常發生於精氨酸或賴氨酸和涉及將甲基的氮(置換氫)。這些氨基酸上的R基團可以被甲基化只要與氮的鍵不超過4,就會多次。甲基化降低了這些氨基酸形成氫鍵的能力,因此甲基化的精氨酸和賴氨酸具有與其標準對應物不同的性質。磷酸化通常發生在絲氨酸,蘇氨酸和酪氨酸上,並涉及用磷酸基團取代R基團末端的醇基上的氫。這增加了R基團的負電荷,因此將改變氨基酸與其標準對應物相比的行為方式。二硫鍵形成是二硫鍵(共價鍵)的產生)在鏈中的兩個半胱氨酸氨基酸之間,其增加了摺疊結構的穩定性。
肽鏈的盤曲摺疊
4.蛋白質摺疊
細胞中的多肽鏈不必保持線性;它可以變成分支或摺疊在自身上。多肽鏈以特定方式摺疊,這取決於它們所處的溶液。所有氨基酸含有具有不同性質的R基團的事實是蛋白質摺疊的主要原因。在諸如胞質溶膠的親水環境中,疏水性氨基酸將集中在蛋白質的核心,而親水性氨基酸將在外部。這是熵有利的因為水分子可以比疏水性氨基酸更自由地在親水性氨基酸周圍移動。在疏水環境中,親水性氨基酸將集中在蛋白質的核心,而疏水性氨基酸將在外部。由於親水性氨基酸之間的相互作用強於疏水性 - 親水性相互作用,因此這在焓方面是有利的。一旦多肽鏈完全摺疊,它就被稱為蛋白質。儘管存在僅含有一條多肽鏈的生理蛋白,但通常許多亞基將組合形成功能完整的蛋白質。蛋白質還可以結合其他分子,如血紅素基團中的血紅蛋白,一種負責攜帶血液中氧氣的蛋白質。
蛋白質分解代謝是蛋白質被分解成的氨基酸過程。也稱為蛋白水解,然後可以進一步進行氨基酸降解。
1.蛋白酶
最初被認為僅破壞酶促反應,蛋白酶(也稱為肽酶)實際上通過切割幫助分解代謝蛋白質併產生之前不存在的新蛋白質。蛋白酶也有助於調節代謝途徑。他們這樣做的一種方法是在不需要運行的途徑中切割酶(即當血糖濃度高時糖原異生)。這有助於節省儘可能多的能量並避免徒勞無功的循環。當分解代謝和合成代謝途徑在相同時間和相同反應的速率下都有效時,發生無效循環。由於產生的中間體被消耗,因此身體不會產生凈增益。能量通過徒勞的循環而消失。蛋白酶通過改變其中一種途徑的速率來阻止這種循環,或者通過切割關鍵酶,它們可以阻止其中一種途徑。當與底物結合時,蛋白酶也是非特異性的,允許細胞和其他蛋白質內的大量多樣性,因為它們可以以能量有效的方式更容易地裂解。
因為許多蛋白酶是非特異性的,它們在細胞中受到高度調節。沒有調節,蛋白酶會破壞生理過程中的許多必需蛋白質。身體調節蛋白酶的一種方法是通過蛋白酶抑製劑。蛋白酶抑製劑可以是其他蛋白質,小肽或分子。有兩種類型的蛋白酶抑製劑:可逆和不可逆。可逆蛋白酶抑製劑與限制其功能的蛋白酶形成非共價相互作用。它們可以是競爭性抑製劑,非競爭性抑製劑和非競爭性抑製劑。競爭性抑製劑與肽競爭結合蛋白酶活性位點。當競爭肽結合時,非競爭性抑製劑與蛋白酶結合,但不讓蛋白酶切割肽鍵。非競爭性抑製劑可以做到這兩點。不可逆的蛋白酶抑製劑共價修飾蛋白酶的活性位點,因此它不能切割肽。
2.外肽酶
外肽酶是主要通過添加水來切割氨基酸側鏈末端的酶。這些酶有兩類:氨肽酶和羧肽酶。氨肽酶是從蛋白質的氨基末端去除氨基酸的酶。它們存在於所有生命形式中並且對於生存至關重要,因為它們為了保持穩定而執行許多細胞任務。這種形式的肽酶是鋅金屬酶,它被過渡態類似物抑制。該模擬類似於實際的過渡狀態因此它可以使酶與其結合而不是實際的過渡態,從而防止底物結合併降低反應速率。羧肽酶在蛋白質的羧基末端裂解。雖然它們可以使蛋白質分解代謝,但它們更常用於轉錄后修飾。
3.內肽酶
內肽酶是指到內部加水酶肽鍵在肽鏈和打破鍵。三種常見的內肽酶是胃蛋白酶,胰蛋白酶和胰凝乳蛋白酶。胰凝乳蛋白酶進行水解反應,在芳香族殘基后裂解。涉及的主要氨基酸是絲氨酸,組氨酸和天冬氨酸。它們都在切割肽鍵中起作用。這三種氨基酸被稱為催化三聯體,這意味著這三種氨基酸必須全部存在才能正常發揮作用。胰蛋白酶在長的帶正電荷的殘基后切割,並在活性位點具有帶負電荷的結合口袋。兩者都作為酶原產生,意味著它們最初以其無活性狀態存在,並且在通過水解反應裂解后,它們被激活。非共價相互作用,如肽骨架和催化三聯體之間的氫鍵有助於提高反應速率,使這些肽酶有效地切割許多肽。
外源蛋白有抗原性,需降解為氨基酸才能被吸收利用。只有嬰兒可直接吸收乳汁中的抗體。可分為以下兩步:
2、腸是消化的主要場所。腸分泌的碳酸氫根可中和胃酸,為胰蛋白酶、糜蛋白酶、彈性蛋白酶、羧肽酶、氨肽酶等提供合適環境。腸激酶激活胰蛋白酶,再激活其他酶,所以胰蛋白酶起核心作用,胰液中有抑制其活性的小肽,防止在細胞中或導管中過早激活。外源蛋白在腸道分解為氨基酸和小肽,經特異的氨基酸、小肽轉運系統進入腸上皮細胞,小肽再被氨肽酶、羧肽酶和二肽酶徹底水解,進入血液。所以飯後門靜脈中只有氨基酸。
1、內源蛋白降解速度不同,一般代謝中關鍵酶半衰期短,如多胺合成的限速酶-鳥氨酸脫羧酶半衰期只有11分鐘,而血漿蛋白約為10天,膠原為1000天。體重70千克的成人每天約有400克蛋白更新,進入遊離氨基酸庫。
2、內源蛋白主要在溶酶體降解,少量隨消化液進入消化道降解,某些細胞器也有蛋白酶活性。內源蛋白是選擇性降解,半衰期與其組成和結構有關。有人認為N-末端組成對半衰期有重要影響(N-末端規則),也有人提出半衰期短的蛋白都含有一個富含脯氨酸、谷氨酸、絲氨酸和蘇氨酸的區域(PEST區域)。如研究清楚,就可能得到穩定的蛋白質產品。
食用蛋白質后15分鐘就有氨基酸進入血液,30到50分鐘達到最大。氨基酸的吸收與葡萄糖類似,有以下方式:
1、需要載體的主動轉運,需要鈉,消耗離子梯度的勢能。已發現6種載體,運載不同側鏈種類的氨基酸。
2、基團轉運,需要谷胱甘肽,每轉運一個氨基酸消耗3個ATP,而用載體轉運只需三分之一個。此途徑為備用的旁路,一般無用。