注射用紫杉醇脂質體
注射用紫杉醇脂質體
注射用紫杉醇脂質體,適應症為本品可用於卵巢癌的一線化療及以後卵巢轉移性癌的治療、作為一線化療,本品也可以與順鉑聯合應用。本品也可用於曾用過含阿黴素標準化療的乳腺癌患者的後續治療或複發患者的治療。本品可與順鉑聯合用於不能手術或放療的非小細胞肺癌患者的一線化療。
化學名稱為:5β,20-環氧-1,2α,4,7β,10β,13α-六羥基紫杉烷-11-烯-9-酮-4,10-二乙酸酯-2-苯甲酸酯-13[(2’R,3’S)-N-苯甲醯-3-苯基異絲氨酸酯]
化學結構式:
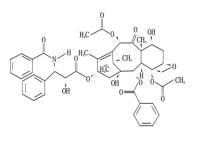
注射用紫杉醇脂質體
分子量:853.92
本品為類白色或淡黃色塊狀物,微有卵磷脂腥味。
本品可用於卵巢癌的一線化療及以後卵巢轉移性癌的治療、作為一線化療,本品也可以與順鉑聯合應用。
本品也可用於曾用過含阿黴素標準化療的乳腺癌患者的後續治療或複發患者的治療。
本品可與順鉑聯合用於不能手術或放療的非小細胞肺癌患者的一線化療。
30mg
常用劑量為135—175mg/m,使用前先向瓶內加入10ml 5%葡萄糖溶液,置專用振蕩器(振蕩頻率20HZ,振幅:X軸方向7cm、Y軸方向7cm、Z軸方向4cm)上振搖5分鐘,待完全溶解后,注入250-500ml 5%葡萄糖溶液中,採用[u]符合國家標準的一次性輸液器[/u]靜脈滴注3小時。
2.骨髓抑制:為主要劑量限制性毒性,表現為中性粒細胞減少,血小板降低少見,一般發生在用藥后8-10日。嚴重中性粒細胞減少發生率為47%,嚴重的血小板降低發生率為5%,貧血較常見。
4.心血管毒性:可有低血壓和無癥狀的短時間心動過緩,肌肉關節疼痛,發生率為55%,發生於四肢關節,發生率和嚴重程度呈劑量依賴性。
5.胃腸道反應:噁心,嘔吐,腹瀉和黏膜炎發生率分別為59%,43%和39%,一般為輕和中度。
7.脫髮:發生率為80%。
8.局部反應:輸注藥物的靜脈和藥物外滲局部的炎症。
1.紫杉醇類藥物過敏者禁用。
2.中性粒細胞低於1500個/mm者禁用。
1.用藥期間應定期檢查外周血象和肝功能。
2.本品只能用5%葡萄糖注射液溶解和稀釋,不可用生理鹽水或其他溶液溶解、稀釋,以免發生脂質體聚集。本品溶於5%葡萄糖注射液后,在室溫(25℃)和室內燈光下24小時內穩定。
3.肝功能不全者慎用。
對妊娠婦女未進行過系統研究,如果它被用於妊娠婦女或在應用本品期間病人懷孕,應立即告知病人具有的潛在危險。哺乳期婦女若使用本品,必須中止哺乳。
目前尚未有用於兒童的臨床經驗,要慎重使用。
未進行有關實驗且無可靠參考文獻。
尚無相應的解毒藥。用藥過量最主要的,可預測的併發症包括骨髓抑制,外周神經毒性及黏膜炎。
藥理作用
毒理研究
遺傳毒性:體外(人淋巴細胞染色體畸變試驗)和體內(小鼠微核試驗)試驗顯示紫杉醇是一種誘裂劑,但在Ames試驗和CHO/HGPRT基因突變試驗中未見其有致突變性。
生殖毒性:大鼠在交配前和交配期間給予紫杉醇,劑量達1mg/kg/天(按體表面積折算,約為臨床日推薦最大劑量的0.04倍)或以上時,可導致雌、雄大鼠生育力損傷,在此劑量下,本品引起生育力和生殖指數下降及胚胎毒性增加。
家兔在器官形成期給予紫杉醇3mg/kg/天,(按體表面積折算,約為臨床日推薦最大劑量的0.2倍),可引起子宮內死亡、吸收胎增加、死胎增加等胚胎和胎仔毒性,同時可見母體毒性。劑量為1mg/kg/天(按體表面積折算,約為臨床日推薦最大劑量的1/15)時,未見致畸作用。在更高劑量下,由於胎仔大量死亡,無法對本品的致畸性進行評價。尚無充分的和嚴格對照的孕婦臨床研究資料,如果患者在妊娠期間使用本品,或在使用本品期間懷孕,應被告之本品對胎兒的潛在危害。接受本品治療的育齡婦女應避免懷孕。
尚不清楚本品是否從人乳中排泄,大鼠在產後9-10天靜脈給予碳-14標記的紫杉醇,可見其乳汁中的放射濃度高於血漿,並與血漿濃度平行衰減。鑒於許多藥物都能從人乳中排泄和本品可能給哺乳嬰兒帶來嚴重不良反應,在接受本品治療時,建議停止哺乳。
遮光、密閉,在2—8℃保存
西林瓶包裝,1瓶/盒。
暫定18個月
國家食品藥品監督管理局標準(試行)WS-718(X-529)-2002。