EGFR
EGF細胞增殖和信號傳導的受體
EGFR(英語:epidermal growth factor receptor,簡稱為EGFR、ErbB-1或HER1)是表皮生長因子受體(HER)家族成員之一。該家族包括HER1(erbB1,EGFR)、HER2(erbB2,NEU)、HER3(erbB3)及HER4(erbB4)。HER家族在細胞生理過程中發揮重要的調節作用。
EGFR廣泛分佈於哺乳動物上皮細胞、成纖維細胞、膠質細胞、角質細胞等細胞表面,EGFR信號通路對細胞的生長、增殖和分化等生理過程發揮重要的作用。
EGFR分為三區:胞外配體結合區,跨膜區和胞內激酶區。
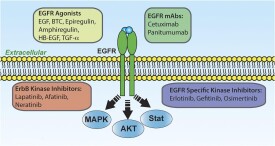
EGFR(Epidermal Growth Factor Receptor)是上皮生長因子(EGF)細胞增殖和信號傳導的受體。EGFR屬於ErbB受體家族的一種,該家族包括EGFR (ErbB-1),HER2/c-neu(ErbB-2),Her 3(ErbB-3) 和Her 4(ErbB-4)。EGFR也被稱作HER1、ErbB1,突變或過表達一般會引發腫瘤。EGFR是一種糖蛋白,屬於酪氨酸激酶型受體,細胞膜貫通,分子量170KDa。EGFR位於細胞膜表面,靠與配體結合來激活,包括EGF和TGFα(transforming growth factor α)。激活后,EGFR由單體轉化為二聚體,儘管也有證據表明,激活前也存在二聚體。EGFR還可能和ErbB受體家族的其他成員聚合來激活,例如ErbB2/Her2/neu。
EGFR二聚后可以激活它位於細胞內的激酶通路,包括Y992,Y1045, Y1068, Y1148 and Y1173等激活位點。這個自磷酸化可以引導下游的磷酸化,包括MAPK,Akt和JNK通路,誘導細胞增殖。受體激活對於皮膚的免疫來說很重要。
研究表明在許多實體腫瘤中存在EGFR的高表達或異常表達。EGFR與腫瘤細胞的增殖、血管生成、腫瘤侵襲、轉移及細胞凋亡的抑制有關。其可能機制有:EGFR的高表達引起下游信號傳導的增強;突變型EGFR受體或配體表達的增加導致EGFR的持續活化;自分泌環的作用增強;受體下調機制的破壞;異常信號傳導通路的激活等。EGFR的過表達在惡性腫瘤的演進中起重要作用,膠質細胞、腎癌、肺癌、前列腺癌、胰腺癌、乳腺癌等組織中都有EGFR的過表達。對膠質細胞瘤的研究發現EGFR的高表達主要與其基因擴增有關。但有時EGFR表達水平的調節異常也存在於翻譯及翻譯后。EGFR在腫瘤中的高表達還可能與活化后降解減少有關,一些研究指出c-Src可通過抑制受體泛素化和內吞作用而上調EGFR水平。許多腫瘤中有突變型EGFR存在,現已發現許多種EGFR突變型。突變型EGFR的作用可能包括:具有配體非依賴型受體的細胞持續活化;由於EGFR的某些結構域缺失而導致受體下調機制的破壞、異常信號傳導通路的激活、細胞凋亡的抑制等。突變體的產生是由於EGFR基因的缺失、突變和重排。EGFR的配體對細胞內信號傳導有很大影響。EGFR的配體通過自分泌形式激活EGFR促進細胞增殖,他們的共表達往往預示腫瘤預后不良,例如,在乳腺浸潤性導管癌的研究中發現,TGFα與EGFR共表達,且這種共表達與病人的生存率顯著相關。Kopp等人對結/直腸癌的研究表明腫瘤的自分泌生長是EGFR的過表達及其配體表達共同作用的結果。
此外,對EGFR與腫瘤的血管生成、高侵襲性及轉移關係的研究發現EGFR可以通過Ang-1及VEGF等因子水平的調節而影響腫瘤血管生成。
在配體與表皮生長因子受體(EGFR)結合后,受體發生了二聚作用,二聚作用既包括兩個同種受體分子的結合(同源性二聚作用),也包括人類EGF相關性受體(HER)酪氨酸激酶家族中的不同成員的結合(異源性二聚作用)。二聚作用后是酪氨酸殘基的自磷酸化作用。這些磷酸化的殘基是募集適配蛋白和額外的酪氨酸激酶底物的結合位點。蛋白質在激活的受體複合物中相互作用刺激ras蛋白,導致磷酸化級聯反應的發生和絲裂原激活蛋白(MAP)激酶的激活。或者轉錄信號傳導和激活、磷脂醯肌醇激酶-3(PI3K)-Akt和應激活化蛋白激酶(SAPK)信號傳導通路將被激活。這些信號通路依次觸發基因轉錄,同時控制細胞增生、分化和生存的通路被激活。
EGFR介導信號通路的特異性和強度取決於激活蛋白的性質和四種EGFR家族成員的水平。與HER2結合的配體不詳,但當HER2和EGFR共表達時,前者經常與配體激活的後者結合形成二聚體。這種異源性二聚體與EGFR同源性二聚體相比,往往具有更高的再利用率、穩定性和傳導信號的能力。EGFR也能與HER3和HER4發生二聚作用,其產物具有更高的持久性和更強的PI3K活性。EGFR信號傳導通路一旦配體結合的EGFR被內吞入細胞,信號將終止,受體將被降解或再循環到細胞膜表面,這取決於配體的性質。例如,被結合的EGF受體將被降解,而被結合的TGF-α受體則進入再循環。不同的生長因子會影響EGFR信號通路的數量和持續時間。
EGFR信號通路有多重的生物學作用。例如,ras-MAPK信號轉導通路刺激細胞的分裂和遷徙。EGFR也是多種受體通路的重要介體,起到信號會聚點的作用,能夠將信號整和與多樣化。例如,在應激、膜解聚作用和一些非生理性刺激物(包括氧化劑、放射線和烷化劑)的反應中,反向激活能誘導EGFR酪氨酸激酶的磷酸化並隨後發生信號的轉導。EGFR家族的成員在正常發育中起了重要的作用,但在人類腫瘤中經常過度表達並失去控制。
EGFR和KRAS基因檢測
EGFR表達於正常上皮細胞表面,而在一些腫瘤細胞中常過表達,EGFR的過表達和腫瘤細胞的轉移、侵潤、預后差有關。EGFR下游的信號轉導通路主要有兩條:一條是Ras/Raf/MEK/ERK-MAPK通路,而另一條是PI3K/Akt/mTOR通路。
EGFR突變:EGFR酪氨酸激酶區域的突變主要發生在18-21外顯子,其中19和21號外顯子突變覆蓋突變的90%。
KRAS基因檢測
KRAS蛋白處於EGFR信號通路通路的下游。在正常生理情況下,EGFR信號通路被活化后,KRAS蛋白短暫激活,其後迅速失活,KRAS激活/失活效應是受控的。而KRAS基因突變時,可以導致EGFR信號通路持續激活,加速腫瘤細胞增殖。KRAS基因突變96%發生在第2號外顯子的12、13號密碼子。20%非小細胞肺癌(NSCLC)、30-35%大腸癌患者中存在KRAS基因突變。
KRAS基因檢測的重要性
K-ras基因可以是正常狀態(稱為野生型)或異常狀態(突變型)。K-ras突變型編碼異常的蛋白,刺激促進惡性腫瘤細胞的生長和擴散;並且不受上游EGFR的信號影響,所以對抗EGFR治療效果差。KRAS基因檢測可以篩選出EGFR靶向治療藥物有效的大腸癌患者,幫助醫生選擇對腫瘤病人最有效的治療方法,實現腫瘤病人的個體化治療。目前在歐美國家,大腸癌患者內科治療前已經常規檢測KRAS狀態,並且成為能否報銷相關抗EGFR治療費用的憑據。
K-ras基因突變發生的時間K-ras基因突變發生在腫瘤惡變的早期,並且原發灶和轉移灶的K-ras基因高度保持一致。一般認為,K-ras基因狀態不會因治療而發生變化。大腸癌患者K-ras基因突變異常的概率為30%-35%。