合成氣
以一氧化碳和氫氣為主的原料氣
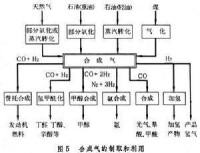
以氫氣、一氧化碳為主要組分供化學合成用的一種原料氣。由含碳礦物質如煤、石油、天然氣以及焦爐煤氣、煉廠氣、污泥和生物質等轉化而得。生物質和污泥在熱解或者氣化時也會產生大量的合成氣,從形成的氣體成分區分的,按合成氣的不同來源、組成和用途,它們也可稱為煤氣、合成氨原料氣、甲醇合成氣(見甲醇)等。合成氣的原料範圍極廣,生產方法甚多,用途不一,組成(體積%)有很大差別:
製造合成氣的原料含有不同的H/C摩爾比:對煤來說約為11;石腦油約為;天然氣最高為。由這些原料所製得的合成氣,其組成比例也各不相同,通常不能直接滿足合成產品的需要。例如:作為合成氨的原料氣,要求,需將空氣中的氮引入合成氣中(見合成氨原料氣);生產甲醇的合成氣要求 或用羰基合成法生產醇類時,則要求;生產甲酸、草酸、醋酸和光氣等則僅需要一氧化碳。為此,在合成氣製得后,尚需調整其組成,調整的主要方法是利用水煤氣反應(變換反應):,以降低一氧化碳,提高氫氣的含量。
合成氣的生產和應用在化學工業中具有極為重要的地位。早在1913年已開始從合成氣生產氨,現在氨已成為最大噸位的化工產品。從合成氣生產的甲醇,也是一個重要的大噸位有機化工產品。1939年,德國開發的乙炔氫羧化工藝曾是生產丙烯酸及其酯的重要方法。第二次世界大戰期間,德國和日本曾建立了十多座以煤為原料用費托合成從合成氣生產液體燃料(見煤間接液化)的工廠,戰後由於有廉價的原油,這些廠先後關閉。1945年,德國魯爾化學公司用羰基合成(即氫甲醯化)法生產高級脂肪醛和醇開發成功,此項工藝技術發展很快。60年代,在傳統費托合成的基礎上,南非開發了SASOL工藝,生產液體燃料並聯產乙烯等化工產品,以適應當地的特殊情況。1960年,聯邦德國巴登苯胺純鹼公司的甲醇羰基化生產醋酸工藝工業化;1970年,美國孟山都公司對此法作了重大改進,使之成為生產醋酸的主要方法,進而帶動了有關領域的許多研究。70年代石油漲價以後,又提出了碳一化學的概念。對合成氣應用的研究,引起了各國極大的重視。
合成氣
合成氣
合成氣
由合成氣可以生產一系列的化學品。

合成氣
合成氣在鐵催化劑作用下加壓反應生成烴,也可發展為生產汽油和丙酮、醇等低沸點產品。這類生產在特殊情況下尚有意義(見費托合成)。
此外,正在開發中的尚有用合成氣直接合成乙二醇、乙醇、醋酸、1,4-丁二醇等重要化工產品。(見彩圖)
第二次世界大戰前,合成氣主要是以煤為原料生產的;戰後,主要採用含氫更高的液態烴(石油加工餾分)或氣態烴(天然氣)作原料。1970年代以來,煤氣化法又受到重視,新技術及各種新的大型裝置相繼出現,顯示出煤在合成氣原料中的比重今後將有可能增長,但主要從烴類生產合成氣,所用方法主要有蒸汽轉化和部分氧化兩種。
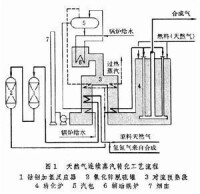
此法以天然氣或輕質油為原料,與水蒸氣反應製取合成氣。1915年,A.米塔斯和C.施奈德用蒸汽和以甲烷為主的天然氣,在鎳催化劑上反應獲得了氫。1928年,美國標準油公司首先設計了一台小型蒸汽轉化爐生產出氫氣。第二次世界大戰期間,開始用此法生產合成氨原料氣。
主要反應為:
主要工藝參數是溫度、壓力和水蒸氣配比。由於此反應是較強的吸熱反應,故提高溫度可使平衡常數增大,反應趨於完全。壓力升高會降低平衡轉化率。但由於天然氣本身帶壓,合成氣在後處理及合成反應中也需要一定壓力,在轉化以前將天然氣加壓又比轉化后加壓經濟上有利,因此普遍採用加壓操作,同時增加水蒸氣用量以提高甲烷轉化率。高水蒸氣用量也可防止催化劑上積炭。除上述主要反應外,還有下列反應發生:
此兩反應均為放熱反應。
在溫度 800~820℃、壓力、摩爾比3.5時,轉化氣組成(體積%)為:
為在工業上實現天然氣蒸汽轉化反應,可採用連續轉化和間歇轉化兩種方法。
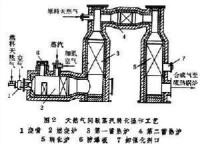
合成氣
合成氣
合成氣
是50年代英國卜內門化學工業公司開發的,1959年建成第一座工廠。此法主要反應為:
在許多方面與天然氣蒸汽轉化相似。比較高,更因其中除烷烴外,還有芳烴甚至少量烯烴,易生成炭而析出,因此必須採用抗析炭的催化劑。一般仍採用鎳催化劑,而以氧化鉀為助催化劑,氧化鎂為載體。輕質油中含硫一般較天然氣為高,而此催化劑對硫又很敏感,因此在蒸汽轉化前,需先嚴格脫硫,並同時加氫。裂化輕油脫硫十分困難,極少用來製取合成氣。用來制合成氣的是直餾輕質油。由於輕質油價格較高,又有上述不利之處,因此只有在缺少天然氣供應的地區,才發展以輕油原料的合成氣生產。
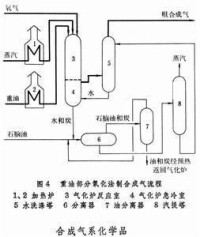
部分氧化 天然氣或輕質油蒸汽轉化的主要反應為強吸熱反應,反應所需熱量由反應管外燃燒天然氣或其他燃料供給,而部分氧化法則是把管內外反應合為一體。本法可不預脫硫,反應器結構材料比蒸汽轉化法便宜。此外,更主要的優點是不擇原料,幾乎從天然氣到渣油的任何液態或氣態烴都能適用。
此反應為強放熱反應。在高溫及水蒸氣存在下,二氧化碳及水蒸氣可與其他未燃燒甲烷發生吸熱反應:
所以主要產物為一氧化碳和氫氣,而燃燒最終產物二氧化碳不多。反應過程中為防止炭析出,需補加一定量的水蒸氣。這樣做同時也加強了水蒸氣與甲烷的反應。
天然氣部分氧化可以在催化劑的存在下進行,也可以不用催化劑。
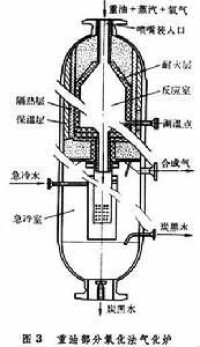
①非催化部分氧化 天然氣、氧、水蒸氣在或更高的壓力下,進入襯有耐火材料的轉化爐內進行部分燃燒,溫度高達出爐氣體組成(體積%)約為:。反應器用自熱絕熱式。
②催化部分氧化 使用脫硫后的天然氣與一定量的氧或富氧空氣以及水蒸氣在鎳催化劑下進行反應。當催化床層溫度約、操作壓力時,出轉化爐氣體組成(體積%)約為: 。反應器也採用自熱絕熱式,熱效率較高。反應溫度較非催化部分氧化法低。
反應產物主要也是一氧化碳和氫氣。反應條件為:不用催化劑,每噸原料加入水蒸氣量約為。水蒸氣起氣化劑作用,同時可以緩衝爐溫及抑制炭的生成。這種反應器的出口氣體用水直接急冷。該法的缺點是:①需要氧氣或富氧空氣,即需另設空氣分離裝置;②生成的氣體比蒸汽轉化法有更高的一氧化碳對氫氣的比例;③使用重油部分氧化時有炭黑生成,這不但增加了消耗,還將影響合成氣下一步處理和使用。使用油吸收除炭,炭與吸收油再循環返回氣化爐的方法。
新型煤化工主要應用先進、高效的煤氣化技術生產合成氣,相比傳統的煤化工,合成氣具有壓力高、惰性氣含量低、雜質易脫除等,用途更為廣泛。
氣流床加壓氣化技術大都以純氧作為氣化劑,在高溫高壓下完成氣化過程,粗煤氣中有效氣含量高,碳轉化率高,不產生焦油、萘和酚水等,是一種環境友好型的氣化技術。氣流床氣化技術主要分為水煤漿氣化技術和粉煤氣化技術。