海兔毒素
海兔毒素
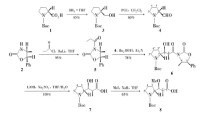
Dolastatin10(D10)合成路線
在20世紀70年代,Pettit 等開始對印度洋無殼軟體動物截尾海兔(Dolabella auricularia)中抗腫瘤活性成分的研究,並發現海兔提取物可以延長P388白血病小鼠的壽命。但由於獲得的這種活性物質含量太低以及當時技術條件的限制,直到80年代才開始以小鼠白血病P388模型為篩選體系,對印度洋、太平洋等海域的海兔進行了系統的研究。用色譜技術對2噸原料進行近2萬次反覆分離篩選,1987年從海洋無殼軟體動物截尾海兔(Dolabella auricularia)中分離得到一種由4個氨基酸組成的線性縮肽類天然毒性蛋白。
它是一種九肽,在生物體中含量極少。Pettit的研究組至今已鑒定出18個含有特殊氨基酸的較短鏈狀肽類化合物,命名為dolastatin1~18。其中Dolastatin3,Dolastatin10(D10),Dolastatin15的結構被確定。而D10是研究最多的一種,一般都以D10作為海兔毒素的代表。
D10是由4個氨基酸組成的線性縮肽類天然細胞毒性蛋白,含有9個不對稱碳原子,從氨基端開始依次是dolavaline(Dov)、valine、dolaisoleuine(Dil)、dolaproine(Dap)4種氨基酸及特異的可能從苯丙氨酸分離出來的伯胺dolaphenie(Doe)作為羧基端縮合而成,故有研究者稱其為5肽產物,相對分子質量為784。D10有一系列同分異構體,其中一些具有生物效應。天然的D-10產量極小,而現有的合成方法和路線僅限於實驗室規模,無法滿足日益增長的需求。其根本原因在於無法高效立體選擇合成D-10中最複雜的組分,即具有三個手性中心的Dolaproine(Dap)。傳統合成Dap 的方法主要有:(1)應用Reformatsky反應進行立體選擇性的合成β-羥基羰基化合物,通過引入空間位阻大的基團來控制2'-和3'-位手性,或者利用Zr,Rh等金屬以及鑭系元素,考察產物立體選擇性,但結果均不理想,並且得到的四個異構體分離困難。(2)應用Baylis-Hillman 反應和Ru 的催化作用,但只能單獨控制2'-位甲基構型,且仍是得到一對非對映異構體。(3)Walker等應用Evans羥醛縮合反應進行了順式“非Evans”體研究,通過TiCl4,SnCl4等路易斯酸,利用金屬螯合作用控制手性,但仍不能得到單一的順式產物。
1970年在太平洋的斐濟島曾發生一起攝食截尾海兔(Dolabella Auricularia)導致的2人食物中毒,這是海兔引起人類食物中毒的首例報道。病人食用海兔後半小時發病,主要表現為全身刺痛、發熱、嘔吐、腹瀉,繼而面部、肢體和手足的肌群出現自發性收縮、震顫、共濟失調等神經紊亂癥狀,最嚴重時出現呼吸困難,極度煩燥及視物扭曲。患者最後病癒出院,但留有口周肌肉抽搐的後遺症。Stallard及Faulkuer認為,海兔能濃集溴元素,且其消化腺的各種組分中已鑒定為溴化倍半萜。慢性溴中毒的特徵表現為共濟失調、震顫及幻覺等,溴在血漿中的半衰期長達12 d,故海兔致人類的食物中毒可能是一種亞急性有機溴中毒。
D10的抗腫瘤機制主要是通過與β微管蛋白的氨基酸殘基結合,影響新的異二聚體的加入,導致二聚體間的界面產生彎曲,累積后導致原來直纖絲彎曲,抑制微管的形成和聚合,並促使其解聚,同時阻礙微管蛋白依賴的GTP 水解,阻礙細胞的有絲分裂,使細胞停滯在細胞間期,且對多種癌細胞有誘導凋亡作用,是一類來源於海洋生物的新型細胞生長抑製劑。進一步研究表明,D10可結合到微管蛋白上的根黴素/美登素交換GTP 的結合位點,導致細胞阻滯在M期。在與其他抗有絲分裂藥物的比較發現,D10對細胞活性的抑制效果IC50= 0.5nMol / L,約為長春鹼(vinblastine)的40倍,根黴素(rhizoxin)的2倍,擬莖點黴毒素A(phomopsin A)的10000 餘倍,與美坦辛(maytansine,IC50= 0.5 nMol/L效果相當。研究還發現D10在細胞內的滯留時間比長春鹼長很多。D10通過巰基與微管蛋白結合與擬莖點黴毒素A相似,但與長春鹼和美坦辛不同。實驗研究表明D10是長春鹼類藥物的非競爭性抑製劑,當將其與作用於微管的藥物長春鹼合用時顯示協同作用。
