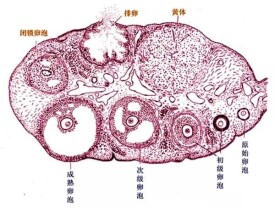
卵泡黃素化
無排卵性月經的一種特殊類型
未破裂卵泡黃素化綜合征(Luteinized Unruptured Follicle Syndrome, LUFS)是指卵泡成熟但不破裂,卵細胞未排出而原位黃素化,形成黃體並分泌孕激素,體效應器官發生一系列類似排卵周期的改變。臨床以月經周期常,有類似排卵表現但持續不孕為主要特徵。是無排卵性月經的一種特殊類型,也是引起的不孕的重要原因之一。
1975年Jewelewicz首先提出有卵泡不破裂而黃體化的情況,並命名為LUFS。治療方法是因人而異,往往以誘發排卵為主,最常用的方法是補充激素,如果用了促排卵葯后,反覆幾個月還是發生卵泡不破裂,就可能需要做試管嬰兒。
LUFS的發病原因尚不十分明了。多數認為與中樞調節紊亂、局部障礙及精神、心理等因素有關。其發病率各家報道不一,多數認為自然月經周期約為3%一5%,藥物促排卵周期約為30%~40%。根據B超動態監測可分為小卵泡型、卵泡滯留型及持續增大型三種類型。
1978年Marik等用腹腔鏡直接觀察卵巢表面,發現有些早期黃體確無排卵裂孔而進一步證實。因患者臨床表現隱匿、月經周期正常,故易被忽視而誤診為“原因不明”的不孕症,而其發病原因複雜,腹腔鏡等觀察方式有創傷性不易被接受,窿床相關報道及研究較少,尚缺乏統一診斷標準,給診斷治療帶來相應困難,故被列為婦科生殖內分泌臨床研究的難題。
中醫尚無相應病名,多歸屬為“不孕症”範疇。
黃素化未破裂綜合征是卵巢無排卵性月經的一種特殊類型。在正常排卵的過程中,卵巢中的一個優勢卵泡發育成熟,在月經周期的中期發生破裂,排出卵子,並同時形成黃體,排卵前期分泌大量的雌激素,排卵后黃體分泌大量的孕激素。在雌、孕激素的作用下,子宮內膜由增殖期轉變為分泌期;宮頸粘液由清稀、透明轉變為粘稠、渾濁;基礎體溫呈雙相型特點。但在黃素化未破裂綜合征的患者有兩個特點:
卵泡黃素化
正常的月經周期中,卵泡經歷許多生化、物理和結構改變,如卵泡隨生長移向皮質表層並突起於卵巢表面。突起的頂部充血、毛細血管內栓塞、間質融化,膠原纖維水解,最後成熟破裂排出卵細胞。但LUF的發生機制未明,有認為與卵泡發育有關,有認為與前列腺素有關,有認為與子宮內膜異位症有關,此外卵巢內局部水解酶、膠原酶、前列腺素功能失調或缺陷也待排除。李念珍報道對家兔在排卵前投以消炎痛,抑制了其排卵經過的變化。Wailacb等對獼猴進行HMG—HCG聯合應用促排卵時加用消炎痛后,見卵巢發生卵泡不破裂但持續分泌黃體酮,再使用前列腺素(PGF2。)后又恢復排卵功能。LuF也見於誘發排卵的月經周期中。
Kerin等認為這種情況僅為生殖調節中一項暫時性偏異,並不構成一種綜合征群。他們對66名月經規律的婦女,逐日進行B超監測,共183周期,發現4.5%曾呈現此現象。
另外,有一項5篇報道的綜合分析提供了如下的一些資料:卵泡黃素化診斷率6.1%~46.6%;一組225名進行腹腔鏡檢查的婦女中,發生率為7.2%(0%一12.1%),另有一項對8篇腹腔鏡檢查結果報道的綜合分析,顯示507例患不孕症的婦女中卵泡黃素化發生率為42.2%(29.3%一68.3%)。而進行超聲監測的7組報道636名一般婦女中,卵泡黃素化發生率為18%(9%~54%)。經超聲檢查78例6篇LuF的重複發生率為31.8%(2.8%~88%),由此可見LuF可以重複發生並影響正常的生育功能,但並非必然。
近年國內的1篇觀察不孕婦女180個月經周期的報道,自然周期中卵泡黃素化佔10.1%,促排卵周期中LuF佔31.8%,且重複發生佔63.6%。另一篇1993年報道7l例月經正常,基礎體溫雙相型的不育者中卵泡黃素化38例(其中小卵泡黃素化23例)佔53.5%。
另有報道對28例無排卵不孕者用氯蔗酚胺促排卵,1例無反應,27鍘顯示排卵樣反應,但實際上有排卵者16例(59.2%),卵泡未破裂黃素化者11例(40.8%),對此11例給予同樣治療而見LuF重演。
不少報道認為卵泡黃素化常與子宮內膜異位症並存,近年國內有一報道46例經腹腔鏡證實的I期子宮內膜異位症中.卵泡黃素化佔48%。
中醫學認為本綜合征戰發生與腎、肝、血氣及沖任失調密切相關。腎藏精,主生殖生育,肝藏血,主疏泄調節,為“女子先天”,任通沖盛,男女兩“精”適時相搏,則胎氣乃成。若肝腎疏泄閉藏有度,血海蓄溢正常,開合有節,沖任調和則月經、妊娠正常;若腎氣(精)虧虛,肝失疏泄,血瘀氣滯,沖任胞脈失和,即使經水按期而至,亦不能攝“精”成孕。
LUFS發生機制未明,目前較多的設想是中樞內分泌紊亂;局部障礙;高PRL血症;酶或激酶不足或缺陷導致卵泡液凝集;其他如藥物因素及心因性因素等。
卵泡黃素化
2.局部障礙。子宮內膜異位症;盆腔炎等可造成盆腔黏連而導致卵泡不破裂無排卵,但內源性LH可促使卵泡細胞黃素化。有研究表明:卵巢手術后發生,主要與卵巢表面稀疏的膜樣黏連有關。此外,卵巢炎甚至亞臨床的卵巢炎也是造成卵巢被皮增厚而導致LUFS發生的局部因素。
3.酶或激酶不足或缺陷或前列腺素缺乏。酶的產生也是LH與FSH作用的結果,LH不足影響CAMP增加,從而使卵巢內纖維蛋白和纖溶酶原激活劑活性低下,可使排卵前卵泡細胞上的纖溶酶原活性降低,影響纖維蛋白的溶解和濾泡壁的自身作用。蛋白溶解酶也對卵泡破裂起作用,當這些酶缺乏即抑制卵泡排卵。
4.高PRL血症。PRL影響促性腺激素釋放激素(GnRH)的釋放,使血LH下降。飄L可改變E2對LH的正反饋調節作用。此外,PRL還可抑制卵巢分泌E2、P,並降低卵巢對GnRH的反應,使排卵不能發生。
5.藥物等外部因素作用。藥物促排卵或超促徘卵周期中,該綜合征的發生率明顯高過自然周期,表明在促排卵過程中卵泡的發育及成熟程度與自然周期不完全相同。如克羅米酚(CC)可使本綜合征明顯增加,據認為是CC等藥物可導致卵巢基質及卵泡黃體化所致。
6.精神心理因素。亦有人認為與精神心理因素有關,長期不孕婦女處於緊張和不斷的應激狀態中,造成血中催乳素水平反覆出現小峰值而影響排卵。
專家解釋:“假排卵”說通俗一點,就是每次月經周期中並沒有真正排卵,醫學上稱為“未破卵泡黃素化綜合征”。但是,很多人會不明白為什麼排卵也會有假的。的確,基礎體溫、宮頸黏液和經期排卵的間接監測指標的變化歸根到底是激素使然。就拿基礎體溫的周期性變化來說,它通常是婦女在排卵后黃體形成並分泌孕激素,後者作用於人體的體溫調節中樞,使體溫上升0.3~0.5攝氏度;至月經前1~2天或月經第一天,由於黃體萎縮,分泌孕激素減少,體溫又復下降,到下一次排卵時它又開始升高,周而復始。但這種基礎體溫的變化並不依賴於排卵,只要婦女能形成黃體並分泌孕激素,基礎體溫的變化就可以出現,所以它實質上只能反映黃體的情況。
同樣,子宮頸黏液的周期性變化也是激素作用的結果,如雌激素可以使宮頸黏液的分泌量增多,含水量增加,黏液絲的拉力增高;孕激素則使宮頸黏液的分泌量減少,變混濁、黏稠,黏液絲的拉力下降。月經周期之間出現的宮頸黏液性狀的改變,只能反映出激素水平的變化。前面已經講過孕激素是黃體分泌的,而雌激素是卵泡細胞分泌的,因此有宮頸黏液的周期性變化,只是說明有卵泡形成。
在醫院做一般檢查時,該類女性的基礎體溫、宮頸黏液和經期子宮內膜的變化均提示:排卵正常。但是,有卵泡形成,又有黃體形成,不一定有排卵。按一般的規律,先有排卵,之後黃體才能形成,但是有的婦女卵泡形成並成熟之後,並不出現排卵,而是直接過度到黃體形成期,之後的變化也與有排卵的婦女無異。鑒於整個過程是發生在有卵泡和黃體形成,只不過卵泡不能破裂排卵的情況下,所以這種現象在醫學上被稱作“未破卵泡黃素化綜合征”。當然,女性是不是患有這種疾病,還應在醫院做進一步檢查和監測。
卵泡未破裂黃素化往往無癥狀,亦無異常體征。因月經周期,月經期與自然周期(有排卵)相仿,基礎體溫曲線也呈雙相型,與有排卵月經的體溫曲線相似,唯有在超聲監測卵泡發育和排卵時或腹腔鏡檢查時方被發現。
卵泡未破裂黃素化的月經周期中的生殖激素的分泌波形圖與自然周期(有排卵)的分泌波形圖(ptofile)相仿。近年有研究發現LuF周期中,在基礎體溫上升後作腹腔鏡檢查的同日測血清和腹腔液的雌二醇和孕酮值,顯示無論有無雌二醇升高,但孕酮值均降低的現象,且發現有時黃體期較短。在10例LUF的研究中黃體中期的孕酮水平較低,且發現PRL,對TsH的反應過強,提示PRl2的分泌異常在卵泡黃素化的發生中起一定作用。有1例卵泡黃素化的研究報道,發現卵泡生長發育慢,顆粒細胞缺陷,卵泡周圍的血供較少,在LH峰狀分泌時無孕酮的升高;但在LH峰后孕酮分泌增加。認為此例LUF可能與顆粒細胞缺陷有關。
(一)臨床表現
1.不孕為常見的癥狀,且常誤認為是“原因不明”的不孕症。
2.可合併有盆腔子宮內膜異位症或者慢性盆腔炎(黏連)的表現。
3.月經周期和月經量常無異常。
4.偶有黃體期稍短或孕酮水平較低等表現,但無特異性。
5.臨床一般常用的監測排卵方法,如基礎體溫(BBT)、宮頸黏液(CMS)、孕酮測定:子宮內膜活檢等均提示為“排卵性”月經。
(二)特殊檢查
1.B超連續檢測。於圍排卵期第8~9天起。每日用陰道B超連續觀察 了解卵泡發育動態情況,若有優勢卵泡形成,達成熟卵泡標準(卵泡最大直徑>18mm晰透亮、邊界清楚等),而無排卵表現,即卵泡持續不消失或無明顯縮小(卵泡滯留型),或繼續增大(30~45mm,卵泡持續長大型),子宮直腸陷凹無遊離液出現,即可考慮為未破裂卵泡黃素化(LUF)周期。在B超監測周期中,應由專人專機檢查,以統一標準,避受將排卵后的囊性黃體誤認為LUF。
2.腹腔鏡檢查。對疑有未破裂卵泡黃素化時,行腹腔鏡檢查可進一步確診。一般認為在排卵后1.5天內排卵征依然存在,此後會逐漸封閉,於4~5天完全上皮化,排卵孔封閉。故於黃體早期(月經周期第20天前,BBT上升2~4天)用腹腔鏡直接觀察卵巢面,見有黃體但無排卵裂孔。
3.后穹窿穿刺液舀體激素測定成熟卵泡中含有大量雌,孕激素,卵泡破裂時釋放入盆腔,使腹腔液中雌、孕激素濃度明顯高於血液中濃度,通常孕激素可高達3倍以上。
因此,於黃體早期行后穹窿穿刺,抽取腹腔液,測其雌、孕激素濃度,與血中濃度比較,可推斷卵泡曾否破裂。
4.內分泌檢查 血LH峰值測定較正常低下或過早出現。
(一)診斷標準
連續B超檢查,卵泡增大至直徑18~24mm,已達成熟標準,72小時內仍不縮小。繼續增大,而BBT出現高溫相,宮頸教液顯示黃體期改變,血清孕酮(P)水平>3ng/yPo。即可診斷為LUFS。若卵泡未達成熟標準,而出現孕激素作用改變,則可診斷為多發性薯成熟卵泡黃素化(MILF)。較之前述成熟型LUF,此則為早熟型LUF。也可用腹腔鏡檢查結合其他臨床特徵做出診斷,但因為腹腔鏡操作較複雜,且帶有損傷性,故臨床一般較少採用。
(二)鑒別診斷
主要與正常排卵周期鑒別。並要注意鑒別有否盆腔內膜異位症、慢性盆腔炎(黏連)等合併症存在。
本綜合征除不孕(係為長期或“原因不明”不孕)外,往往無其他明顯自覺癥狀,故中醫應重在中西證病結合辨證。臨床見證以腎虛血瘀為主,每合併肝鬱氣滯、濕熱瘐阻或心肝火旺等證象。
因LUFS無特殊臨床表現,對已婚育婦女尤其是偶發LUF周期者多無異常影響,所以目前lUFS的治療主要是對不孕不育婦女而言。因LUFS的形成機制尚不十分明了,故我中心多針對其LH峰異常、PRL過高、PG缺乏、合併盆腔炎及子宮內膜異位等。採用相應藥物促排卵治療、手術治療及精神心理治療等。其中促排卵療法佔主導地位,促排卵藥物正確恰當地使用不僅是治療LUFS的關鍵,也是LUFS患者妊娠的基礎。
促排卵治療
在應用促排卵治療前,必須積極處理造成LUFS的局部機械性因素,如子宮內膜異位症、慢性盆腔炎、盆腔黏連等。
手術治療
1.卵泡穿刺治療。
2.腹腔鏡或剖腹手術治療。
精神心理治療
精神過度緊張、焦慮等可導致LUFS的發生,精神心理諮詢治療可有助於恢復正常排卵功能。
卵泡黃素化大多在不育症者作卵泡發育和排卵的系統監測中發現,而且並非每一個月經周期中都出現LUF,因此其防治問題,僅對不育症方具臨床意義。鑒於LUF並非每一周期均發生,作者認為連續2個月經周期均出現LUF再作治療較妥當。
對LUF的防治尚無成熟的經驗,療效亦欠理想。大多主張在超聲監測卵泡達成熟時,用HCG(10000—15000IU)激發排卵。有報道將卵泡黃素化分為兩種類型,成熟型和早熟型。當卵泡達成熟卵泡大小(平均徑18—24mm),且雌二醇>734pmol/L而孕酮<7.95nmol/L時為戒熟型。當卵泡未達成熟卵泡大小,孕酮>7.95nmol/L時為早熟型,對成熟型主張用HCG或:HCG與HMG同時注射以激發排卵,取得一定效果。對早熟型可用較大量的雌激素或GnRH—A抑制卵泡發育,繼而再用HMG誘發卵泡生長。對卵泡較小(未達成熟卵泡大小)黃素化者有主張用氯蔗酚胺或HMG促進卵泡發育,當卵泡成熟時再用HCG激發排卵。
卵泡黃素化的防治僅為不育者而為,因為卵泡黃素化並非一持續存在的疾病在用藥時並未能預測該周期一定會發生LUF,可見用藥后的目的是為了防止此周期又發生LuF而影響受孕。事實上用藥后發生排卵的話,可能為治療的效果,也可能為自然排卵,故LUF的療效更難確切地判斷。