氨解反應
生成胺類化合物的過程
氨解反應是指含各種不同官能團的有機化合物在胺化劑的作用下生成胺類化合物的過程。氨解反應包括鹵素的氨解、羰基化合物的氨解、羥基化合物的氨解、磺基及硝基的氨解和直接氨解。利用氨解反應可以製備多種脂肪胺和芳香胺等。
氨解反應是指含各種不同官能團的有機化合物在胺化劑的作用下生成胺類化合物的過程。
可氨解的基團:-X,-OH,,-CO-,Ar-H。
合成胺類化合物的方法:反應類型,還原、氨解,水解,加成和重排。芳胺的兩大製法,硝基還原(經濟、方便)和芳環鹵素氨解。
包括:鹵素的氨解、羥基化合物的氨解、羰基化合物的氨解、磺基及硝基的氨解和直接氨解。
親核取代反應:根據反應物的活潑性的差異,可分為非催化氨解和催化氨解
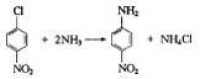
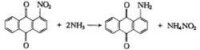
(1) 非催化氨解:對於活潑的鹵素衍生物,如芳環上含有硝基的鹵素衍生物,用氨水處理時,就可以使鹵素被氨基置換,氯的氨解反應屬雙分子親核置換反應,反應分兩步進行;速度決定步驟是氨對氯衍生物的加成。雖然不含磺基的芳香化合物在氨水中很難溶解,但大多數反應仍能在水相中進行,因為隨著溫度和氨濃度的提高,氯化物在氨水中的溶解度會增大。
(2) 催化氨解:對於活性較差的鹵化物,如氯苯、1-氯萘-4-磺酸等,在沒有銅催化劑存在時,在,加壓下與氨不會發生反應,但在銅催化劑存在時,,便反應生成相應的芳胺。
第一步:催化劑和氯化物生成加成產物,即生成一正離子絡合物,是反應速度決定步驟。
第二步:正離子絡合物提高了氯的活潑性,很快與氨、氫氧離子或芳胺按下列方程反應
(1)非催化氨解:反應屬於歷程,雙分子親核取代反應,首先是帶有未共用電子對的氨分子向芳環與氯相連的碳原子發生親核進攻,得到帶有極性的中間加成物,此加成物迅速轉化為銨鹽,並恢復環的芳香性,最後脫掉質子,得到產物,第一步氨基衍生物的生成是決速步驟。
例如,鄰或對硝基氯苯與氨水溶液加熱時,氯被氨基置換反應按 下式進行:
氨解反應
首先,氨分子中帶有未共用電子對的氮原子向芳環上與氯相連的碳原子發生親核進攻,得到帶有極性的中間加成物;然後,加成物迅速轉化為銨鹽,並恢復環的芳香性,再與一分子氨反應,失去即得到反應產物。
動力學方程式:’
式中c’為對硝基氯苯的濃度,當大大過量時,為假一級反應。
反應歷程的證明:通過一系列具有不同離去基團的鹵素衍生物與同一親核試劑反應反應的速度相比,當X為F、Cl、Br、I時,反應相對速率為:3300,4.3,4.3,1.0。證明鍵的斷裂對反應速率沒有影響,否則鍵的斷裂為決速步驟,的鍵最弱,反應速率為。脂肪族取代屬於這種情況。
(2)催化氨解
氨解反應
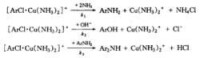
氨解反應
研究發現:反應速度與銅催化劑及芳香氯化物的濃度成正比,與氨水的濃度無關。銅氨離子與芳香氯化物形成正離子絡合物是反應速度的控制階段。正離子絡合物很快與氨、氫氧根離子或芳胺反應,分別得到主產物芳胺、副常委酚和二芳胺。主、副產物之比決定於氨,氫氧離子和芳胺的比例,氨濃度增加,可以減少酚和二芳胺的生成。
(1) 鹵化物性質
A 取代基的影響。鹵化物上已有的取代基對反應速率有很大的影響,含有強吸電基團,反應活性增加,含有給電子基團,反應活性下降。
B 鹵素(離去基團)活性。不同鹵素的氨解反應速率有較大的差異。
(2) 攪拌(與溶解度):在液相氨解反應中,反應速率和攪拌效果有很密切的關係。在無攪拌時,相對密度較大的不溶性有機底物沉積在反應器底部,反應將在兩相界面發生。對於間歇反應設備,要求安裝有效的攪拌裝置;對於連續反應設備,要控制流速使反應物料形成湍流狀態。
(3) 氨水濃度與用量:對於液相氨解反應,氨水使應用量大和應用範圍最廣的胺化劑,因此使用氨水時其濃度和用量是重要的影響因素。有機物和氨的摩爾比稱為氨比,理論氨比是2,實際氨的用量遠大於此比值。間歇氨基化時,氨比時6~15,連續氨基化時月為10~17。過量的氨水可提高氯化物的溶解度,改善反應物料的流動性。降低副產物的腐蝕性。但用量過大,增加氨的回收負荷,降低設備的生成能力。
氨水的濃度增加,可提高氯化物在氨水中的溶解度,加快反應速度。但是受氨的溶解度的限制,配置高濃度的氨水比較困難,因此向反應器中沖入液氨來提高氨的濃度。在相同的溫度下,蒸汽壓和氨的濃度成正比,對設備的耐壓能力提出更高的要求。
(4) 溫度:提高溫度可增加反應物在氨水中的溶解度,加快反應速度。隨著反應深度的增大,溶液的pH值降低,腐蝕性增強;如果溫度過高,副反應增加,壓力提高,甚至出現焦化現象。所以,一般地,間歇氨解反應溫度小於175~190℃,用碳鋼設備;連續氨解反應,用優質不鏽鋼設備,溫度小於240℃。
(5)芳環上帶有吸電子基團時反應容易得多,這時氟的取代速度遠遠超過氯和溴,反應的活潑順序是。這是因為親核試劑加成形成σ絡合物是反應速度的控制階段,氟的電負性最強,最容易形成σ絡合物。
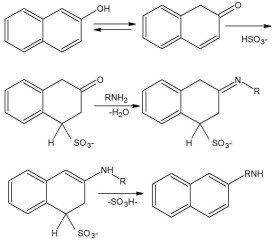
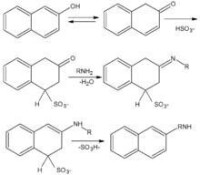
對於某些胺類,如果通過硝基的還原或其他方法來製備並不經濟,而相應的羥基化合物卻有充分供應時,則羥基化合物的氨解過程就有重要意義。
如布赫爾(Bucherer)反應:萘系羥基衍生物在酸式亞硫酸鹽存在下轉變為氨基衍生物的反應。
氨解反應
氨解反應
機理如下:
氨解反應
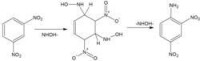
1-萘酚和2-萘酚中的羥基都能在酸式亞硫酸鹽存在下置換成氨基,但它們的磺基衍生物並非都能順利地進行這類反應。其規律為:
①當羥基處於1位時,2位或3位的磺基對氨解反應起阻礙作用,若在4位上存在磺基,則反應容易進行。
②當羥基處於2位時,3位或4位的磺基對氨解起阻礙作用,而1位的磺基則起促進作用。
③當羥基與磺基不處同一環時,磺基的影響很小。
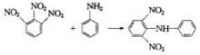
氨解反應
磺基的氨解也屬於親核置換反應。磺基被氨基置換隻限於蒽醌系列,蒽醌環上的磺基由於受到羰基的活化作用,容易被氨基置換。其歷程如下:
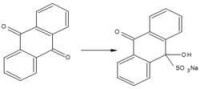
氨解反應
羥基化合物的氨解主要是指含有羥基的酚類、醇類及蒽醌系羥基化物的氨解反應。主要用於那些通過硝基還原或其他方法製備胺類不經濟,而相應的羥基化合物原料便宜,來源廣泛的胺類化合物的製備。
醇類的氨解是製備低級脂肪胺的常用方法。根據催化劑可以分為兩類:
(1) 在脫水催化劑存在下的氨解
反應:
工藝條件:氣相反應350~500℃,1~15MPa下,催化劑。
產物:伯,仲,叔胺的混合物,採用連續精餾分離產物。
(2) 在脫氫催化劑存在下的氨解
催化劑:載體型Ni、Co、Cu、Fe、Pt、Pd,活化催化劑。
工藝條件:氣相反應100~200℃,0.5~20MPa。
產物:伯,仲,叔胺的混合物,採用連續精餾分離產物。
(3) 生成實例:甲醇的氨解
一甲胺:制高效低毒的殺蟲劑,如: 。二甲胺:制二甲基甲醯胺,
三種胺的沸點非常接近,需要四個連續精餾塔才能達到分離的目的。
工藝條件:溫度50~60℃,液相氨解,1~2 MPa,控制條件,可以使以某種產物為主。
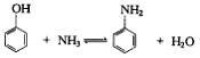
氨解反應
氨解反應
(2)苯酚的氨解:常壓,迴流
工藝流程:氣相催化氨解,固定床絕熱反應器,催化劑為硅酸鋁。工藝條件:溫度385℃,壓力1.5 MPa。優點:設備投資費用低,為硝基苯法的1/4,催化劑的活性高,壽命長,三廢少。
(3) 用芳胺氨解:橡膠防老劑
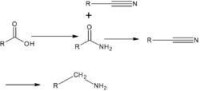
當醛和氨發生反應時,包括了生成的a-羥基氨的過程(親核加成)及a-羥基氨脫水生成烯胺,並進一步氫化的過程,見下式:
氨解反應
從乙醛製備乙胺獲得伯胺、叔胺副產物,生成的二乙胺收率按乙醛投料量計為90%~95%。如果用大大過量的氨,便可由乙醛製備乙胺:
氨解反應
反應歷程:醯胺首先經溴取代生成N-溴代醯胺,由於溴的吸電子性和醯基的作用,是亞胺基上氫原子的酸性增強,在強鹼的作用下失去一個質子,形成不穩定的溴代醯胺陰離子,易脫去溴離子生成具有高度活性的醯基氮賓。隨後R基帶著一對電子作親核重排,遷移到帶正電荷的氮原子上,生成異氰酸酯。異氰酸酯發生水解反應,水與羰基加成,氫轉移,然後脫羧生成伯胺。反應速率和R的性質有關,R基的給電性強,反應速率加快。
特點:過程複雜,操作簡單,中間產物無需分離,產率高,純度高。
通常磺酸基氨解只限於蒽醌系列。磺酸基氨解的一個重要用途是將α-蒽醌磺酸氨解製成α-氨基蒽醌。由這條路線得到的產品質量高,但是在製備α-蒽醌磺酸時,需加入有毒的汞催化劑定位,這條路線已被 硝化—還原或硝化—氨解路線所替代。
較有實際意義的是由2,6-蒽醌二磺酸胺解製備2,6-二氨基蒽醌。其反應式如下:
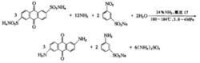
氨解反應
氨解反應
值得注意的是,在氨解過程中如果大量聚積,乾燥時會有爆炸危險。採用過量較多的氨水使 溶在氨水中,出料后再用水沖洗反應器,可防止事故發生。
按一般方法,要在芳環上引入氨基,通常先引入-Cl、、等吸電子取代基,以降低芳環的鹼性,然後,再進行親核置換成氨基。從實用的觀點看,如能對芳環上的氫直接進行親核置換引入氨基,就可大大簡化工藝過程,因而是特別引人注目的。
要使該反應實現:
首先:芳環上應存在吸電子取代基,以降低芳環鹼性;
其次:要有氧化劑或電子受體參加,以便在反應中幫助Hˉ脫去。
應該指出,這種方法還處於探索性的研究階段。比較重要的直接氨化反應是以羥胺為反應劑和以氨基鈉為反應劑的方法。
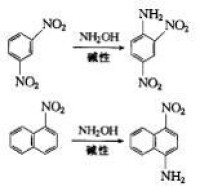
在鹼性介質中,苯系化合物中至少含有兩個硝基,萘系化合物中至少含有異構硝基時,可發生親核取代反應生成伯胺。這是最重要的直接氨解法,胺化劑有、。
氨解反應
氨解反應
工業上利用該方法製取胺類,如2-氨基吡啶和2,6-氨基吡啶,該反應稱為Chichibabin反應,已經工業化。
苯與氨直接氨基化可得到苯胺,此法苯的轉化率低,催化劑的壽命短,尚未工業化。
芳香性的胺類有一定的致癌作用,因此在使用時要小心。並不是所有的芳香性的胺類都有致癌活性,環上的取代基的位置不同,致癌活性不同,有一定的規律性。掌握了這些規律性對於我們今後的工作和研究有很大的幫助。
(1) 氨基位於萘的2位和聯苯對位的化合物,均有強的致癌活性。(2) 氨基位於萘的1位和聯苯間位的化合物,均有弱的致癌活性。(3) 氨基位於聯苯鄰位的化合物似乎沒有致癌活性。(4) 芳環中氨基的對位或鄰位被甲基、甲氧基、氟或氯原子取代的化合物的致癌活性增強。
氨解反應
苯胺是最簡單的芳伯胺。據粗略統計,大約有300種化工產品和中間體是經由苯胺製得的。芳胺的工業合成路線主要是硝基化合物還原和鹵化物或羥基化合物氨解,只有少部分品種採取其它合成途徑。
(1)鄰和對硝基苯胺的製備
氨解反應
(2)2-氨基蒽醌的製備
2-氨基蒽醌是生產藍色還原染料的重要中間體,由2-氯蒽醌氨解製成。其反應式如下:
氨解反應
氨解反應