腦膠質瘤
腦角質瘤
腦腫瘤中膠質細胞瘤發病率最高,約佔40.49%,綜合發病年齡高峰在30-40歲,或10-20歲。大腦半球發生的膠質瘤約佔全部膠質瘤的51.4%,以星形細胞瘤為最多,其次是膠質細胞瘤和少枝膠質細胞瘤,腦室系統也是膠質瘤較多的發生部位,占膠質瘤總數的23.9%,主要為管膜瘤,髓母細胞瘤,星形細胞瘤,小腦膠質瘤占膠質瘤總數的13%,主要為星形細胞瘤。
腦膠質瘤是由於大腦和脊髓膠質細胞癌變所產生的、最常見的原發性顱腦腫瘤。年發病率約為3-8人/10萬人口。如同其他腫瘤(疾病)一樣,膠質瘤也是由於先天的遺傳高危因素和環境的致癌因素相互作用所導致的。一些已知的遺傳疾病,例如神經纖維瘤病(I型)以及結核性硬化疾病等,為腦膠質瘤的遺傳易感因素。
腦角質瘤
本次醫藥界的盛會探討了腦膠質瘤的最新發展和治療方案,研討了蒂清在國內外應用的現狀,並深入彙報了蒂清的臨床試驗成果。為蒂清的使用療效及臨床應用的交流開闢一個具有專業深度的平台,為中國抗腫瘤藥物的研究提供更多的論證依據,為廣大醫務工作者帶來新的治療武器,更為被病魔所困擾的廣大患者提供更新、更加有效的治療藥品和更加優秀的治療方案,解除廣大患者的痛苦。與會專家指出,蒂清的問世是中國癌症治療領域的重大突破,更是廣大腦瘤患者福音,必將推動中國癌症治療領域研發的進程,使其達到國際先進水平
本品為硬膠囊劑,內容物為白色粉末。
多形性膠質母細胞瘤或間變性星形細胞瘤。
用法用量本葯每一療程28天,最初劑量為按體表面積口服一次150mg/㎡,一日1次,在28天為一治療周期內連續服用5天。如果治療周期內,第22天與第29天(下一周期的第一天)測得的絕對中性粒細胞數(ANC)≥1.5×109/L,血小板數為≥100×109/L時,下一周期劑量為按體表面積口服一次200mg/㎡,一日1次,在28天的治療周期內連續服用5天。在治療期間,第22天(首次給葯后的21天)或其後48小時內檢測病人的全血數。在任意治療周期內,如果測得的絕對中性粒細胞數(ANC)<1.0×109/L或者血小板數<50×109/L時,下一周期的劑量將減少50mg/㎡,但不得低於最低推薦劑量100mg/㎡。
對本品及輔料過敏者禁用。由於蒂清與達卡巴嗪均代謝為MTIC,對達卡巴嗪過敏者禁用。
注意事項有可能出現骨髓抑制,給葯前患者必須進行絕對中性粒細胞及血小板數檢查。在治療第22天(首次給葯后的21天)或其後48小時內檢測病人的全血數,之後每星期測定一次,直到測得的絕對中性粒細胞數(ANC)≥1.5×109/L,血小板數≥100×109/L時,再進行下一周期的治療。肝、腎機能損傷病人慎用本品。
蒂清影響睾丸的功能,男性病人應採取避孕措施。
女性病人在接受蒂清治療時應避免懷孕。
1)膠質瘤不會轉移
2)膠質瘤極易複發,原因是腫瘤和正常腦組織邊界不清,手術時難以完全切除
3)淋巴結腫大說明有炎症,應去醫院檢查
4)如果腫瘤複發,可以考慮再次手術
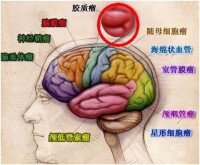
腦膠質瘤根據腫瘤細胞的形態學、腫瘤細胞的惡性程度以及腫瘤所處的部位進行分類。
按腫瘤細胞的形態學劃分
腦膠質瘤根據其腫瘤細胞形態學與正常腦膠質細胞的相似程度(並不一定是其真正的細胞起源),進行如下主要分類:
星型細胞瘤—星形細胞
少枝細胞瘤—少枝細胞
混合膠質瘤,例如少枝--星形細胞瘤,包含了混雜類型的膠質細胞
室管膜瘤—室管膜細胞
按腫瘤細胞的惡性程度劃分
腦膠質瘤按腫瘤細胞在病理學上的惡性程度,可以進一步分類。
低級別膠質瘤(WHO1-2級),為分化良好的膠質瘤;雖然這類腫瘤在生物上並不屬於良性腫瘤,但是患者的預后相對而言,還是不錯。
高級別膠質瘤(WHO3-4級),為低分化膠質瘤;這類腫瘤為惡性腫瘤,患者生存較差預后。
目前雖然有很多關於膠質瘤的分級系統,但是最為常用的還是世界衛生組織(WHO)制定的分級系統。根據這一分級系統,腦膠質瘤分為1級(惡性程度最低、預后最好)到4級(惡性程度最高、預后最差)。其中,傳統細胞病理學所謂的間變膠質瘤與WHO的3級相對應;膠質母細胞瘤與WHO的4級相對應。
按腫瘤所處的位置劃分
腦膠質瘤可以根據其在大腦所處的位置,進行分類。小腦幕(一層包裹小腦的結締組織)將腦組織分為幕上和幕下區域。據此,腦膠質瘤也分為幕上膠質瘤和幕下膠質瘤。
幕上膠質瘤:位於小腦幕上,主要是大腦半球,為成人最常見腦膠質瘤(70%)。
幕下膠質瘤:位於小腦幕下,主要是小腦半球,為兒童最常見腦膠質瘤(70%)。
有這些疾病的患者,其腦膠質瘤的發生機會,要比普通人群高很多。此外,一些環境的致癌因素也可能與膠質瘤的發生相關。有研究表明,電磁輻射,例如手機的使用,可能與膠質瘤的產生相關。但是,目前並沒有證據表明,這兩者之間存在必然的因果關係。雖然大部分的膠質母細胞瘤患者都曾有巨噬細胞病毒感染,並且在絕大部分的膠質母細胞瘤病理標本都發現有巨噬細胞病毒感染的證據,但是,這兩者間是否存在因果關係詞,目前也不是十分清楚。
從病理髮生學(pathogenesis)角度而言,膠質瘤是在內部遺傳易感因素與外部環境致病因素相互作用下,在細胞的遺傳物質(DNA)及表觀遺傳物質(epi-genetics)水平,發生了足以致癌的突變(以及突變的組合);這些突變,驅動細胞持續地進入細胞周期進行有絲分裂、逃避凋亡、躲避細胞的生長接觸抑制、躲避免疫抑制等,並使細胞獲得與持續增長相適應的能量代謝異常、誘導腫瘤新生血管生長、缺氧與壞死等改變。
與不同級別膠質瘤的臨床與細胞病理表現所相對應的分子改變也有所不同。例如,低級別膠質瘤主要表現為細胞低速的分裂增生;而高級別膠質瘤則表現為高速的細胞分裂增生以及伴隨的新生血管生成以及腫瘤的缺氧、壞死。與之相應的,低級別膠質瘤在分子水平往往無HIF-1及VEGF等分子通道的啟動與高表達。值得注意的是,大腦雖然被認為是一個在正常生理狀態下,細胞幾乎不發生分裂增生(turning over)的器官,但是在特定時期和條件,大腦中樞器官還是會有一定的細胞分裂。例如,在兒童期,有神經元的分裂。因此,在兒童期,神經元來源的腫瘤,如髓母細胞瘤,發病率比成年高。但是,這並不意味著,有細胞分裂的發生,就有腫瘤癌變的可能。因為,在絕大部分情況下,細胞增生過程中發生的突變(spontaneous mutation),都可以被細胞分子“維穩”功能所修正;如若無法修正,則細胞會啟動凋亡途徑,使發生突變的細胞自發死亡。可見,膠質瘤的發生是個小概率的偶然事件。低級別膠質瘤在細胞增生過程中,可能會“蓄積”新的突變,從而使其向高級別膠質瘤轉變(惡變)。為了系統地了解膠質瘤的分子病因學,美國在2008年啟動了膠質瘤的分子基因圖譜工程(cancer molecular atlas)。通過對膠質瘤的DNA進行測序,發現平均每個膠質母細胞瘤,有高達5個分子突變。其中,NF基因是最常見發生突變的抑癌基因;EGFR是最常見的原癌基因。這些分子突變,驅動各種信號通道的表達並構成膠質瘤發生、發展的分子基礎。
腦膠質瘤對腦組織的影響,主要是由於腫瘤對周圍組織的擠壓以及腫瘤細胞的分泌作用所導致的。例如腫瘤所導致的水腫,一方面,可以由於腫瘤的佔位效應阻礙血液的迴流從而使靜脈壓升高、水分子從血管內向組織間隙蓄積;另一方面,可以由於膠質瘤細胞分泌的一些因子,如血管內皮細胞生長因子(VEGF,又稱血管滲透因子,vascular permeability factor, VPF),從而使血腦屏障開放、水分子從血管腔隙向組織間隙轉移。癲癇是腦膠質瘤患者最常見的癥狀之一。研究表明,膠質細胞能夠表達絕大部分參與電衝動的神經遞質以及受體;並且,膠質細胞與神經電衝動的發生、傳遞、擴布以及調節,緊密相關。這些,也即構成膠質瘤導致癲癇發作的分子病理基礎。
腦膠質瘤所導致的癥狀和體征,主要取決其佔位效應以及所影響的腦區功能。膠質瘤由於其在空間的“佔位”效應(mass effect),可以使患者產生頭痛、噁心及嘔吐、癲癇、視物模糊等癥狀。此外,由於其對局部腦組織功能的影響,還可以使患者產生其他的癥狀。比如,視神經膠質瘤可以導致患者視覺的喪失;脊髓膠質瘤可以使患者產生肢體的疼痛、麻木以及力弱等癥狀;中央區膠質瘤可以引起患者運動與感覺的障礙;語言區膠質瘤可以引起患者語言表達和理解的困難。膠質瘤由於惡性程度不同,其所產生癥狀的速度也不同。例如,低級別膠質瘤患者的病史往往在幾個月甚至上年,而高級別膠質瘤患者的病史往往在幾個星期至幾個月。根據患者的病史、癥狀以及體征,可以初步推斷出病變的部位以及惡性程度。但是最終的定位、定性診斷,還要綜合考慮其他的檢查,包括磁共振以及最終的診斷標準--病理診斷。
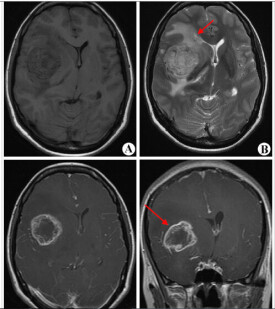
膠質瘤的診斷,要綜合考慮患者的病史、癥狀、體征、輔助檢查以及術后病理等進行綜合考慮和判斷。患者有臨床癥狀表現后,就診時最常做的檢查包括頭顱CT與磁共振(MRI)。頭顱CT可以初步判定是否有顱內佔位。膠質瘤在CT上,往往表現為腦內、低信號的病變;低級別膠質瘤一般無瘤周水腫,高級別膠質瘤往往伴有瘤周水腫。此外,CT在發現是否有腫瘤出血以及鈣化,優於磁共振。瘤卒中發生的出血,在CT上表現為高信號,提示腫瘤的惡性程度較高。腫瘤伴有鈣化的發生,提示腫瘤的病理類型為少枝的可能性大。磁共振在顯示腫瘤的部位、性質等方面,要優於CT檢查。低級別膠質瘤在磁共振上往往表現為T1低信號、T2高信號的腦內病變,主要位於白質內,與周圍腦組織在影像上往往存在較為清晰的邊界,瘤周水腫往往較輕,病變一般不強化。高級別膠質瘤一般信號不均一,T1低信號、T2高信號;但如有出血存在,則T1有時也有高信號的存在;腫瘤往往有明顯的不均一強化;腫瘤與周圍腦組織界限不清;瘤周水腫較為嚴重。有時,膠質瘤與其他的病變,例如炎症、缺血等,不是很容易區分。因此,有可能需要做其他的檢查,包括PET、MRS等檢查,進一步了解病變的糖代謝及其他分子代謝情況,從而進行鑒別診斷的區分。此外,有時為了明確病變與周圍腦組織功能的關係,還要進行所謂的功能磁共振檢查(fMRI)。通過這些檢查,一般可以在手術前,對膠質瘤的部位以及惡性程度級別,有個初步的臨床判斷。但是,最終的診斷,要依賴於手術后的病理診斷。
重視第一次打擊
按傳統的綜合治療,多數患者接受外科手術後會出現兩種結局:一是術后重要的神經功能缺失,如偏癱、失語和視丘下部損害;二是手術的刺激會造成腫瘤惡性程度增高,實際上縮短了病人生存期。接診的神經外科醫師在沒有把握從根本上控制腫瘤增殖或治癒腫瘤的情況下,貿然手術切除實際是亂捅“馬蜂窩”,後果是造成複發后腫瘤浸潤範圍廣泛、瘤細胞惡性程度增高。因此腦膠質瘤的第一次治療方案應慎之又慎,不能貿然手術切除。我們根據丘腦或基底節區星形細胞瘤區域多數腫瘤生長緩慢、分化程度較高,可以長時間(5年之內)生存的特點,設計立體定向輔助下腫瘤131I組織間液放療,能取得良好治療效果。
強調患者的個體化治療
我們根據患者全身情況、年齡、腫瘤部位、性質和特點將膠質瘤分為7個治療類型:大腦半球、小腦半球、腦幹、囊性、腦深部、幕上低級別和小兒的膠質瘤。又分別採取7種新綜合治療方法:即術后瘤內間質化療、術后瘤內近距離放療、術后經腦動脈介入化療、非高顱壓狀態下單純經腦動脈介入化療、免疫導向放療、瘤組織間液放療、外周血造血幹細胞支持下的大劑量化療等7項新技術。精心擬定39種組合治療方案進行個體化治療,改變了腦膠質瘤傳統治療的弊端。
局部治療原則已推廣
膠質瘤最主要的生物學特性是腦組織的終位性增殖。我們課題組吸取國外先進的治療理念與方法,針對膠質瘤終位性特點和不斷增殖的現實,設計的7種化療和放療方法操作簡便,重複給藥方便,生物相容性好,全身毒副作用輕微,臨床療效好。1991年以來經全國20多家軍隊和地方三甲醫院神經外科推廣應用,累計完成新綜合治療腦膠質瘤2296例,臨床治癒率(生存期超過3年)25.47%,影像學治癒率16%,患者生存期明顯延長。
提倡小體積腫瘤的帶瘤生存
不少患者是在健康查體中意外發現體積較小、部位深在、沒有臨床癥狀的早期腦腫瘤。另外,對一些膠質瘤細胞分化較好、顱內佔位效應不明顯的患者,理想的治療方案應優先選擇應用微創、立體定向輔助治療,或採取不開顱手術的經腦動脈介入化療等方法。
病理學圖像表明,膠質瘤的瘤中心和亞臨床區存在一道由淋巴細胞形成的“瘤柵”,在一定程度上限制了膠質瘤細胞的增殖速度和浸潤範圍。腫瘤的增殖能力在破壞“瘤柵”的完整性,而腦內防禦細胞群又在努力構築“瘤柵”的完整性。這一對矛盾隨時都在發生著,不合理的外科手術儘管短期內減少了腫瘤數量,改善了人體荷瘤癥狀,但手術治療對腫瘤的增殖促進是公認的事實。一些重要部位和功能區的低級別膠質瘤、位置深在的小體積膠質瘤,完全可以在不破壞“瘤柵”完整性的情況下,允許患者帶瘤生存並保障良好的生命質量,這是提出的治療新概念。
開展精確制導放射治療
上世紀90年代,單克隆抗體曾作為免疫治療載體進行腫瘤治療。課題組與國外科研機構合作,於2002年率先開展了嵌合體型抗核抗體標載的131I對腦膠質瘤進行免疫導向放療,巧妙利用了抗核抗體與腫瘤細胞壞死組織高親和力的特點,將其標載的131I運載到瘤體中心壞死區域,與生長過快而崩解的瘤細胞結合,無選擇地殺傷壞死區域附近增殖活躍的膠質瘤細胞,達到抑制或治癒膠質瘤的療效。本項新技術可以十分恰當地形容為“精確制導的導彈攜帶核彈頭,對鎖定區域進行核打擊。”自2002年5月至2005年1月,課題組共完成56例,其中影像學治癒3例,臨床治癒6例,生存期超過1年的52例,無效4例,探索出一種療效確實、毒副作用輕微的新技術。目前有12家醫院協作開展免疫導向放療2期臨床研究,已將本技術作為標準臨床研究方法。
目前對於膠質瘤的治療,包括手術、放療、化療、靶向治療等手段。具體的治療,要綜合考慮患者的功能狀態、對治療的預期結果以及腫瘤所處的腦區部位、惡性程度級別等多種因素,進行綜合考慮判斷,從而制定個體化綜合治療方案。
手術
手術往往是膠質瘤治療的第一步。手術不僅可以提供最終的病理診斷,而且可以迅速去除大部分的腫瘤細胞,緩解患者癥狀,並為下一步的其他治療提供便利。對於一些低級別膠質瘤,如毛細胞星形細胞瘤,手術的完整切除,是可以使患者得到根治以及長期存活。目前的膠質瘤手術,已經進入了一個微創時代,與前相比,更為安全,創傷更為小,腫瘤切除更為完全。顯微鏡應用於腦膠質瘤的切除,可以更加清晰地辨別腫瘤與腦組織的邊界,以及周圍重要的神經血管等結構,從而能夠在安全的情況下,最大化地切除膠質瘤。神經導航的應用,將膠質瘤的手術切除,提高到新的高度。神經導航與汽車導航相類似,可以使外科醫生在手術前從切口的設計、術中功能腦區的辨認以及手術切除方式的選擇等方面,更加精確和細化。近年來出現的術中磁共振,可以進一步提高手術完整切除的完整程度,並減少患者術后功能缺陷等併發症的產生。術中皮層刺激電極的應用,可以完善術中對於運動區、語言區的辨認,從而幫助外科醫生更好地保護腦的重要功能。
放療
在接受外科手術治療后,對於高級別膠質瘤患者,往往需要進一步的放療。對於低級別膠質瘤患者,若存在高危因素(例如腫瘤體積超過6厘米、手術切除不完全等因素),也要考慮進行放療。放療包括局部的放療和立體定向放療。對於首次發現的膠質瘤,一般不採用立體定向放療。局部放療根據所採用技術不同,又可以分為適形調強放療和三維塑形放療。對於複發膠質瘤患者,特別是處於功能區腫瘤,有時可以考慮進行立體定向放療。
化療
化療及靶向治療在膠質瘤的治療中,逐漸發揮重要作用。對於高級別膠質瘤,替莫唑胺的應用,可以顯著延長患者的生存預后。目前,替莫唑胺是治療膠質瘤唯一有明確療效的化療藥物。對於初治高級別膠質瘤患者,替莫唑胺在與放療同時應用后(同步放化療階段),還應繼續單獨服用一段時間(6-12周期)。其他的化療藥物(如尼莫司丁),對於複發膠質瘤的治療,可能有一定療效。新近出現的血管靶向藥物,阿伐斯丁,對於複發高級別膠質瘤,有明確療效,可以顯著延長患者的生存期。最近大規模三期研究的中期分析表明,對於初治高級別膠質瘤患者,阿伐斯丁與放療、替莫唑胺的聯用,可以顯著提高患者的無進展生存期,並有望成為標準治療方案之一。
腫瘤電場治療
腫瘤電場治療是一種全新的腫瘤治療技術,通過低強度、中頻(200 kHz)交變電場,作用於增殖癌細胞的微管蛋白,干擾腫瘤細胞有絲分裂,使受影響的癌細胞凋亡並抑制腫瘤生長。2018年腫瘤電場治療被納入衛健委首部《腦膠質瘤診療規範(2018年版)》,並被推薦用於治療新發GBM(1級證據)和複發高級別腦膠質瘤(2級證據)。最新版NCCN指南將“同步放化療+TMZ+電場治療”作為膠質母細胞瘤 1類推薦。
其他
其他的一些免疫治療和生物治療,尚處於臨床試驗階段,其療效有待進一步明確。從一些研究來看,也是富有前景,並有望為膠質瘤患者的治療,開闢新的途徑。
經過綜合治療后,對於低級別膠質瘤(WHO 1-2級)患者而言,中位生存期在8-10年之間;對於間變膠質瘤(WHO 3級)患者而言,中位生存期在3-4年之間;對於膠質母細胞瘤(WHO 4級)患者而言,中位生存期在14.6—17個月之間。值得注意的是,對於膠質母細胞瘤患者而言,新出現的放療與替莫唑胺化療方案,可以使將近10%患者存活至5年以上;而在替莫唑胺出現之前,單獨使用放療,僅有不足1%的患者可以存在5年。
膠質瘤很難根治,往往會複發。在腫瘤複發后,根據患者的功能狀況,可以考慮再次手術、放療、化療等治療。