DNA損傷修復
DNA損傷修復
DNA損傷修復是在細胞中多種酶的共同作用下,使DNA受到損傷的結構大部分得以恢復,降低了突變率,保持了DNA分子的相對穩定性。
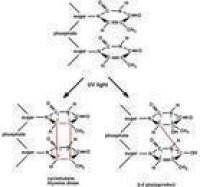
(圖)DNA損傷修復
1949年A.凱爾納偶然發現灰色鏈絲菌等微生物經紫外線(UV)照射后如果立即暴露在可見光下則可減少死亡。此後在大量的微生物實驗中都發現了這種現象,並證明這是許多種微生物固有的DNA損傷修復功能,並把這一修復功能稱為光復活。1958年R.L.希爾證明即使不經可見光的照射,大腸桿菌也能修復它的由紫外線所造成的DNA損傷,而後又證明其他微生物也有這種功能,當時就把這種修復功能稱為暗復活或暗修復。此後發現暗修復普遍地存在於原核生物、低等真核生物、高等真核生物的兩棲類乃至哺乳動物中,並證實暗修復包括切除修復和複製后修復兩種。1968年美國學者J.E.克利弗首先發現人類中的常染色體隱性遺傳的光化癌變疾病──著色性干皮病(XP)是由基因突變造成的 DNA損傷切除修復功能的缺陷引起的。這一發現為惡性腫瘤的發生機理提供了一個重要的分子生物學證據,也使DNA損傷修復的研究進入了醫學領域。
DNA分子的損傷類型有多種。UV照射后DNA分子上的兩個相鄰的胸腺嘧啶 (T)或胞嘧啶(C)之間可以共價鍵連結形成環丁醯環,這種環式結構稱為二聚體。胸腺嘧啶二聚體的形成是 UV對DNA分子的主要損傷方式。
絲裂黴素C可造成DNA分子單鏈間的交聯,這種情況常發生在兩個單鏈的對角的鳥嘌呤之間。鏈的交聯也往往帶來DNA分子的斷裂。
DNA分子還可以發生個別鹼基或核苷酸的變化。例如鹼基結構類似物5-溴尿嘧啶等可以取代個別鹼基,亞硝酸能引起鹼基的氧化脫氨反應,原黃素(普魯黃)等吖啶類染料和甲基氨基偶氮苯等芳香胺致癌物可以造成個別核苷酸對的增加或減少而引起移碼突變(見基因突變)。
一種 DNA損傷劑往往可以同時引起幾種類型的損傷,其損傷效應的大小和類型與劑量及細胞所處的周期狀態有關。
光復活又稱光逆轉。這是在可見光(波長3000~6000埃)照射下由光復活酶識別並作用於二聚體,利用光所提供的能量使環丁醯環打開而完成的修復過程。光復活酶已在細菌、酵母菌、原生動物、藻類、蛙、鳥類、哺乳動物中的有袋類和高等哺乳類及人類的淋巴細胞和皮膚成纖維細胞中發現。這種修復功能雖然普遍存在,但主要是低等生物的一種修復方式,隨著生物的進化,它所起的作用也隨之削弱。
切除修復
又稱切補修復。最初在大腸桿菌中發現,包括一系列複雜的酶促DNA修補複製過程,主要有以下幾個階段:核酸內切酶識別DNA損傷部位,並在5'端作一切口,再在外切酶的作用下從5'端到3'端方向切除損傷;然後在 DNA多聚酶的作用下以損傷處相對應的互補鏈為模板合成新的 DNA單鏈片斷以填補切除后留下的空隙;最後再在連接酶的作用下將新合成的單鏈片斷與原有的單鏈以磷酸二酯鏈相接而完成修復過程。
切除修復並不限於修復嘧啶二聚體,也可以修復化學物等引起的其他類型的損傷。從切除的對象來看,切除修復又可以分為鹼基切除修復和核苷酸切除修復兩類。鹼基切除修復是先由糖基酶識別和去除損傷的鹼基,在DNA單鏈上形成無嘌呤或無嘧啶的空位,這種空缺的鹼基位置可以通過兩個途徑來填補:一是在插入酶的作用下以正確的鹼基插入到空缺的位置上;二是在核酸內切酶的催化下在空位的5'端切開DNA鏈,從而觸發上述一系列切除修復過程。對於各種不同類型的鹼基損傷都有特異的糖基酶加以識別。不同的核酸內切酶對於不同類型損傷的識別也具有相對的特異性。
切除修復功能廣泛存在於原核生物和真核生物中,也是人類的主要修復方式,嚙齒動物 (如倉鼠、小鼠)先天缺乏切除修復的功能。
1978年美國學者 J.L.馬克斯發現真核生物與原核生物間由於染色質結構不同, 切除修復的過程也不相同。真核生物的DNA分子不象原核生物那樣是裸露的,而是纏繞在組蛋白上形成串珠狀的核小體結構。真核生物中的嘧啶二聚體的切除分兩個階段:快速切除期,約需2~3小時,主要切除未與組蛋白結合的DNA部分的損傷;緩慢切除期,至少要持續35小時而且需要有某種控制因子去識別這種損傷,使DNA受損部分從核小體中暴露出來,然後經過一系列步驟完成切除修復,然後修復的DNA分子再纏繞在組蛋白上重新形成核小體。
重組修復
重組修復從 DNA分子的半保留複製開始,在嘧啶二聚體相對應的位置上因複製不能正常進行而出現空缺,在大腸桿菌中已經證實這一DNA損傷誘導產生了重組蛋白,在重組蛋白的作用下母鏈和子鏈發生重組,重組后原來母鏈中的缺口可以通過DNA多聚酶的作用,以對側子鏈為模板合成單鏈DNA片斷來填補,最後也同樣地在連接酶的作用下以磷酸二脂鍵連接新舊鏈而完成修復過程。重組修復也是嚙齒動物主要的修復方式。重組修復與切除修復的最大區別在於前者不須立即從親代的DNA分子中去除受損傷的部分,卻能保證DNA複製繼續進行。原母鏈中遺留的損傷部分,可以在下一個細胞周期中再以切除修復方式去完成修復。
重組修復的主要步驟有:
1.複製
含有TT或其他結構損傷的DNA仍然可以正常的進行複製,但當複製到損傷部位時,子代DNA鏈中與損傷部位相對應的位置出現切口,新合成的子鏈比未損傷的DNA鏈要短。
2.重組
完整的母鏈與有缺口的子鏈重組,缺口由母鏈來的核苷酸片段彌補。
3.再合成
重組後母鏈中的缺口通過DNA多聚酶的作用合成核酸片段,然後由連接酶是新片段與舊鏈連接,至此重組修復完成。
重組修復並沒有從親代DNA中去除二聚體。當第二次複製時,留在母鏈中的二聚體仍使複製不能正常進行,複製經過損傷部位時所產生的切口,仍舊要用同樣的重組過程來彌補,隨著DNA複製的繼續,若干代以後,雖然二聚體始終沒有除去,但損傷的DNA鏈逐漸“稀釋”,最後無損於正常生理功能,損傷也就得到了修復。
SOS修復
是SOS反應的一種功能。SOS反應是DNA受到損傷或脫氧核糖核酸的複製受阻時的一種誘導反應。在大腸桿菌中,這種反應由recA-lexA系統調控。正常情況下處於不活動狀態。當有誘導信號如 DNA損傷或複製受阻形成暴露的單鏈時,RecA蛋白的蛋白酶活力就會被激活,分解阻遏物lexA蛋白,使SOS反應有關的基因去阻遏而先後開放,產生一系列細胞效應。引起SOS反應的信號消除后,recA蛋白的蛋白酶活力喪失,lexA蛋白又重新發揮阻遏作用。
SOS 反應發生時, 可造成損傷修復功能的增強。如uvrA、uvrB、uvrC、uvrD、ssb、recA、recN和RUV基因發達從而增強切除修復、複製后修復和鏈斷裂修復。而recA和umuD.C則參與一種機制不清的易錯修復,使細胞存活率增加,突變率也增加。
除修復作用外,SOS反應還可造成細胞分裂受阻、溶原性噬菌體釋放和DNA複製形式的改變。後者指DNA聚合酶I*的形成,使DNA複製的準確性降低並可通過損傷部位。此時,DNA複製的起始也無需新合成蛋白。
在真核細胞中,雖然還不清楚具體過程,但肯定存在可誘導的易錯修復。酵母RAD6系統就是一種易錯修復系統。在哺乳類細胞中,DNA損傷可誘導細胞內病毒的釋放、病毒轉化作用的加強、染色體重組增強和細胞纖溶酶激活物的形成等。並且還發現了和大腸桿菌相似的ω-復活效應和ω-誘變效應。由於這種反應可增強突變、染色體重排和病毒的活動,以及對 DNA複製形式的影響,可能與癌基因激活和腫瘤形成有直接的關係。因而,SOS反應可作為檢測藥物致癌性的指標,而抑制SOS反應的藥物則可減少突變和癌變。這類物質被稱之為抗變劑。
適應性修復
1977年美國學者L.薩姆森等在大腸桿菌中發現的不同於 SOS修復的又一種誘導反應,它可以修復鳥嘌呤鹼基的甲基化。如先以每毫升培養基 1微克的誘變劑N-甲基-N'-硝基-亞硝基胍 (MNNG)培養大腸桿菌兩小時,就能使大腸桿菌對MNNG濃度高几百倍的環境產生抗性。這是由於 MNNG引起的DNA鏈上的鳥嘌呤甲基化誘導合成甲基受體蛋白,這種甲基受體蛋白分子的半胱氨酸能和甲基基團結合形成S-甲基半胱氨酸,從而使甲基化的鳥嘌呤鹼基得以修復。
鏈斷裂修復
包括DNA分子的單鏈斷裂修復、雙鏈斷裂修復和染色體的斷裂重接修復。在連接酶的參與下這些斷裂能夠迅速地以重接的方式修復。這種修復有兩個特點:一是不穩定性,重接后又可以再度離解;二是不正確性,經常發生隨機的重接錯誤。
鏈交聯修復
起始步驟是在糖基酶的催化下解開交聯的一條臂, 通過鹼基切除的方式先修複合成其中一條單鏈,然後再在內切酶的催化下,以核苷酸切除修復的方式從相反的方向修復對側的單鏈片斷。
大部分DNA損傷修復都依賴於DNA的修複合成,所以對修複合成的測定常用來作為DNA修復的檢測方法。常用的有以下幾種:
放射自顯影法
在細胞培養物中加入氚標記的胸腺嘧啶核苷等放射源,用放射自顯影方法計數銀顆粒數來測定修複合成過程中參入到DNA分子中的量。
液體閃爍計數法
用液體閃爍計數器測定培養物中的放射源因修複合成而參入到DNA分子中的量。這一方法適用於大批量樣本。
超速離心法
一種應用比較廣泛的方法,可應用於切除修復、複製后修復及鏈斷裂修復方式的檢測。一般是用氚標記溴脫氧尿嘧啶核苷等參入到修複合成的DNA分子中去以改變DNA分子的重量(BrdU的分子量比尿嘧啶核苷大),通過超速離心可以從沉降係數不同的各組分中收集修複合成中參入量不同的DNA片斷,然後分別測定其放射性的強度來判斷修複合成的多少。
病毒宿主細胞復活法
以SV40病毒、腺病毒、皰疹病毒、噬菌體等感染培養的人體細胞或細菌,然後以紫外線等處理以造成病毒DNA分子的損傷,因為病毒DNA分子損傷的修復是靠宿主細胞的修復酶系統,所以受損傷的病毒能否繼續生存繁殖可間接地反映宿主細胞的修復功能。
姐妹染色單體互換(SCE)法
姐妹染色單體互換率的檢測也能反映一部分DNA修復功能。人類中的某些先天性DNA修復缺陷疾病如布盧姆氏綜合征患者的自發SCE顯著增高;另一些如著色性干皮病則誘發SCE增高。這是由於DNA修復功能的缺陷導致染色體穩定性減弱所致。
實踐意義DNA修復與腫瘤各種原因引起的DNA損傷可以通過各種方式修復。如果修復功能有缺陷,DNA損傷就可能造成兩種結果:一是細胞死亡;二是發生基因突變,或進而惡性轉化為腫瘤細胞。先天性DNA修復缺陷疾病患者容易發生各種惡性腫瘤,例如人類的著色性干皮病患者的皮膚對陽光過度敏感, 照射后出現紅斑、水腫,繼而出現色素沉著、乾燥、角化過度,結果可導致黑色素瘤、基底細胞癌、鱗狀上皮癌及棘狀上皮瘤的發生。通過細胞融合的研究表明具有不同臨床表現的該病患者有明顯的遺傳異質性,可以分為A、B、C、D、E、F、G七個互補群及變種,A-G互補群表現為不同程度的核酸內切酶缺乏引起的切除修復功能缺陷,變種的切除修復功能正常,但複製后修復的功能有缺陷。又如范可尼貧血臨床主要表現的特徵如再生障礙性貧血、生長遲緩、易患白血病等是由於先天性鏈交聯等修復缺陷所致。其他如布盧姆氏綜合征和毛細血管擴張共濟失調患者都易患白血病和淋巴肉瘤,也是先天性DNA修復缺陷造成的。
值得注意的是DNA修復功能缺陷雖可引起腫瘤的發生,但已癌化細胞本身的DNA修復功能並不低下,相反地卻顯著地升高,並能夠充分地修復化療藥物引起的DNA損傷, 這也是大多數抗癌藥物不能奏效的原因。地鼠細胞的DNA損傷修復的方式以複製后修復為主, 如果在地鼠的漿細胞瘤細胞的培養物中加入環磷醯胺等抗癌藥后,瘤細胞照樣生長,如果加入環磷醯胺的同時再加入咖啡因(複製后修復的抑製劑),則瘤細胞的生長受到了明顯的抑制。所以DNA修復的研究可為腫瘤聯合化療提供方案。
從DNA修復功能的比較研究中發現壽命長的動物(象、牛等)修復功能較強;壽命短的動物 (倉鼠、小鼠、鼩鼱等)修復功能較弱。人的DNA修復功能也很強,但到一定年齡后逐漸減弱,同時突變細胞數也相應增加,所以老年人癌的發病率也比較高。檢測各年齡組正常人的染色體畸變率和 DNA修復功能證實了這一點。人類中常染色體隱性遺傳的早老症和韋爾納氏綜合征患者一般早年死於心血管疾病或惡性腫瘤;患者的體細胞極易衰老,是研究老年病與DNA修復關係的很好模型。
DNA修復與免疫
DNA修復功能先天缺陷的病人的免疫系統也常是有缺陷的,主要是 T淋巴細胞功能的缺陷。隨著年齡的增長細胞中的DNA修復功能逐漸衰退,如果同時發生免疫監視機能的障礙,便不能及時清除癌化的突變細胞,從而導致發生腫瘤。所以, 衰老、DNA修復、免疫和腫瘤四者是緊密關聯的。
DNA修復的研究已被應用於檢測各種化學致癌物。一般的方法是在體外傳代培養的正常人皮膚成纖維細胞或大鼠原代培養的肝細胞中加入被檢物,培養一定時間后再加入繼續培養,然後收集細胞作放射自顯影或液體閃爍的測試,如果參入量顯著增高,表明被檢物可疑為誘變劑或致癌劑。微生物培養的方法則更為簡便、迅速,例如可以用枯草桿菌重組功能發生缺陷的突變型來進行檢測,這些突變型由於喪失了重組功能而不能進行重組修復,因而更容易為許多誘變劑和致癌劑所殺傷致死。
關於DNA修復機制方面的許多問題還有待於進一步的研究闡明。例如從原核生物開始到真核生物的高等哺乳類動物各依靠哪些方式來修復受損傷的DNA分子,修復方式又是怎樣隨物種的進化而發生演變的,修復缺陷的遺傳異質性的本質又是什麼,免疫缺陷和DNA修復功能缺陷的因果關係又是怎樣的等等。
[1]中國論文下載中心 http://www.studa.net/yixue/080422/13524534.html
