芋螺毒素
芋螺毒素
芋螺毒素(conotoxin或conopeptide,或CTX),由海洋腹足綱軟體動物芋螺(Conus)的毒液管和毒囊內壁的毒腺所分泌,由許多單一毒肽組成的雞尾酒樣的混合毒素,主要成分是一些對不同離子通道及神經受體高專一性的活性多肽化合物。每種芋螺的毒液中可能含50~200個活性多肽。不同種芋螺所含活性肽各不相同,即使同種芋螺因海域不同,其毒素成分也可存在差別,理論上估計有5萬多種不同活性肽存在於芋螺毒液中。芋螺毒素多數由10~40個氨基酸殘基組成,富含兩對或三對二硫鍵,是發現的最小核酸編碼的動物神經毒素肽,也是二硫鍵密度最高的小肽,可作用於各種離子通道和受體的類型及亞型。
與其他天然肽類毒素相比,芋螺毒素具有相對分子質量小、結構穩定、高活性、高選擇性及易於合成等突出優點。它們能特異性地作用於乙醯膽鹼受體及其他神經遞質的各種受體亞型,以及鈣、鈉、鉀等多種離子通道,不僅可直接作為藥物,還可作為理想的分子模板用於發展新葯先導化合物,對研究神經生物學也具有重要意義。研究中的疾病治療範圍包括慢性疼痛、癲癇、心血管疾病、精神障礙、運動障礙、痙攣、癌症以及中風等。多種具有強神經肌肉阻斷作用的芋螺毒素應用於臨床麻醉手術的輔助藥物也在進行研究,喉部肌肉的快速麻痹有助於氣管內插管等手術。中國在這方面起步較晚,1999年才真正開始研究分佈在中國的芋螺的毒液。

代表性芋螺
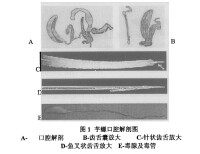
芋螺口腔解剖圖
芋螺毒腺
芋螺食物種類很廣,包括多毛環節動物蠕蟲,頭足類動物,其他腹足動物,雙殼類、魚和甲殼綱動物。根據其捕食習性分為食魚芋螺、食螺芋螺、食蟲芋螺。其中食蟲性芋螺最為常見,而食魚芋螺的毒性最大。捕食時,它具有兩種捕獵方式,一種是將毒液釋放到周圍海水中,較為常見的第二種,迅速伸出形似魚叉般的牙齒刺入獵物體內,牙齒上具有毒素。它們會向獵物投射接連毒腺管和毒囊的針狀齒舌,並注射毒液。獵物一旦被擊中,就立刻麻痹,成為芋螺的食物。芋螺毒液是捕食與防禦作用的主要武器,毒液的毒性很強,人被刺傷時亦常導致嚴重傷害,甚至死亡。300年前,就有芋螺毒死采螺人的記錄。
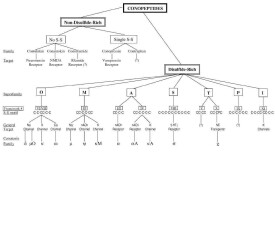
根據芋螺毒素基因及其前體蛋白信號肽的保守性,可將芋螺毒素分為A、O、T、M、P、I等多個超家族。α、αA、κA屬於A-超家族,ω、δ、κ、μO屬於O-超家族,μ、ψ、ΚM屬於M-超家族。O-超家族芋螺毒素(半胱氨酸模式C-C-CC-C-C)主要作用於電壓門控離子通道(又稱電壓敏感性通道),包括Ca2+離子通道、Na+離子通道和K+離子通道等。作用於Ca2+離子通道的只有O-超家族的ω-芋螺毒素。在此基礎上,根據每個成員保守的半胱氨酸骨架,結合其藥理學活性,將之進一步分為若干個家族,按其作用靶位的不同又可將其分為α、αΑ、δ、ε、γ、κ、λ、λ/χ、μ、μO、ρ、σ、ω、ψ等若干個家族。例如:O-超家族,包括ω-、μO-、δ-和κ-芋螺毒素;T-超家族,包括τ-和χ-芋螺毒素;A-超家族,包括α-、αA-和κA-芋螺毒素等。另外,還有一類不含二硫鍵或者僅一對二硫鍵的芋螺肽(conopeptide),由於數量少且種屬的分佈相對稀少,通常直接在其名稱後面直接加一個或兩個字母來表明其種屬來源,如contryphan-R,conantokin-G等。而δ-、μ-、μO-芋螺毒素作用於不同亞型的鈉通道,分別屬於O、M超家族,統稱為鈉通道芋螺毒素。δ-芋螺毒素延緩鈉流的鈍化速度,延長動作電位的持續時間。μ-芋螺毒素分為作用於河豚毒素敏感型(TTX-S)與不敏感型(TTX-R)兩類,尤其是TTX-R型μ-芋螺毒素,序列短,活性高,選擇性強,已證實具有顯著的鎮痛效果。

A-超家族芋螺毒素的序列分析
A-超家族芋螺毒素的cDNA序列分析發現,它們的信號肽序列具有很高的同源性,而前體肽序列在同一家族中也具有很高的保守性,成熟肽區則顯示超變異性,但是各家族的二硫鍵骨架結構仍然相對保守。但就整個A-超家族芋螺毒素來說,它不像其他超家族芋螺毒素具有完全相同的二硫鍵骨架結構,在其三個家族中,α-芋螺毒素具有CC-C-C骨架結構,而αA-和κA-芋螺毒素具有完全不同的二硫鍵骨架結構CC-C-C-C-C,這些結構上的差異也直接導致了他們在生理功能上也有明顯的分化和不同。
α-芋螺毒素是A-超家族芋螺毒素中分佈最廣、丰度最高的家族,它們是一些12~30AA的小肽,通常含兩個二硫鍵,有20種α-芋螺毒素的一級結構得到了確證,分別來自不同的芋螺種。α-芋螺毒素是神經或肌肉乙醯膽鹼受體的抑製劑。而一種芋螺中同時可能含有6種以上的α-芋螺毒素,其靶位分子均為nAChR受體。已知不同生物物種或同一種物種體內均存在多種nAChR受體亞型,某些生物體內nAChR受體亞型可達16種之多。為了適應此種生態環境,α-芋螺毒素的分子結構不斷進化,其二硫鍵間的loop環框架與氨基酸組成發生變異。單個氨基酸取代即可提高α-芋螺毒素對某一nAChR受體亞型的選擇性100倍以上。多樣性的α-芋螺毒素可以顯著提高芋螺捕食不同生物的能力。
對α-EI的NMR結構研究表明,儘管α-EI的結構骨架與其他已知的α4/7芋螺毒素比較吻合,但是其表面電荷分佈和部分表面基團位置與α-GI十分相似,也許正是這種分佈造成了其對肌肉型nAChR的作用。由此推測毒素對受體亞型的選擇性也受到毒素表面電荷和基團的影響。

I-超家族芋螺毒素的前體序列
已發現了幾十個I-超家族芋螺毒素(I-CTX),該家族毒素比一般的芋螺毒素要大,並且成熟肽超變異。I-超家族芋螺毒素通常由33~46個氨基酸組成,含有4對二硫鍵。分子生物學研究發現,每個芋螺毒素均有單一的mRNA編碼,原始翻譯產物是它們的蛋白前體。前體通常由N-端的信號肽,中間的Pro區和C-端的成熟肽組成。Buczek等對I-超家族芋螺毒素的cDNA序列分析發現其家族成員之間的信號肽序列同源性很低,按信號肽序列可將之分為I1和I2兩組。第1組I1-超家族芋螺毒素可視有無翻譯后修飾分為A、B兩類,其中A類芋螺毒素的C-末端倒數第3個氨基酸一般為Phe、Leu或Met,都是D型氨基酸,B類芋螺毒素的信號肽和pro區與A類的較為相似,但其成熟肽的長度比A類的短,而且沒有翻譯后修飾。第2組I2-超家族芋螺毒素沒有pro區,而在其前體的C-端有一段約6~13個氨基酸的序列。
芋螺毒素質譜圖
所有的芋螺毒素具有幾個共同的結構基序,然而在不同的芋螺種中,芋螺肽的序列差異極為顯著。按照芋螺毒素的二硫鍵框架及高度保守的信號肽序列,芋螺毒素可分為若干個超家族,如A、M、O、P、I、S、T等,其中A家族芋螺毒素又分為α-,αA-,κA-三個亞家族。大約一半的已知神經元特異性α-芋螺毒素的三維結構已經確定,其摺疊方式也已有共識———由兩個保守二硫鍵支撐的螺旋區域。這些二硫鍵使α-芋螺毒素具有兩個閉環框架特徵,半胱氨酸殘基和二硫鍵的締結方式在整個序列中是不變的,構成了二環的基本框架。α-芋螺毒素共有的主要氨基酸序列中半胱氨酸殘基的排列:CCXmCXnC(C代表半胱氨酸,Xm和Xn為非半胱氨酸殘基的數量)。一般在上述序列中1/3和2/4半胱氨酸之間形成二硫鍵。半胱氨酸殘基之間氨基酸的數量將α-芋螺毒素分成不同的亞型。這些亞型包括α3/5-、α4/3-和α4/7-芋螺毒素,分別以2/3和3/4半胱氨酸殘基之間氨基酸的數目命名。α3/5-芋螺毒素(CCX3CX5C,如α-GI和MI)拮抗脊椎動物肌肉nAChRs,α4/7-芋螺毒素(CCX4CX7C,如α-MII)對脊椎動物神經nAChRs具有特異的選擇性和親和力。α4/3-芋螺毒素(CCX4CX3C,如α-ImI和α-RgIA)對同聚肽神經nAChRs(α7-α10亞基)和雜聚肽α9α10nAChRs亞基有拮抗作用,而來自Conus purpurascens的α-芋螺毒素PIB(α-PIB)是一種α4/4-芋螺毒素(CCX4CX4C)對脊椎動物神經肌肉nAChRs有高親和性和抑制活性。

芋螺毒素色譜圖
芋螺毒素的命名規則如下:1個希臘字母表明藥理學活性,1個或2個字母代表芋螺種屬,1個羅馬數字錶示二硫鍵框架編號,1個大寫字母表示其變異體。如σ-GⅧA中,σ指出藥理學活性,G代表地紋芋螺(C.geographus),Ⅷ為二硫鍵骨架,而A為該類肽的第一個毒素。若只有克隆基因獲得的成熟肽序列,就用1個或2個字母代表芋螺種屬,1個阿拉伯數字錶明半胱氨酸框架,1個阿拉伯數字代表變異體,如Tx5.1、Tx5.2。
芋螺毒素(Cys殘基排列方式-C-C-CC-C-C-)肽鏈由24~31個氨基酸組成,分別含有3對二硫鍵成4-Loop框架。Marian Price-Carter等研究了ω-芋螺毒素MVIIA中二硫鍵對該毒素的穩定性和肽段摺疊的影響,發現每個二硫鍵均對毒素的穩定構象有重要貢獻,缺少任何一個二硫鍵都會導致毒素變成不規則的二級結構,大幅度降低與鈣通道的結合能力,並變得更容易被還原。已利用NMR技術獲得了MVIIA,GVIA,MVIIC,MVIID,SVIB,SO3和TxⅦ等ω-芋螺毒素的溶液構象,這些芋螺毒素的整體構象都十分相似,在空間上表現為由3股被轉角連接的反平行β-片層所組成,具有穩定的抑製劑半胱氨酸繩結模體的結構,這種保守的結構正是芋螺毒素能作用於鈣離子通道上的宏位點的基礎,所不同的只是β-片層的長度和β-轉角的類型。芋螺毒素的多樣性及與受體結合的高特異性是由於Loop區核苷酸序列高變的結果,ω-芋螺毒素對鈣離子通道亞型的選擇性也正是因為分子中4個Loop區氨基酸序列的超變異。雖然各種ω-CTX的同源性都比較低,但通常第13位是保守的Tyr殘基,在第5位是保守的Gly殘基,並且通常含有4~6個鹼性氨基酸。
利用核磁共振光譜法可以確定多種芋螺毒素的三維結構。這些小肽很難形成結晶,但也有幾種小肽可以通過X-射線晶體法分析其結構,如具有神經肌肉活性的芋螺毒素GI可以通過這兩種方法分析其結構。儘管芋螺毒素是一種小肽,但是它們卻能摺疊成精細的結構。根據這些結構特徵,有可能確定它們一致的結構特徵。這些結構上的特性明顯受到二硫鍵的締結方式和圍繞第3個半胱氨酸的一個螺旋區域的限制,這種螺旋的典型特徵是覆蓋第5~12位的殘基。環1(Loop1)的摺疊方式是高度保守的,包括螺旋的第一個轉角。主要的差別發生在環2(Loop 2),最為直觀的表現就是該環包含的殘基數是不等的。然而,即使是在殘基數相等的情況下,在4/7型的芋螺毒素中,環1比環2有更好的重疊程度。在這種情況下,結構的差異顯然是與氨基酸殘基的序列多樣性相關而不是氨基酸殘基的數量。因此,環2的序列多樣性導致了芋螺毒素的多樣性,使其對神經元nAChRs具有特異選擇性。對具有神經元活性的芋螺毒素進行活性結合實驗,有助於研究神經元nAChRs的多樣性和受體特異選擇性,也可能獲得治療神經性疾病的藥物。

芋螺毒素紫外光譜圖
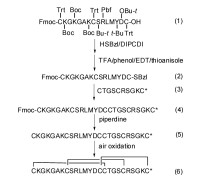
芋螺毒素合成路線
從芋螺的毒管中可提取少量天然芋螺毒素,大多從野生芋螺的死體毒管中提取。或者引誘活體芋螺刺捕獵物,用乳膠套收集噴射的毒液,可收集到幾微升毒液。為了充足供應芋螺,美國研究人員在農場里嘗試芋螺的養殖,只養了Conuspurpurascens一種,但還不能辨別活芋螺的性別,也未觀察到芋螺的交配行為,這說明暫時無法人工繁殖芋螺。因而,靠從芋螺體內分離提取獲得大量的芋螺毒素用於研究和生產是不現實的,天然來源的芋螺毒素十分有限,這制約了芋螺毒素研究的開展和應用。但獲得的少量天然毒液可用高效液相色譜儀進行分離和分析,通過質譜儀和序列分析,可得到單個毒素肽的氨基酸序列。
研究中使用的芋螺毒大多數是毒液排出管抽提物。對於大多數芋螺種來說,這些抽提物勉強用於研究。但也有例外,如一種產自東太平洋獵食魚的種類稱為紫紋芋螺(C.purpurascens),其抽提物量不足以用於生化研究。可以先將紫紋芋螺飼養在水中洞穴中,用吹脹的塑料套子在金魚身上摩擦,芋螺從沙子中跑出來,吸吮著套子,隨套子浮在水面上。或Eppendorf試管,挖去蓋子,放一些魚鰭在試管中,再在魚鰭上面放上一層薄膜,芋螺試圖吸吮試管,便將毒液排入試管中。每收集3-5mL毒液需要耐心地多次用這種方法不停地累積。
μ芋螺毒素基因的串聯
芋螺毒素在體內先合成較大的無活性多肽前體,它們由50~80個氨基酸殘基組成,含有典型的信號肽序列區和可變區,在近成熟肽區位置,有標準的蛋白質水解信號,這些信號肽序列在所有超家族成員中具有保守性。同一超家族的芋螺毒素成員具有高度保守的信號肽序列和高度保守的二硫鍵連接方式。如MVIIC,MVIID,SⅥA,SⅥB和SO3是根據已知ω-毒素毒素肽氨基酸保守序列,合成特定的探針,從中篩選出來的。其他國家已構建了織錦芋螺(C.textile),幻芋螺(C.magus),地紋芋螺(C.geographus),金翎芋螺(C.penaceus)等幾種芋螺的cDNA文庫。同時根據信號肽及3’端非翻譯序列,設計芋螺毒素各個超家族基因的特異PCR引物,從cDNA和基因組DNA中克隆新型毒素基因成為可能,且是分離芋螺毒素基因的主要方法。
研究人員從3種芋螺(C.livi-dus、C.abbreviatus和C.ebraeus)中測出了284個四環芋螺毒素前體蛋白基因序列,又從另外5種芋螺(C.arena-tus,C.pennaceus,C.tessulatus,C.ven-tricosus和C.textile)中獲得了170個芋螺毒素的cDNA序列。他們都在GeneBank中申請了序列號。中國海南淺紋芋螺(C.striatus)和織錦芋螺(C.textile)中也分別發現了6種新O-超家族毒素的cDNA序列和2種α-CTX。地紋芋螺(C.geographus)基因組DNA則用PCR法克隆到新型α-CTX GIC。
三種芋螺的基因組DNA電泳圖
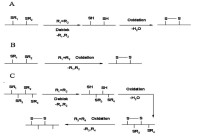
二硫鍵形成方法示意圖
研究人員在合成ω-CNVIIA時,對這幾種氧化摺疊方法作了比較,發現gluthatione氧化法效果最好。隨後進行純化,即可得到具有天然毒素活性且純度較高的多肽,最後利用NMR技術進行構象分析。因此,人工合成芋螺毒素的成本較高,還不能完全滿足作為藥物商業化生產的要求。但由於芋螺毒素藥物的用量小,效果好,價值高,可部分滿足市場需求。
隨著對芋螺毒素研究的深入和多肽合成技術的進步,芋螺毒素的合成方法也不斷改進。Ale-wood小組將硒代半胱氨酸引入,合成了3個α-芋螺毒素ImI的類似物。具體操作是用硒代半胱氨酸代替了其中的1對或者2對半胱氨酸,形成二硒鍵替代了原有的二硫鍵,顯著提高了芋螺毒素的氧化摺疊效率,NMR和CD譜都表明類似物和天然的ImI在結構上十分相似,並且保持了原有的生物活性。可採用硒代半胱氨酸代替半胱氨酸合成了μ-芋螺毒素SIIIA類似物,並且使用同位素標記了1對半胱氨酸,在提高了合成效率的同時確定了二硫鍵的連接。
有研究人員在利用微波合成法合成了α-芋螺毒素MII的過程中,比較了使用微波合成法和經典的固相合成法。結果表明使用微波合成的產率更高,從77%~89%提高到75%-93%。更重要的是使用微波加熱縮短了每個反應周期的時間,由1-2h減少到12-15min。如果把微波用於環狀肽α-芋螺毒素IMI合成,合成效率也有所提高。此外,芋螺毒素的合成還有很多其它的策略,如μ-MrIA和α-MII採用N-C骨架環化的方法合成。還有科學家利用內醯胺、硫醚等代替二硫鍵,研究芋螺毒素的摺疊產率。
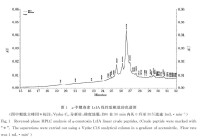
芋螺毒素LtIA線性肽粗肽的色譜圖
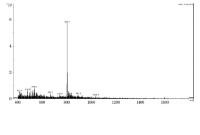
芋螺毒素LtIA線性肽的質譜圖
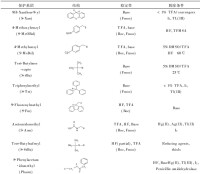
多肽固相合成中常用的半胱氨酸保護基團
由於天然芋螺毒素含有特定的二硫鍵連接方式,因此如何合成特定二硫鍵連接方式的多肽成為合成中最大的難題,也是限制獲得大量天然芋螺毒素的關鍵因素。在芋螺毒素合成過程中,二硫鍵形成一般通過以下兩種方法:第1種為遊離的巰基形成二硫鍵;第2種為半胱氨酸脫保護直接形成二硫鍵;,因芋螺毒素一般含有多對二硫鍵,一般情況下需綜合使用上述兩種方法。遊離的巰基形成二硫鍵在芋螺毒素的合成過程中,半胱氨酸的保護基團如果是S-Trt、S-Tmob、S-Xan等,經過切割后就會形成遊離的巰基,這些巰基需進一步自由氧化形成二硫鍵。這是芋螺毒素合成最常用的策略。遊離的巰基形成二硫鍵的方法有多種,如空氣氧化法、二甲基亞碸氧化法、固相埃爾曼試劑法、鐵氰化鉀氧化法等。一般認為此法形成的終產物受熱力學控制,反應產物為水,純化步驟少。但由於芋螺毒素含多個半胱氨酸,自由氧化後會形成多種同分異構體。含兩對二硫鍵可以形成3種異構體,如α、ρ、τ、χ等家族芋螺毒素。如果含有6個半胱氨酸理論上會形成15種異構體。研究者已經摸索多種方法,研究體外條件下二硫鍵形成的機制。結果表明芋螺毒素本身的性質和外界因素都對二硫鍵的連接有著一定程度的影響。如Shigeiu等研究了鹽濃度和溫度對ω-芋螺毒素MVIIC摺疊的影響。結果顯示在5℃時氧化的效果最好,天然構象的產率隨著溫度的上升而下降,而2.0mol·L-1(NH4)2SO4可以大大提高ω-芋螺毒素MVIIC的正確摺疊效率。Cruz等研究了去污劑對疏水性δ-芋螺毒素PVIA氧化摺疊的影響,結果表明加入去污劑後天然產物的比例大大提高。Miloslavina等研究了離子化溶液對芋螺毒素摺疊的影響,結果表明離子化溶液可以提高親水性和疏水性肽的氧化摺疊效率。此外,前體肽和二硫鍵異構酶作用以及醯胺化等對芋螺毒素二硫鍵形成也都有一定程度的影響。半胱氨酸脫保護定點形成二硫鍵芋螺毒素含有多對半胱氨酸,每一對半胱氨酸可以採用不同的基團保護,合適的脫保護試劑脫去保護基團,定點形成二硫鍵,這是形成芋螺毒素二硫鍵正確連接的常用方法之一,此法可以定點形成二硫鍵,為構象研究提供了方便,但也需要注意Met、Trp等這些敏感的氨基酸可能會發生副反應。含有2對二硫鍵的α-芋螺毒素GI即採用此種方法被合成,其半胱氨酸分別用Acm和MeBzl保護,用HF/anisole脫去MeBzl保護基團,鐵氰化鉀氧化形成第1對二硫鍵,然後利用I2脫去Acm並且直接形成第2對二硫鍵,合成α-芋螺毒素GI時,在脫去MeBzl的同時,樹脂也被切割。而Alewood等對定點合成α-芋螺毒素GI進行了進一步探索,即首先在樹脂上形成二硫鍵,最後切去樹脂,具體為先用巰基乙醇/DIEA/DMF脫去Fm保護基團形成第1對二硫鍵,之後再利用I2脫去Acm並且直接形成第2對二硫鍵,最後才使用HF脫去樹脂。
另外,還有一種新的定點形成二硫鍵的方法,稱為一罐法(One-pot method)。即兩對半胱氨酸分別用t-Butyl和4-methylbenzol基團保護,在5%DMSO/TFA和25℃條件下,t-Butyl保護基團被脫除,再將溫度升高到70℃脫去4-methylbenzol基團。研究人員利用兩步法和一罐法均合成了α-芋螺毒素ImI,並且比較二者合成效率,結果表明一罐法合成效率更高。
O-、M-等超家族芋螺毒素比較特殊,因為含有3對二硫鍵,一般自由氧化和定點形成二硫鍵相結合來合成。如ω-芋螺毒素MVIID,此肽含有6個半胱氨酸。首先用S-Trt保護Cys1,Cys3,Cys4,Cys6,Cys2,Cys5用S-Acm保護。先用切割液脫去樹脂和S-Trt保護基團,形成4個遊離的巰基,空氣氧化形成2對二硫鍵,剩下的1對保護基團採用I2脫去並形成第3對二硫鍵。含有3對二硫鍵的芋螺毒素還可以採用三步法合成,即每一步都形成1對二硫鍵。Durieux等利用S-Trt,S-Acm和S-MeOzl3種保護基團,分3步切割形成二硫鍵合成了ω-芋螺毒素MVIIA。

芋螺毒素氨基酸序列
每個芋螺毒素均由單一的mRNA編碼,通過核糖體翻譯機制進行生化合成,原始翻譯產物是一種特定的前蛋白原前體化合物,約為70~120AA,包括一個大約20AA的N-端信號肽,一個中間前體段和一個大約10~30AA的成熟毒素段,成熟毒素段常為由C-端編碼的單一拷貝區段,生成的毒素片段可在經過不同程度的翻譯后修飾,許多芋螺毒素是基因多肽產物中高度翻譯后修飾的產物。前蛋白原前體的不同區段的進化速率很不相同,同一超家族的信號肽段是高度保守的,與之相反,成熟毒素段卻是高突變的,可能前蛋白原的信號肽段、中間前體段和成熟毒素段是分別由不同的較小的外顯子編碼形成,這些外顯子被較大的內含子片段相互隔斷,內含子片段可以調控複製、重組等功能,使前體分子C-端部分加速進化。芋螺毒素的多樣性主要來源於成熟毒素段的高突變作用,在一定進化時段內,芋螺毒素利用組合庫方式或稱為盒式轉化機制的方式快速構造新的毒素多肽序列,同時保留高度保守的二硫鍵排布方式。前蛋白原前體中有一個可由翻譯后修飾酶類識別的特殊信號肽段,多種翻譯后修飾過程進一步生成更多新序列的芋螺毒素分子。常見的翻譯后修飾方式有谷氨酸的γ-羧基化,大約有20%的芋螺毒素存在γ-羧基谷氨酸,使之利於阻斷NMDA受體。另一種翻譯后修飾方式是L-氨基的氨基酸的差向異構化作用,將色氨酸與亮氨酸轉換成D-型,則可以提高其對某類亞型受體的特異性。

芋螺毒素結構模擬圖
芋螺毒素肽表現出分子多樣性是通過成熟毒素肽區的超突變,芋螺在進化歷程上正使用一種重組戰略以便在毒液中產生新的肽序列,同時保留肽的基本結構框架。因此,很顯然,芋螺毒液是芋螺捕獲獵物的主要武器,也可能被當作其它生物學目的(如防衛)。毒液的內容物以很多方式提供了生物體相互作用的生化反射,這種生化反射對該芋螺的競爭勝利或失敗是必需的。在一個特殊芋螺種競爭勝利的小生態環境中,可能對毒液的個別組分有連續性的自然選擇。當一個新的種進化時,也許因為環境突然改變,捕食者、被捕食者和競爭者三者變化著的關係可能對毒液的其他組分產生新的和巨大的選擇壓力。在這些不穩定因素下,毒液的組分明顯成熟過度,以致於在相對短的時間內,新種的出現伴隨著為適應已改變了的生態小環境而其毒液肽的新組成的出現。因此,可論證地說,芋螺屬已變成所有海洋無脊椎動物屬中物種最豐富的屬。通過這種擴增成數百種種,毒液的基本戰略保持相同:即幾個基因超家族的多樣化衍生出來的小的結構肽類,強力地影響捕食者、被食者和競爭者的神經系統。

μ芋螺毒素基因序列分析圖
CTx中A-超家族芋螺毒素中最常見的加工方式是C端的醯胺化和脯氨酸的羥基化;另一種翻譯后修飾方式是L-氨基的氨基酸的差向異構化作用,將色氨酸或亮氨酸轉換成D-型,則可以提高其對某類亞型受體的特異性。同時發現了一些其他的修飾,如Ser糖基化及Tyr的磺基化等。芋螺毒素分子的翻譯后修飾的重要作用在於可使單一基因生成結構不同的多類肽分子結構,大大增加了芋螺毒素分子的多樣性。通過翻譯后修飾也可以生成不同於母體分子結構的新肽分子模體,提高對靶位分子的識別能力與專一性,同時這些結構變化也常能提高芋螺毒素對蛋白酶的抗性。另一些翻譯后修飾的重要作用是改變其物理化學性質,如絲氨酸和蘇氨酸的羥基的O-糖基化作用可增加毒素分子的穩定性以及與膜轉運分子的親和性,苯丙氨酸的鹵化作用可以增加分子的脂溶性,使之易於透過血腦屏障,進入中樞神經系統。動物實驗研究表明,達到同樣的活性需要的劑量未糖基化的比糖基化的高10倍,顯然O-糖基化增加了毒素的效率。這些氨基酸的修飾與加工均需要特定的酶,同時也需要相應的識別序列或者特徵結構,對芋螺毒素而言,對其結構與功能至關重要的可能是蛋白質二硫鍵異構酶(protein disulfide isomerase,PDI)。
放射性配體結合實驗常用於評價單個氨基酸被替代后的活性。由於Gla比較特殊,首先引起人們的關注。研究發現,Con-G[γ4A]活性完全喪失;Con-G[γ3A]活性較原肽段下降20倍;Con-G[γ10A]、Con-G[γ14A]活性無明顯改變;Con-G[γ7A]對嚙齒類動物和人類神經細胞,活性均增加4倍,這表明,Con-G中第4位Gla很重要。對Con-T的研究表明,3位Gla替換對原肽段活性影響較大;4位Gla為維持活性所必需,無論用何種氨基酸替換后,所得類似物均無活性。10位Gla被取代后活性稍降低,14位Gla被替換后活性增加1倍。放射性配體結合實驗研究除Gla以外其他氨基酸發現,Con-T[Q6A]活性增加兩倍,其餘類似物活性均不同程度下降。這說明Con-T中,第6位氨基酸重要性相對小,其餘氨基酸對於維持Con-T活性都是必需的。全細胞電壓鉗實驗結果表明,Con-G的5位Leu和Con-T的10~21位氨基酸是影響其配體-NMDA受體亞基選擇性的重要因素。所以,進行conantokins分子改造時不僅要保留重要氨基酸位點,而且還要盡量保留影響配、受體亞基結合的結構。以便在提高conantokins類似物活性的同時,保持其與NMDA受體相對高的親和力。
N端相對保守,對於維持肽段活性意義重大,分子設計應該盡量不作改變;C端相對次要,在有限的範圍內減少若干氨基酸殘基,雖然肽段活性降低,但可通過增大給藥劑量來維持原有效應,且減少氨基酸數目可縮小分子,有可能使conantokins經外周給葯即可透過血腦屏障進入中樞,簡化其給藥方式。
20世紀60年代在澳大利亞首次發現芋螺獵食魚類。研究證實不同芋螺毒具有不同的生物活性組分。1997年從芋螺毒中純化一個活性肽,並成功測定了其氨基酸組成,這個肽就是μ-芋螺毒素。第一個被弄清氨基酸序列並被化學合成驗證了的芋螺毒活性肽是α-芋螺毒素GI,它是從地紋芋螺(Conus geographus)毒中純化出來的,含2個二硫鍵,由13個氨基酸殘基組成,是一種煙鹼能型強拮抗劑,其作用類似於蛇毒神經毒素(如α-bungarotoxin,Cobratoxin)。緊接著從地紋芋螺毒中分離鑒定出另一種活性肽,是鈉通道的阻斷劑,其作用類似於Tetrodotoxin和Saxitoxin,它可引起哺乳動物麻痹反應。這兩種肽是引起采螺人死亡的主要原因。
通過觀察了對小鼠和金魚注射contryphan-R后的行為學表現發現,對金魚肌肉注射后,金魚很快出現震顫、麻痹等癥狀。對小鼠顱腔注射時,低劑量(0.5~6.0nmol/g)可產生騷抓、舔咬、豎尾、桶狀翻滾癥狀等;高劑量(8~20nmol/g)則會表現出抽搐、驚厥、癱瘓乃至死亡。產生這些行為學異常的具體機制尚不清楚。芋螺毒素特異性地作用於多種離子通道與神經受體,對魚的毒性多在1~10μg/Kg之間。
20世紀80年代初,美國猶它大學的研究人員直接將芋螺毒組分注射到哺乳動物中樞神經系統,而拋開當時該實驗室乃至大多數實驗室已長期慣用的所謂的標準方法即腹腔內膜注射法(i.p.),結果顯示,用顱腔注射法引發了大量的小白鼠不同的行為癥狀反應,這揭示了芋螺毒的藥理多樣性;而用i.p法,只有很小比例的小白鼠產生穩定可測的癥狀反應。為了進行針對性研究而從這些癥狀反應中選擇了一種“似睡”現象,把從芋螺毒中分離出的控制這種“似睡”現象的活性組分命名為“睡蟲”肽(sleeper),它能使年齡不到14天大的小白鼠進入“似睡”狀態。而如果將這種“睡蟲”肽注射到年齡為21天大的小白鼠顱腔,小白鼠卻表現出超活躍癥狀反應,即小白鼠不停地在籠子四周邊緣攀爬且從一角落跑到另一個角落。正因這種肽能誘發不同年齡大小的小白鼠表現出不同的癥狀反應,所以人們又將其稱為“睡蟲或爬蟲”(sleeper or cleeper)肽。還有人從芋螺毒中純化了“搖蕩”肽(shaker),該肽引發小白鼠顫抖。
逐漸減少睡眠肽的C端氨基酸殘基后其活性逐漸下降,保持其活性存在的最短肽段為Con-T。而減少Con-R的C端氨基酸殘基數目,其活性下降不是十分明顯,Con-R尚且能夠保持原始肽段活性不變,但是從Con-R開始,活性便逐漸下降,保持Con-R活性存在的最短肽段為Con-R。Con-G活性受C端氨基酸殘基數目影響較大,Con-G活性逐漸降低,保持Con-G活性存在的最短肽段為Con-G。Blandl等發現,Con-R誘導小鼠睡眠持續時間為2~4h,小於Con-R引發的6~8h睡眠時間。由於放射性配體結合實驗顯示兩肽段的活性相同,因此推斷是由於Con-R分子C端的二硫鍵結構導致其體內半衰期延長,進而延長了小鼠睡眠持續時間。
從幻芋螺(C.magus)毒中純化的“搖蕩”肽(shaker peptide)和從地紋芋螺(C.geographus)毒中發現的另一個“搖蕩”肽都能抑制青蛙神經肌肉連接處的鈣流和突觸傳遞。這表明“搖蕩”肽可能作用於控制神經遞質釋放的一種新型鈣通道。採用電生理技術分析鑒定新鈣流研究“搖蕩”肽影響鈣通道及鈣流,結果發現了一種新型鈣導,即N-型鈣流,這些“搖蕩”肽專一地強有力地抑制N-型鈣流。這些“搖蕩”肽就是μ-conotoxinGVIA和μ-conotoxinMVIIA。在神經科學領域,μ-conotox-inGVIA可能會成為僅次於Tetrodotoxin的一種研究工具探針,因為它在抑制突觸傳遞和判斷N型鈣流是否存在這兩方面很有用。
芋螺毒素構象
芋螺毒素構象圖冊參考資料。
芋螺毒素的組合作用機制突出的表現為不同毒理作用之間的協同組合上,亦即以高度組織化的“毒素集團”發揮其功能。已經了解的此種組合作用機制有兩種模式。一種模式稱為“休克+麻痹”作用,如紫芋螺(C.purpurascens)有兩類不同作用的毒素,一類毒素可致被捕食生物立即產生類似電休克式的強直性癱瘓的快速作用,此類芋螺毒素包括可抑制Na+通道失活的δ-芋螺毒素以及抑制K+通道的κ-與κA-芋螺毒素,這些毒素可迅即使軸突纖維完全去極化,導致休克癥狀。紫芋螺毒液中的另一類毒素包括多類α-及μ-芋螺毒素,則可完全阻斷神經肌肉傳導,使被捕食生物長時間癱瘓,在這兩類不同作用的毒素的共同作用下,紫芋螺等一些食魚芋螺,既可以迅速捕捉魚類,又能從容的吞食它們。另一種模式稱為“安定+麻痹”作用,如地紋芋螺,被捕食生物進入其口腔時,並不發生被刺咬時常出現的驚厥狀況,而是非常安靜,表明地紋芋螺使用了不同於“休克+麻痹”的另一種模式,地紋芋螺中富含Conantokin-G、Contulakin-G等芋螺睡眠肽類,這些肽類可使被捕食生物感覺系統鈍化失活,處於安定睡眠狀態。然後再在α-及μ-芋螺毒素的作用下,進入麻痹癱瘓期,達到捕食目的。
電壓門控離子通道超家族是由一大族結構相似的膜結合蛋白組成的,它們受跨膜電壓變化的激活。這些蛋白質對單價陽離子具有不同的選擇性,按照慣例被分為Ca2+,Na+,和K+通道。這些離子通道的最重要的生理作用是促使細胞電信號的產生、調整和轉換。電壓門控離子通道的主要孔洞形成α-亞基是由含有4個同源結構域的單一亞基組成的(如Na+和Ca2+通道),或由4個不同的亞基組成(如鉀通道)。α-亞基與輔助亞基相互作用並不是完整地形成一個孔洞,而是改變α-亞基的特性。在某種生理狀態下,當電壓門控離子通道被激活時,會經歷一個構象變化,致使陽離子選擇性地透過通道蛋白的孔洞。這種處於開放狀態的電壓門控離子通道可被其另外一種構象變化失活、從而使通道進入不傳導狀態,或者回到關閉狀態。電壓門控離子通道是多種生物毒素的作用靶標。越來越多的可與Na+,K+,和Ca2+通道的成孔α-亞基相互作用的芋螺毒素家族被研究鑒定。已知有3個不同的芋螺毒素家族作用於電壓門控離子通道,μ-CTX是Na+通道阻斷劑、μO-CTX抑制Na+通道的電導率、δ-CTX延遲或抑制Na+通道的快速失活。只有ω-CTX作用於Ca2+通道。
Ca2+通道為所有興奮性細胞膜的必要成分之一,Ca2+通道是由4或5個不同的亞基組成的複合物。觀察到的Ca2+通道在生理學和藥理學上的多樣性主要是由成孔α1-亞基的特性形成的。據此可分為L,T,N,P,R和Q類型,其中N類型的Ca2+通道只存在於神經元組織(如脊椎動物的中樞神經系統以及外周神經系統),它主要抑制神經遞質尤其是去甲腎上腺素從交感神經上釋放時Ca2+的進入。基於不同的生理學和藥理學特性,電壓敏感性鈣通道(鈣通道)由3個鈣通道家族組成,L-型鈣電流的通道屬於Cav1家族;P/Q-、N-、R-型鈣電流的通道屬於Cav2家族;T-型鈣電流的通道則屬於Cav3家族。其中L-型參與一些興奮-收縮∕分泌偶聯和心肌的活動;T-,N-,P-,Q-和R-型參與神經遞質的釋放。
芋螺通過其魚叉樣小毒箭螫刺傷與其接觸的裸潛、捕撈人員、游泳者及其他海洋作業人員,造成局部皮膚損傷,毒素吸收后導致全身中毒。誤食或吃法不當也可引起全身中毒。尚無有效的治療方法,一般採用對症療法和支持療法。
在藥理學上,芋螺毒素表現為配體和電壓門控的NM-DA受體非競爭性拮抗劑。NMDA受體屬於離子型谷氨酸受體亞家族,介導Ca2+跨膜內流,為興奮性氨基酸受體,由3種亞基組成:NR1、NR2(A-D)和NR3(A-B)。NR1是功能亞基,可單獨構成離子通道,NR2和NR3是調節亞基,不能單獨構成離子通道,分別增強或抑制NR1亞基的功能。NMDA受體發揮功能至少需要NR1和NR2的表達,NR3不是NM-DA受體發揮功能所必需的。研究發現,Con-G特異性拮抗含NR1/NR2B亞基的NMDA受體,Con-T與Con-R拮抗含有NR1/NR2A/NR2B及NR1/NR2B亞基的NMDA受體,而同種conantokins的不同類似物對NMDA受體的拮抗活性也存在差別。由於NMDA受體的亞基組成在生物發育過程中存在時空特異性以及疾病發生、發展過程中的階段特異性,因此,芋螺毒素對疾病不同發展階段和不同部位可能存在不同作用。
研究發現,Conantokins4個成員N端前4位氨基酸殘基均相同,為分子中的保守序列,足以說明該結構的重要,Con-R與Con-L甚至N端前15位氨基酸均相同。而Con-R對雜訊誘導驚厥小鼠的保護指數為17.5,而Con-L的保護指數僅為1.2,表明二者C端序列差異是影響其抗驚厥活性的主要因素。研究發現,Con-R的N端前5位氨基酸殘基中任何一個發生改變,多肽的活性都要下降11~1000倍,因此認為Con-R與NMDA受體結合併發生作用的關鍵序列就是這5個氨基酸殘基以及緊隨其後的兩個轉角並與其位於α螺旋同一側面的其他氨基酸殘基。
研究顯示,癲癇病人NMDA受體NR2B亞基的mR-NA較對照組增高,表明NMDA受體NR2B亞基功能上調可能參與癲癇發病,選擇性作用於NR2B亞基的Con-G可能具有治療癲癇的潛力。動物實驗顯示,Con-G抗大鼠癲癇的半數有效劑量(median effective dose,ED50)在雜訊誘發組為3.5pmol;電擊誘發組為25.9pmol;戊四唑誘發組為28.7pmol;木防已苦毒素誘發組為50pmol,這表明Con-G對不同原因引起的癲癇都有潛在治療作用,顯示出廣譜、高效的抗癲癇活性。與其他NMDA受體非選擇性拮抗劑相比,Con-G可劑量依賴性地阻斷刺激大鼠角膜激發的癲癇發作。側腦室單次注射Con-G顯示出快速、持久的藥效。通過比較,Con-G的作用特點類似廣譜抗癲癇葯2-丙基戊酸鈉。研究還發現,Con-G與其他NMDA受體拮抗劑以及標準抗癲癇葯相比,其有效劑量(ED50)與毒性劑量(TD50)跨度更大。此外,Con-R也被證明在4種動物癲癇模型上效果優於艾芬地爾(ifenprodil)和地佐環平(dizocilpine,MK-801),側腦室微量給葯即可阻斷雜訊誘發小鼠癲癇發作,並可部分阻斷癲癇陣攣發作,且該劑量遠低於毒性劑量。這表明,Con-G、Con-R在有效治療劑量範圍內不引起毒性作用,安全性比現有抗癲癇藥物更好。
含NR2B亞基的NMDA受體在痛覺信息傳遞和痛覺敏化的形成過程中扮演重要作用。因此,針對NR2B亞基的NMDA受體拮抗劑conantokins具有對疼痛潛在的治療作用。有研究表明,給小鼠鞘內注射Con-G和Con-T,均能減輕福爾馬林誘導的Ⅱ相痛、坐骨神經結紮后的痛覺過敏和弗氏完全佐劑(Complete freund’sAdjuvant,CFA)導致的誘發痛。另外,它們發揮鎮痛作用的劑量和出現副作用的劑量相差20倍以上。這表明,Con-G和Con-T在有效的鎮痛劑量範圍內幾乎無任何副作用,是一種理想的鎮痛藥物。
NMDA受體過度激活可以造成胞內Ca2+超載,引發細胞死亡,採用conantokins治療腦缺血損傷成為新近研究的熱點。Williams等採用SD大鼠胚胎腦細胞進行研究發現,Con-G將十字孢鹼(staurosporine)誘導的細胞凋亡存活率提高60%,高於艾芬地爾和地佐環平,在此基礎上他們發現Con-G能夠顯著減少大腦中動脈阻塞大鼠腦梗死面積,具有8h的保護期。此外,Con-G不僅能夠有效減少中腦動脈阻塞大鼠梗死灶細胞c-fos的基因表達,且能夠增加抗凋亡基因bcl-2陽性細胞數並減少損傷區域DNA斷裂數量。這表明Con-G具有潛在的神經細胞保護作用,提示其具有抗腦缺血損傷的潛力。
由於NMDA受體參與精神活性物質獎賞效應的形成,因此conantokins對於精神活性物質成癮具有潛在干預作用。魏娟娟等觀察到Con-G使嗎啡依賴小鼠平均跳躍次數減少89%,並呈劑量依賴性,相同劑量Con-G[S16Y]可完全抑制嗎啡依賴小鼠戒斷跳躍;而Con-R[1-17]僅使嗎啡依賴小鼠平均跳躍次數減少40.2%~58.3%。可見,Con-G和Con-G[S16Y]抗嗎啡依賴藥效強於Con-R[1-17],其原因可能是Con-G和Con-G[S16Y]對NMDA受體NR2B亞基的選擇性高於Con-R[1-17]。
Conantokins對帕金森病也顯示出一定治療作用。給帕金森病大鼠注射Con-G進行干預,發現它能夠呈劑量依賴性地加強左旋多巴誘導的大鼠旋轉。另一項研究表明,Con-G可以增強甲基苯丙胺誘導大鼠的行為學效應。其原因可能是甲基苯丙胺可以促進多巴胺釋放,Con-G給葯間接增強了多巴胺激動劑的藥效。該結果提示,conantokins具有治療帕金森病的臨床應用潛力。
芋螺毒素藥用研究的其他方向還有:具有去甲腎上腺素轉運蛋白抑制作用的T家族芋螺毒素,可用於治療抑鬱症。以及抑制α1-腎上腺素受體的一些芋螺毒素,可用於治療良性前列腺過度增生引起的尿失禁。