非那雄胺片
5-α還原酶抑製劑
非那雄胺片適用於治療和控制良性前列腺增生(BPH)以及預防泌尿系統事件,降低發生急性尿瀦留的危險性,降低需進行經尿道切除前列腺(TURP)和前列腺切除術的危險性;可使肥大的前列腺縮小,改善尿流及改善前列腺增生的有關癥狀。前列腺肥大的患者適用於本品治療。
【生產企業】
公司名稱:Merck Sharp & Dohme Limited
地址:Hertford Road, Hoddesdon, Hertfordshire, EN11 9BU, United Kingdom
生產廠名稱:MSD International GmbH(Puerto Rico Branch)LLC
地址:Road #2, Kilometer 60.3, Sabana Hoyos, Arecibo, PR 00688, Puerto Rico
包裝廠名稱:Merck Sharp & Dohme Limited
地址:Shotton Lane, Cramlington, Northumberland, NE23 3JU, United Kingdom
【化學結構式】
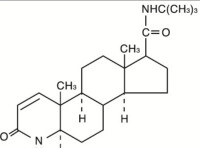
化學結構式
【適應症】
1、本品適用於治療和控制良性前列腺增生(BPH)以及預防泌尿系統事件
—降低發生急性尿瀦留的危險性。
—降低需進行經尿道切除前列腺(TLRP)和前列腺切除術的危險性。
2、本品可使肥大的前列腺縮小改善尿流及改善前列腺增生有關的癥狀,前列腺肥大患者適用於本品治療。
【用法用量】
推薦劑量是每天1片,每片5毫克,與或不與食物同服。
腎功能不全患者劑量
老年人劑量
儘管葯代動力學研究顯示70歲以上患者非那雄胺的清除率有所降低,但不需調整給藥劑量。
本品具有良好的耐受性。
在PLESS研究中對1524名患者每天服用5毫克本品和1516名患者服用安慰劑進行了為期4年多的安全性評價。4.9%(74名患者)由於與本品有關的不良反應而中斷治療與之相比安慰劑組是33%(50名患者)。服用本品的患者中37%(57名患者)以及安慰劑治療的患者中2.1%(32名患者)由於與性功能有關的不良反應而中斷治療,這是報道最多的不良反應。
在4年多的研究中被研究人員認為可能,很可能和確定與本品有關發生率≥1%且大於安慰劑的臨床不良反應主要是性功能受影響、乳房不適和皮疹。在研究的第年中服用本品的患者8.1%發生陽痿而用安慰劑的患者為3.7%.性慾降低者為6.4比3.4%.射精降礙為0.8比0.1%。在研究的第二至第四年中,兩個治療組間這三種不良反應的發生率沒有明顯差異。第二至四年的累積發生率陽痿(本品5.1%.安慰劑5.1%).性慾降低(2.6%;2.6%1;射精障礙(0.2%.0.1%)。
在第一年中用本品和安慰劑射精量減少的患者分別為3.7和0.8%,在第二至四年中累積發生率本品為1.5%、安慰劑為0.5%。在第一年中報道本品組和安慰劑組出現乳腺增生為(0.5%,0.1%).乳房觸痛(0.4%.0.1%)以及皮疹(0.5%,0.2%)。第二至四年的累積發生率,乳腺增生1.8%,1.1%).乳房觸痛(0.7%,0.3%).及皮疹(05%,01%)。
在為期一年、安慰劑對照的III期臨床研究以及五年延長期(853名患者延長治療至五到六年)的研究中,不良反應的情況與在PLESS中二至四年的報道相似。未發現隨本品治療期延長而增的不良反應。新出現的與藥物有關的性功能方面的不良反應的發生率隨治療時間的延長而降低。
其他長期研究資料
在一項為期7年,安慰劑對照的臨床研究中,共人選了18,882名健康男性。在其中9060名男性進行前列腺針吸活組織檢查的數據分析中,觀察到前列腺癌的發生在本品中有803名(18.4%);在安慰劑組中有1147名(24.4%)。通過前列腺針吸活檢資料發現患前列腺癌在Gleason評分為7-10的在本品組中有280名(6.4%),而在安慰劑組中有237名(5.1%)。進一步分析顯示在本品組的高評分前列腺癌病人的增加可能由於因為本品對前列腺體積的作用而產生的檢測偏差而引起。在此項研究中所有被診斷為前列腺癌的病例中,大約98%的病人在診斷時被歸類為囊內腫瘤(臨床T1期或T2期)。Gleason評分7-10的臨床意義尚不清楚。
乳腺癌
在入選了3047名男性、為期4-6年,與安慰劑和對照葯進行對照的MTOPS研究中接受非那雄胺治療的男性中有4例乳腺癌病例,未接受非那雄胺治療的男性中沒有乳腺癌病例。在入選了3040名男性為期4年安慰劑對照的PLESS研究中接受安慰劑治療的男性中有2例乳腺癌病例但接受非那雄胺治療的男性中沒有乳腺癌病例。在入選了18882名男性、為期7年、安慰劑對照的前列腺癌預防試驗(PCPT)中.接受非那雄胺治療的男性中有1例乳腺癌病例,接受安慰劑治療的男性中有1例乳腺癌病例。已有關於使用非那雄胺的男性中發生乳腺癌的上市后報告。非那雄胺的長期使用與男性乳腺腫瘤形成之間的關係尚未知。
產品上市后經驗
以下是產品上市后報道的與保列治和/或低劑量非那雄胺有關的不良反應。由於這些不良反應是規模不確定的人群自發報告的因而有時不可能對其發生率進行可靠地評估或者確定其與藥物暴露之間的因果關係。
精神疾病:抑鬱。
生殖系統和乳腺疾病:睾丸疼痛在停止治療後繼續存在的勃起功能障礙男性不育和/或精液質量差。已有報告稱停止非那雄胺用藥后精液質量恢復正常或出現改善。
實驗室化驗結果
評價實驗室檢查結果時,應考慮到服用本品的患者(見注意事項)PSA水平降低的情況。
服用本品或安慰劑的患者中,標準實驗室參數沒有其它差別。
本品不適用於婦女和兒童。
本品禁用於以下情況.
.對本品任何成份過敏者。
.妊娠——懷孕和可能懷孕的婦女(見孕婦及哺乳期婦女用藥)。
一般注意事項
對於有大量殘留尿和/或嚴重尿流減少的患者,應該密切監測其堵塞性尿路疾病。
對PSA及前列腺癌檢蠢的影響
目前為止,用本品治療前列腺癌患者還未見臨床療效。在對照的臨床研究中,通過系列PSAs和前列腺活檢,對前列腺增生和前列腺特異抗原(PSA)升高的患者進行監測。這些對前列腺增生的研究中,本品未改變前列腺癌的檢測率,並且使用本品與使用安慰劑的患者前列腺癌的總發病率沒有顯著差異。
建議在接受本品治療前及治療一段時間之後定期做直腸指診,以及其它的前列腺癌檢查。血清PSA也用於前列腺癌的檢查。一般來說,基線PSA>10納克/毫升(Hybritech)則提示應進一步檢查並考慮活檢;PSA水平在4和10納克/毫升之間建議作進一步檢查。在患有或未患有前列腺癌的男性中PSA水平存在一定的重疊。因此,患前列腺增生的男性,不管是否服用本品,若PSA值在正常參考範圍內並不能排除前列腺癌的可能性。若基線PSA<4納克/毫升也不能排除前列腺癌。
即使伴有前列腺癌,本品可使前列腺增生患者血清PSA濃度大約降低50%。在評價PSA數據且不排除伴有前列腺癌時,應考慮本品會使前列腺增生患者的血清PSA水平降低。雖然患者有個體差異,在PSA數值範疇數據,其降低程度是可預測的。對來自3000多名患者的雙盲、安慰劑對照的4年期本品長期療效和安全性研究(PLESS)的PSA數據的分析證明,典型患者使用本品治療6個月或更長,與未經治療的男性正常PSA值比較,其PSA值應該加倍。這種調整不但保留了PSA檢測的靈敏性和特異性,而且保持它檢查前列腺癌的效能。
應謹慎評價使用非那雄胺治療的患者的PSA水平持續增高,包括考慮本品治療的非依從性。
本品不會引起遊離PSA百分比(遊離PSA/總PSA)的顯著下降,而且在本品的影響下遊離PSA/總PSA值保持恆定。當遊離PSA百分比用於檢測前列腺癌時,其值無需調整。
藥物/實驗室檢查相互作用
對PSA水平的影響
血清PSA濃度與患者年齡和前列腺體積有關,而前列腺體積又與患者年齡有關。當評價PSA實驗室測定結果時,應考慮接受本品治療的患者PSA水平降低的事實。大多數患者,在治療的第一個月內PSA迅速降低,隨後PSA水平穩定在一個新的基線上。治療后基線值約為治療前基線值的一半。因此,用本品治療六個月或更長的典型患者,在與未經治療男性的正常PSA值相比較時PSA值應該加倍。臨床解釋見注意事項–對PSA和前列腺癌檢查的影響。
【孕婦及哺乳期婦女用藥】
本品禁用於懷孕或可能受孕的婦女(見【禁忌】)。
接觸非那雄胺——對男性胎兒的危險性
由於存在吸收非那雄胺后,繼而對男性胎兒產生危險的可能性,當婦女懷孕或可能受孕時,她們不應觸摸本品的碎片和裂片。本品為包衣片,在正常情況下可避免接觸其活性成份。因此,所提供的藥片應沒有破裂。
【哺乳婦女】
本品不適用於女性。
尚不知非那雄胺是否從人乳汁排泄。
【兒童用藥】
本品不適用於兒童。
兒童用藥的安全性和有效性資料還未確定。
【老年用藥】
見[用法用量]項的具體描述。
尚未確定具有臨床重要意義的藥物相互作用。本品對細胞色素P450-相關的藥物代謝酶系統沒有明顯影響。在男性中已被檢測的化合物有普萘洛爾、地高辛、格列本脲,華法林、茶鹼和安替比林,它們均未發現與本品有臨床意義的相互作用。
其它聯合治療
雖然沒有進行特異的藥物相互作用研究,但在臨床研究中本品與血管緊張素轉換酶抑製劑、對乙醯氨基酚、乙醯水楊酸、a-阻滯劑、b-阻滯劑、鈣通道阻滯劑,心臟病用硝酸酯類,利尿劑,H2拮抗劑,HMG-CoA還原酶抑製劑,非甾體抗炎葯(NSAIDs),喹諾酮類和苯二氮卓類同時使用時,沒有發現明顯的臨床不良相互作用。
【藥物過量】
服用本品單次劑量高達400毫克,以及服用本品多次劑量每天80毫克共3個月的患者未見不良反應。
對本品用藥過量沒有推薦的特異治療。
本品為一種4-氮雜甾體化合物,它是睾酮代謝成為更強的雄激素雙氫睾酮(DHT)過程中的細胞內酶-II型5-還原酶的特異性抑製劑。而良性前列腺增生(BPH)或稱作前列腺肥大取決於前列腺中睾酮向DHT的轉化。本品能非常有效地減少血液和前列腺內DHT。非那雄胺對雄激素受體沒有親和力。
臨床藥理學
良性前列腺增生(BPH)主要發生於50歲以上的男性患者,並且隨著年齡的增加發病增多。流行病學研究顯示前列腺增大者發生急性尿液瀦留和需要進行前列腺手術的危險性增加3倍。患有前列腺增大的男性出現中等至嚴重程度泌尿系統癥狀和尿流率下降的可能性是前列腺較小的男性的3倍。
前列腺的發育和增大以及隨後出現的良性前列腺增生(BPH)有賴於體內有效的雄激素雙氫睾酮(DHT)的含量。睾酮由睾丸和腎上腺分泌,然後快速被主要分佈於前列腺、肝臟和皮膚中的II型5a-還原酶轉化成雙氫睾酮(DHT),然後優先結合於這些組織中的細胞核。
非那雄胺是人類II型5a-還原酶競爭性抑製劑,能慢慢與II型5a-還原酶形成穩定的酶複合物。這一複合物的循環過程非常緩慢(t1/2為30天)。體內和體外試驗證明非那雄胺是II型5a-還原酶的特異性抑製劑,與雄激素受體沒有親和力。
單劑量給予5mg的非那雄胺后可使血清DHT濃度快速下降,最大效應出現於給葯后8小時。血漿非那雄胺濃度在24小時內有變化,而這一時期內血清DHT水平仍然保持不變,說明血漿藥物濃度與血漿DHT濃度不直接相關。
BPH患者以5mg/天劑量服用非那雄胺4年後,血循環中的DHT濃度大約平均降低70%,並且伴有前列腺體積縮小約20%。此外,PSA比基線值降低了大約50%,說明前列腺上皮細胞生長減少。DHT水平的抑制、增生的前列腺的退化並伴有PSA水平的降低在研究的4年中能一直維持。在這些研究中,睾酮的血循環水平大約增加10-20%,但仍在生理水平範圍內。
擇期進行前列腺切除術的病人服用本品7-10天後,可引起前列腺內DHT水平降低大約80%。前列腺內睾酮的水平增加至治療前的10倍。
健康志願者使用本品治療14天後停葯,DHT水平在大約2周內回復至治療前的水平。治療3個月的病人,其前列腺的體積縮小大約20%,停葯3個月後,又返回至接近基線值。
與安慰劑相比,非那雄胺對血循環中的皮質醇、雌二醇、催乳素、甲狀腺刺激激素或甲狀腺素的循環水平沒有影響。對血脂(如總膽固醇、低密度脂蛋白、高密度脂蛋白和甘油三酯)或骨密度沒有具臨床意義的影響。治療12個月的病人黃體激素(LH)增加約15%,促卵泡激素(FSH)增加約9%;但是這些激素水平仍在生理範圍內。促性腺激素釋放激素刺激生成的LH和FSH的水平沒有改變,說明沒有影響垂體睾丸軸的調節控制。給予健康男性志願者本品24周以評價精液參數,結果顯示本品對精子濃度、活動度、形態或pH值沒有具臨床意義的影響。試驗中觀察到射精量平均減少0.6ml,伴有每次射精的精子總量減少。這些參數仍在正常範圍內,並且停止用藥后可以逆轉。
非那雄胺可以抑制C19和C21類固醇代謝,因此對肝臟和外周的II型5a-還原酶均有抑制作用。血清DHT代謝產物雄烯二醇葡萄糖苷酸和雄甾酮葡萄糖苷酸也顯著減少。這一代謝模式與在先天性II型5a-還原酶缺乏的患者中觀察到的相似,後者體內DHT的水平明顯降低,前列腺較小,並且不會患BPH。這些個體在出生時有泌尿生殖缺陷和生化異常,但沒有因II型5a-還原酶的缺乏造成其他重要的臨床疾患。
動物藥理學
在雄性大鼠和犬體內試驗中證實了非那雄胺抑制5a-還原酶和阻止DHT形成的能力。試驗是為了證實前列腺DHT水平的降低或前列腺體積的縮小。大鼠皮下注射0.1mg的非那雄胺4小時后,出現前列腺DHT濃度的降低。犬口服給予1mg/kg的非那雄胺(18小時內分4次給予),在最後一次給葯后6小時出現前列腺DHT濃度的降低。這些研究證明了非那雄胺在體內可以阻止DHT形成。
DHT濃度的降低導致了前列腺體積減小。性成熟犬口服給予每天1mg/kg的非那雄胺,共6周出現前列腺體積縮小。給葯前和給葯后前列腺體積的比較顯示非那雄胺可以使前列腺體積縮小40%以上。相似效應出現於給予睾酮的未成熟雄性去勢大鼠中。口服劑量為0.1mg/天的非那雄胺可明顯抑制外源性睾酮對附屬性腺的生長作用,這是由於對5a-還原酶的特異性抑制作用。每天2.5mg的非那雄胺不能抑制外源性DHT對實驗動物精囊和前列腺的促生長作用。
本品在大鼠前列腺胞液中與雄激素受體沒有親和力,因此沒有直接的抗雄激素活性。濃度高達10M的非那雄胺不能防止H-DHT的結合,而未標記的DHT抑制其結合,IC50為2.9nM。
在大鼠、小鼠或兔體內進行的標準試驗證實非那雄胺不能抑制促性腺激素分泌或顯示任何抗雌激素、親子宮、抗孕激素、雄激素樣或孕激素樣活性。這些數據與非那雄胺是特異性5a-還原酶,沒有其它激素樣活性相一致。
在肝臟毒性試驗中,犬口服給予每天40mg/kg的非那雄胺28天。取靜脈血測定ALT(SGPT)和AST(SGOT)。兩項轉氨酶均沒有升高,說明非那雄胺不會引起肝臟損傷。
其它一些藥理學研究用於評價非那雄胺對器官系統和生物學參數的影響。犬腎臟、胃或呼吸功能,以及犬和大鼠的心血管功能均沒有重要改變。
雄性和雌性小鼠非那雄胺口服LD50約為500mg/kg。雌性和雄性大鼠非那雄胺口服LD50分別為400和1000mg/kg。
致癌和致突變作用
大鼠給予劑量高達每天320mg/kg的非那雄胺(相當於人建議使用劑量每天5mg的3200倍)24個月試驗顯示沒有致癌作用。
小鼠為期19個月致癌試驗中,每天250mg/kg組(相當於人建議使用劑量每天5mg的2500倍)睾丸Leydig細胞腺瘤的發生率出現具有統計學意義的顯著性增加(P≤0.05);小鼠給予2.5或每天25mg/kg后沒有出現腺瘤(分別是人建議使用劑量的25和250倍)。
小鼠給予劑量為每天25mg/kg和大鼠給予每天40mg/kg以上(分別為人建議使用劑量每天5mg的250倍和400倍以上),均觀察到Leydig細胞增生的發生率增加。在給予高劑量非那雄胺的兩種嚙齒類動物試驗中均證實Leydig細胞增生改變和血清黃體激素(LH)增加(高於對照組2-3倍)有相關性。提示Leydig細胞改變源於血清LH水平的升高,而不是非那雄胺的直接效應。
大鼠或犬給予劑量為每天20和45mg/kg的非那雄胺(分別為人建議使用劑量每天5mg的200倍和450倍)一年或小鼠給予劑量為每天2.5mg/kg的非那雄胺(為人建議使用劑量每天5mg的25倍)19個月均沒有出現與藥物有關的Leydig細胞改變。
體外細菌致突變試驗、哺乳動物細胞致突變試驗或體外鹼性洗脫試驗均顯示沒有致突變作用。體外染色體畸變試驗中,中國倉鼠卵巢細胞給予高濃度(450-550μmol)的非那雄胺后出現染色體畸變輕度增加。這些濃度相當於人給予5mg的非那雄胺產生的血漿峰濃度的4000-5000倍。此外,體外試驗中使用的濃度450-550umol在生物系統中是無法達到的。在小鼠體內染色體畸變試驗中,非那雄胺在最大可耐受劑量下(每天250mg/kg,為人建議使用劑量每天5mg的2500倍)沒有觀察到與給葯有關的染色體畸變數增加。
生殖毒性試驗
性成熟雄性兔給予每天80mg/kg的非那雄胺(為人建議使用劑量每天5mg的800倍)12周,沒有出現生育力、精子數或射精量的改變。
性成熟雄性大鼠給予同樣劑量的非那雄胺6或12周后,對生育力沒有顯著影響;但是如果繼續給葯至24周或30周,則出現生育力和受孕率的顯著降低,伴有精囊和前列腺重量的顯著降低。所有這些效應在停止給葯6周后可恢復。
使用非那雄胺的大鼠生育力的降低是繼發於其對附屬性器官前列腺和精囊的作用而導致精栓形成失敗。精栓在大鼠正常生育中是必須的,但與人類無關,因人不形成交配栓。大鼠和兔的睾丸或交配行為沒有出現與給葯有關的改變。
發育毒性試驗
懷孕大鼠給予劑量為每天100μg/kg-每天100mg/kg的非那雄胺(為人建議使用劑量每天5mg的1-1000倍),雄性後代出現劑量依賴性增加的尿道下裂,其發生率分別為3.6-100%。此外,當劑量≥每天30μg/kg(≥人建議使用劑量每天5mg的30%),懷孕大鼠的雄性後代的前列腺和精囊的重量降低,包皮分離延遲以及短暫的乳頭髮育;當劑量≥每天3μg/kg(≥人建議使用劑量每天5mg的3%),出現泌尿生殖道間距縮短。大鼠產生這些影響的關鍵期為懷孕第16-17天。
上述改變是II型5a-還原酶抑製劑的預期藥理作用。許多改變,如尿道下裂出現於在子宮內暴露於非那雄胺的雄性大鼠,這與那些報道的II型5a-還原酶先天缺陷的男性嬰兒類似。在子宮內暴露於任何劑量的非那雄胺的雌性後代均沒有異常影響。
大鼠懷孕後期和哺乳期給予非那雄胺導致第一代雄性後代生育力輕度降低(每天3mg/kg;為人建議使用劑量每天5mg的30倍)。給予非那雄胺的雄性大鼠(每天80mg/kg;為人建議使用劑量每天5mg的800倍)和未給予非那雄胺的雌性大鼠交配後生出的第一代雄性或雌性後代均沒有出現發育異常。
兔懷孕第6-18天暴露於劑量高達每天1000mg/kg的非那雄胺(為人建議使用劑量每天5mg的1000倍),其胎仔沒有出現畸形。
試驗研究了恆河猴在胚胎和胎仔發育期內懷孕第20-100天暴露於非那雄胺的子宮內效應,恆河猴比大鼠或兔能更好地預測對人類發育的影響。懷孕猴靜脈注射劑量高達每天800ng的非那雄胺(至少為攝入每天5mg的非那雄胺的男性精液導致懷孕婦女估計最高暴露量的60-120倍),沒有出現雄性胎仔畸形。為了證實恆河猴模型與人類胚胎髮育的相關性,懷孕猴口服給予極高劑量的非那雄胺(每天2mg/kg;相當於人建議使用劑量每天5mg的20倍或大約為由男性攝入每天5mg的非那雄胺導致的估計最高暴露劑量的100-200萬倍),導致雄性胎仔外生殖器畸形。雄性胎仔沒有出現其它畸形,雌性胎仔在任何劑量下均沒有出現與非那雄胺有關的異常。
男性單劑量口服給予C-非那雄胺后,給藥劑量的39%從尿液中以代謝產物的形式(實際上尿液中沒有藥物原形)排泄,總量的57%從糞便中排泄。在該項研究中確定的非那雄胺的兩個代謝產物,在非那雄胺對5a-還原酶的抑制活性中只起很小部分的作用。
相對於單劑量靜脈注射相關劑量,非那雄胺的口服生物利用度大約為80%。該生物利用度不受食物影響。非那雄胺在給葯后2小時左右達到最大血漿濃度,在給葯6-8小時后完全吸收。非那雄胺的平均血漿清除半衰期為6小時。蛋白結合率約為93%。非那雄胺血漿清除率和分佈容積分別約為165mL/min和76L。
重複給葯試驗證實非那雄胺隨時間推移有少量緩慢蓄積。每天給葯5mg后,非那雄胺血漿濃度的穩態谷值為8-10ng/mL,且持續穩定一段時間。
非那雄胺的消除率在老年患者中有一定程度的降低。隨著年齡的增加,半衰期也延長,18-60歲男性的平均半衰期約為6小時,70歲以上男性的平均半衰期約為8小時。這一發現沒有臨床顯著性,因此不用減低劑量。
伴有慢性腎功能障礙(肌酐清除率在9-55mL/min範圍內)的病人,單劑量給予C-非那雄胺后的分佈與健康志願者沒有差別。蛋白結合在腎功能障礙的患者體內也沒有改變。部分正常時由腎臟排泄的代謝產物從糞便中排泄。因此出現代謝產物糞便排泄增加,而相應地尿液排泄減少。伴有腎功能損害的非透析病人不需調整藥量。
服用非那雄胺7-10天後病人的腦脊液(CSF)中可回收到非那雄胺,但藥物不是主要集中在CSF中。每天服用本品5mg的患者精液中也回收到非那雄胺。在成年男性中,非那雄胺5g對血循環中的DHT水平沒有影響,而精液中非那雄胺的量比這一劑量還要少50-100倍(見動物毒理學,發育毒性)。
“變性”孩子帶來兩個新葯
早在上世紀60年代中期,默沙東的科研人員就開始了對男性荷爾蒙的研究,希望找到能治療青春期粉刺的新葯。當時主要有兩個已知的甾體類激素,睾丸酮和作用更強的二氫睾丸酮。從理論上講,如果能抑制將睾丸酮轉化為二氫睾丸酮的5-α還原酶,應該可以降低體內男性荷爾蒙的活動,從而阻止粉刺的生長。
但是,隨著項目的進展,公司意識到給青少年使用甾體類激素藥物是難以被社會接受的,市場營銷的困難很大,所以在上世紀70年代初期就終止了5-α還原酶抑製劑的研究。
幾乎同時,遠在加勒比海島國多米尼加的一家醫院裡,一個來自偏遠部落的小女孩接受了腹腔手術。醫生意外發現“她”實際是個男孩!這個看似毫不相干的花邊新聞給5a-還原酶抑製劑的研究項目帶來了轉機,並最終導致了兩個新葯的發現。
跟蹤研究發現,在那個偏遠部落里,許多男性出生時外生殖器呈雌性,所以被當成女孩來撫養。但到了發育期間,他們的雄性特徵開始顯現,並長出男性外生殖器,成為男人。而這些在發育期“變性”的男人進入老年以後不會脫髮變成禿頭,他們的前列腺相對都很小,而且老年時也不會增生。
進一步的分子遺傳學研究結果顯示,這些特殊的多米尼加男性體內二氫睾丸酮的含量大大低於正常人的水平,因為他們都缺少將睾丸酮轉化為二氫睾丸酮的5a-還原酶。這一結果讓默沙東的科學家們敏銳地意識到:5a-還原酶的抑製劑也可以降低正常人體內的二氫睾丸酮的含量,也應該可以用來防止和治療老年性的良性前列腺增生。
把靶標鎖定在前列腺之後,默沙東重新啟動了5a-還原酶抑製劑的研究項目。又經歷了十幾個冬夏之後,1992年默沙東的科研團隊終於將非那雄胺(保列治)投放市場,成為治療良性前列腺增生的第一個口服藥物。
保列治治療前列腺增生的成功使默沙東的科研人員有機會進一步研究5a-還原酶與男性型脫髮之間的聯繫。5年後,第二個5a-還原酶抑製劑藥物——保法止上市。保法止和保列治的有效成分是相同的,都是非那雄胺,只是劑型和劑量不同。
醫學界對那些多米尼加部落人的進一步研究還發現,那裡的男性除了不脫髮和沒有前列腺增生外,到目前為止還沒有發現前列腺癌的患者。為此,默沙東與美國國立癌症研究院合作,開展了大規模的長期臨床試驗,研究保列治對前列腺癌的防治作用,目前尚無定論。
保列治和保法止的發現又一次印證了著名科學家路易·巴斯德的名言:“機遇垂青於有準備之人。”60年代默沙東對男性荷爾蒙和5a-還原酶的研究,為日後保列治的研發打下了很好的基礎,為尋找這個代謝途徑里的相關葯靶做好了準備,所以20世紀70年代中後期有關多米尼加“變性人”的報道及其跟蹤研究立刻引起了默沙東科研人員的注意,抓住了這個貌似毫不相關,很容易被忽略的機會。
中國目前的基礎生物醫學研究尚在起步階段,中國的醫藥界精英應該注意積累各種常見病、多發病的病理知識,同時密切關注全球基礎生物醫學研究的新動向和新發現,做有準備之人。
——摘自《新葯研發的故事》
1994年保列治在中國上市
2006年,中國《BPH診斷治療指南》問世,同樣推薦了保列治作為治療前列腺增生的基本藥物,使得中國泌尿學界在前列腺增生的診療方面與世界接軌
2009年,2011年,2014年中國《BPH診斷治療指南》不斷更新,保列治一直處於治療BPH的重要地位。
● AUA指南
● EAU指南
● 中國《良性前列增生診斷和治療指南》
在一項本品長期療效和安全性研究(PLESS)中,對有中度至嚴重前列腺增生癥狀的3016名服用4年本品的患者前列腺增生相關的泌尿系統事件(外科介入[如,經尿道切除前列腺和其他前列腺切除術]或需插入導管的急性尿瀦留)進行了評價。在這項雙盲、隨機,安慰劑對照的多中心研究中,用本品治療使泌尿系統事件的總體危險性降低了51%,並伴有顯著且持續的前列腺體積縮小,以及持續的最大尿流速增高和癥狀改善。