蒽環類藥物
蒽環類藥物
蒽環類藥物以其嚴重的心臟毒性而著稱。它們能夠治療的癌症種類比任何其他類型的化療藥物都要多,並且使用它們的化療目前最有效的抗癌療法之一;可用於治療的癌症包括白血病、淋巴瘤、乳腺癌、子宮癌、卵巢癌和肺癌等。這就意味著,拓撲異構酶II抑製劑使拓撲異構酶II的複合物在DNA鏈斷裂之後才能更穩定,導致後者催化了DNA的破壞;同時,拓撲異構酶II抑製劑還能阻礙連接酶對DNA的修復。右雷佐生是一種心臟保護劑,能夠通過競爭性螯合鐵離子來減少蒽環類藥物產生的自由基數目。
蒽環類藥物(英語:Anthracyclines)或蒽環類抗生素(英語:Anthracycline antibiotics)是一類來源於波賽鏈黴菌青灰變種(Streptomyces peucetius var. caesius)的化療藥物。
這類藥物的主要副作用是心臟毒性,這極大程度地限制了它們的進一步使用。其他副作用包括骨髓抑制、嘔吐、脫髮等。
第一個被發現的蒽環類抗生素是柔紅黴素,由放線菌門的波賽鏈黴菌(Streptomyces peucetius)自然產生。不久之後科學家研製出了阿黴素,隨後又有很多衍生物被合成出來(儘管只有很小一部分在臨床上被投入使用)。
常用的蒽環類藥物包括:
● 柔紅黴素(道諾黴素)
● 阿黴素(多柔比星)
● 阿柔比星
● 表阿黴素(表柔比星)
● 伊達比星
● 戊柔比星(僅用於治療膀胱癌)
● 米托蒽醌(屬衍生物蒽醌類)
作為抗生素的一種,蒽環類藥物也具有抗菌活性,但由於毒性過大,它們從未被用於治療感染。
蒽環類藥物主要有三種作用機理:
⒈通過嵌入DNA雙鏈的鹼基之間,形成穩定複合物,抑制DNA複製與RNA合成,從而阻礙快速生長的癌細胞的分裂。
⒉抑制拓撲異構酶II,影響DNA超螺旋轉化成為鬆弛狀態,從而阻礙DNA複製與轉錄。有研究顯示拓撲異構酶II抑製劑(除蒽環類藥物還包括依託泊苷等)能夠阻止拓撲異構酶II的翻轉,而這點對於它從它的核酸底物上脫離是必需的。
蒽環類藥物以其嚴重的心臟毒性而著稱。這種心臟毒性可能由許多因素引起,包括對心肌細胞肌質網上蘭尼鹼受體的影響、心臟中自由基的產生及藥物代謝產物的蓄積。它們的心臟毒性通常表現為心電圖變化(尤其是QRS複合波的頻率變化)和心律不齊;心肌病及其引發的心力衰竭(有時數年後才表現出來)也時有發生。毒性主要與患者終生累積劑量有關。因此,在治療的過程中,醫生會根據藥物種類及患者情況計算所適用的終生劑量,當劑量達到上限的時候,一般來說會停止繼續使用蒽環類藥物(或者重新估算上限)。
有研究顯示蒽環類藥物引起心力衰竭的幾率不僅與劑量有關,還隨著接受治療之後的時間的推移而增加——由2年之後的2%到15年之後的5%。
除了保持在累積劑量上限以下之外,腫瘤科醫生還會使用許多其他方法降低心臟毒性。一般來說,在化療結束的3、6、9個月之後醫生會建議檢查一次心臟。此外,保護心臟的措施還包括了使用右雷佐生輔助化療,使用脂質體藥物,和改用持續靜脈滴註:
● 右雷佐生是一種心臟保護劑,能夠通過競爭性螯合鐵離子來減少蒽環類藥物產生的自由基數目。研究顯示它能夠將心臟毒性發生幾率減少約三分之二,同時並不影響化療的效果或者是總體生存率。
● 相對於普通蒽環類藥物來說,較少的脂質體藥物會被運輸到心臟,因此毒性較小。
● 持續靜脈滴注能夠減小藥物在心臟(尤其是左心室)中的的峰濃度。
1.柔紅黴素(道諾黴素)
第一代蒽環類抗腫瘤抗生素,用於各種類型的急性白血病(包括粒細胞性、淋巴細胞性和單核細胞性以及粒-單核細胞性)、紅白血病、慢性粒細胞性白血病、惡性淋巴瘤,也可用於神經母細胞病、尤因肉瘤和腎母細胞瘤等。
2.阿黴素(多柔比星)
抗瘤譜較廣,適用於急性白血病(淋巴細胞性和粒細胞性)、惡性淋巴瘤、乳腺癌、支氣管肺癌(未分化小細胞性和非小細胞性)、卵巢癌、軟組織肉瘤、成骨肉瘤、橫紋肌肉瘤、尤文肉瘤。腎母細胞瘤、神經母細胞瘤、膀胱癌、甲狀腺癌、前列腺癌、頭頸部鱗癌、睾丸癌、胃癌、肝癌等。
3.阿柔比星
阿柔比星對急性白血病、惡性淋巴瘤、胃癌、肺癌、乳腺癌和卵巢癌等有卓越療效,對阿黴素、柔紅黴素耐葯的病例亦有效,並且脫髮、口腔炎等均較輕。
此外,還有表阿黴素(表柔比星)、伊達比星、戊柔比星(僅用於治療膀胱癌)、米托蒽醌(屬衍生物蒽醌類)等。
另外,作為抗生素的一種,蒽環類藥物也具有抗菌活性,但由於毒性過大,它們從未被用於治療感染。
1.蒽環類藥物的心臟毒性的臨床類型
蒽環類藥物可引起心臟毒性分為早期和晚期,前者包括急性、亞急性和慢性。
1.1急性或亞急性心臟毒性
急性或亞急性心臟毒性在蒽環類藥物治療中或治療後幾天至數周發生,具有以下幾種特徵性表現:(1)QRS波低電壓、QT間期延長、非特異性ST-T段改變等;(2)一過性心律失常:以竇性心動過速最常見,也可出現發生各種室上性、交界性、室性心律失常;(3)各型房室和束支傳導阻滯。這些電生理學改變很少導致臨床癥狀,而亞急性心臟毒性導致急性左心衰竭、心包炎或致命的心包炎-心肌炎綜合征等情況也較少出現。
1.2慢性心臟毒性
慢性心臟毒性通常是指發生在化療結束后1年以內出現的心臟損傷,此類型在臨床上最為常見。其發生率與總劑量、峰值水平及是否同時合用其他具有心臟毒性的抗腫瘤藥物有關。以充血性心力衰竭和(或)心肌病為特徵,臨床癥狀發作多隱匿,多為不可逆改變。相關檢查可見心臟增大、左心室射血分數(LVEF)降低、ST-T段改變等,可迅速進展為雙室心衰,多在8周內死亡,死亡率高達30%~60%。
1.3晚期心臟毒性
晚期心臟毒性見於化療結束1年以後,主要包括隱匿性心室功能障礙、充血性心力衰竭及心律失常。晚期發作心臟毒性與藥物累積量及用藥次數呈正相關。患者日常生活無心功能損害的癥狀,但感染、手術、妊娠等應激情況可使心臟負擔加重,誘發癥狀出現。
2.病理
蒽環類藥物致心臟毒性會導致的心肌病理改變,包括許多亞細胞結構如核仁、線粒體、肌漿網、溶酶體、肌纖維等。隨著蒽環類藥物總劑量的增加,心肌損傷的程度逐漸加重,並從可逆性損傷轉變為不可逆性損傷,可觀察到的主要改變是:肌漿網擴張和肌纖維消失。病變早期階段,這些改變出現在散在的心肌細胞中,隨著心臟毒性的發展,病變細胞逐漸增加,大部分心肌受累。發展到晚期階段,出現散在的心肌細胞消失,由纖維組織取代。電鏡觀察可見T管系統和肌漿擴張融合,纖維失去肌動蛋白和肌球蛋白,間質細胞和纖維增生。這種病理改變是蒽環類抗癌藥所特有的,與病毒性心肌病變或缺血性心肌損傷截然不同。此病理改變影響心肌收縮力,從而導致心功能障礙。
3.發生機制
氧化應激學說、代謝產物學說、鈣超載學說、免疫反應學說等。
3.1自由基損傷學說
蒽環類抗腫瘤藥物心臟毒性的產生機制目前尚不十分明確,以往的大部分研究認為蒽環類藥物對心肌的損傷與其在體內形成大量自由基有關。蒽環類藥物中的蒽醌基團在多種還原酶及NADH脫氫酶等酶系統的作用下,還原為半醌自由基,再經過一系列電子傳遞過程生成超氧陰離子(O-2)和羥自由基(OH-)。這些自由基可以引起線粒體、微粒體脂質過氧化,對多種細胞產生強烈的損傷作用。正常心肌中抗氧化酶系如超氧化物歧化酶(SuperoxideDismutase,SOD)和谷胱甘肽過氧化物酶(GlutathionePeroxidase,GSH-Px)水平較其他組織低,而蒽環類抗腫瘤藥物又能降低心肌中GSH-Px及SOD的含量,使蒽環類抗腫瘤藥物產生的自由基及超氧化物不能被及時清除,而損傷心肌細胞。另外,蒽環類抗腫瘤藥物還可以通過非酶途
徑產生自由基,其對Fe3+有很高的親和力,產生蒽環-鐵螯合物,螯合物可以通過電子進行巰基化合物到氧分子間的傳遞。蒽環-鐵螯合物對心臟磷脂的親和力很高,當與心磷脂結合後會導致細胞器膜功能的損傷而產生心臟毒性。
3.2鈣超載及能量代謝障礙 正常心肌細胞中Ca2+大部分儲存於線粒體、肌漿網及肌膜上,Ca2+在維持心肌細胞興奮-收縮偶聯中起重要作用。蒽環類藥物可以通過激活肌漿網上的Ca2+通道,使肌漿網釋放到胞漿的Ca2+增加,細胞內遊離Ca2+濃度快速增加可影響心電活動從而導致各種心律失常,此為鈣超載。蒽環類藥物還能抑制心肌細胞肌漿網膜上的Ca2+-ATP酶基因表達,影響Ca2+-ATP酶的生物合成,使其活性降低,肌漿網攝取Ca2+能力下降,線粒體產生ATP減少,心肌能量代謝障礙,加重細胞損傷,甚至導致心肌細胞死亡。
3.3鐵離子代謝紊亂 研究發現,蒽環類藥物心臟毒性的另一重要機制可能是鐵調節蛋白-鐵效應原件結合的改變。正常生理條件下,心肌細胞內只有極少量的具有生物活性的遊離鐵,大部分鐵離子都是與鐵蛋白結合,以結合鐵的形式存在的。鐵蛋白則作為心肌細胞內鐵的主要儲存形式,可以防止鐵離子逸出,避免對組織和細胞的損傷。在病理條件下,某些還原劑可還原鐵蛋白,使之釋放有活性的Fe2+,通過參與催化Haber-Weiss反應,產生氧自由基,從而對心肌產生毒性作用。
其他理論:還有細胞凋亡學說、免疫反應學說等,但這些學說都尚未得到深入研究。
4預防措施
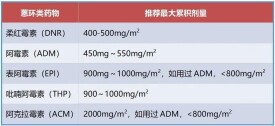
4.1限制累積劑量
限制累積劑量是預防蒽環類藥物心臟毒性的最重要的措施之一。阿黴素的累積劑量應限制在550mg·m以內,表柔比星的累積劑量應小於900mg·m,柔紅黴素、米托蒽醌等蒽環類藥物尚無明確的累積劑量被推薦。
4.2改變給藥方法
臨床研究發現,阿黴素緩慢靜脈輸注(>6h)可顯著減少藥物毒性,但其抗腫瘤效果可能受影響。
4.3脂質體蒽環類藥物的應用
目前應用的脂質體蒽環類藥物有脂質體柔紅黴素、脂質體阿黴素和聚乙二醇包被的脂質體阿黴素,這些藥物的應用既提高了療效,又減少了毒副反應。其中聚乙二醇包被的脂質體阿黴素較前兩者具有更長的藥物半衰期,它們療效相當,但心臟毒性的發生率更低。
4.4自由基清除劑
蒽環類藥物引起心肌毒性的最重要的機制是自由基產生並不能及時清除,而造成心肌損傷。故若使用自由基清除劑則可達到保護效果。如甲基黃酮醇胺可顯著降低蒽環類藥物誘導心肌損傷小鼠的血清肌酸激酶和乳酸鹽脫氫酶的含量,顯著增加心肌組織中SOD活性,增強氧自由基清除系統的功能,從而減輕氧自由基對心肌的損傷。
4.5鈣拮抗劑
鈣超載學說也是蒽環類藥物引起心肌毒性的另一重要的機制,故鈣離子拮抗劑也具有保護心肌作用。如鈣拮抗劑維拉帕米有已為大量的臨床治療研究證明有心肌保護性,其對蒽環類藥物誘導的活體脂質過氧化損傷有抑制作用。也有相關研究證實1,6-二磷酸果糖能促進ATP合成增加,將更多的鈣離子從肌漿漿液泵入肌漿網或細胞外,從而降低細胞鈣離子濃度。能通過降低心肌細胞內遊離鈣和對活性的改變,起到減輕阿黴素對心肌的毒性作用。
4.6線粒體保護劑
蒽環類藥物能引起心肌能量代謝障礙,而線粒體在能量代謝中起主要作用,所以應用線粒體保護劑也成為保護心肌的重要措施之一。西紅花酸能顯著降低線粒體DNA斷裂程度及升高線粒體膜電位,提高細胞色素C氧化酶活性及其亞基IImRNA表達水平,明顯降低心肌線粒體超氧陰離子含量,提高GSH-PX活性,由此表明西紅花酸能明顯減輕阿黴素心肌線粒體損傷。國內還曾有學者應用銀杏片、薯蕷皂苷片等藥物進行研究的,也得到心肌損害減少的結果。
4.7細胞凋亡抑製劑
雖然蒽環類引起細胞凋亡學說仍未深入研究,而且細胞凋亡抑製劑的作用也存在爭議,但越來越多的學者認為在蒽環類藥物所致的心肌病發生、發展過程中細胞凋亡發揮重要作用。研究發現,通過體內及體外實驗研究發現,脂聯素可以通過上調AMPK信號途徑來減輕阿黴素引起的心肌凋亡作用。
4.8鐵離子螯合劑
鐵離子螯合劑如右丙亞胺等。右丙亞胺是2-二氧丙嗪複合物,水解形成3種EDTA類似物,3種水解產物不僅可以與遊離態鐵離子螯合,而且可以從Fe3+-蒽環類葯螯合物中奪取Fe3+,從而減少氧自由基產生,進而抑制蒽環類藥物的心臟毒性。
4.9抗氧化劑
大量研究表明,一些具有抗氧化作用的藥物(如維生素E、維生素C、維生素A、N-乙醯半胱氨酸、谷胱甘肽、熊果酸、褪黑素等)的心臟保護作用並不理想。但對於褪黑素和維生素E,Wahab等[30]持有不同觀點。他們的研究表明褪黑素與維生素E具有明顯的心臟保護作用,尤以褪黑素更為顯著,且二者均有助於提高蒽環類藥物的抗腫瘤作用。所以褪黑素的心肌保護作用是否理想還有待進一步研究。黃酮類化合物(如槲皮素、monoHER、quercitrin等),具有鐵螯合作用、抗氧化作用和碳醯還原酶抑制作用,因而能夠減輕蒽環類藥物的心臟毒性]。
4.10中藥