三酸兩鹼
硝酸、硫酸、碳酸鈉等物質合稱
三酸兩鹼,即硝酸(HNO₃)、硫酸(H₂SO₄)、鹽酸(HCl)和氫氧化鈉NaOH、碳酸鈉Na2CO3。但碳酸鈉不是鹼,是鹽,俗稱純鹼、蘇打,顯鹼性。
酸是由氫元素和酸根組成的化合物如:硫酸(H2SO4)、鹽酸(HCl)、硝酸(HNO3) 鹼是由金屬元素和氫氧根組成的化合物如:氫氧化鈉、氫氧化鈣、氨水(NH3·H2O)鹽是由金屬元素元素(或銨根)和酸根組成的化合物如:氯化鈉、碳酸鈉
硝酸,別名硝鏹水,化學式是HNO₃,是六大無機強酸之一。
硝酸易溶於水,常溫下其溶液無色透明,但濃硝酸因溶有二氧化氮(NO₂),因此呈淡黃色。有窒息性刺激氣味。其不同濃度水溶液性質有別,市售濃硝酸為恆沸混合物,質量分數為69.2%(約16mol/L),易揮發,在空氣中產生白霧,是硝酸蒸汽與水蒸汽結合而形成的硝酸小液滴;質量分數足夠大(市售濃度為95%以上)的,稱為發煙硝酸。
硝酸是一種強氧化性、腐蝕性的強酸,除了性質較穩定的金、鉑、鈦、鈮、鉭、釕、銠、鋨、銥以外,其他金屬都能與它反應。硝酸易見光分解,應在棕色瓶中於陰暗處避光保存,嚴禁與還原劑接觸。在有機化學中,濃硝酸與濃硫酸的混合液是重要的硝化試劑;濃硝酸能使羊毛織物和動物組織變成嫩黃色。能與乙醇、松節油、碳和其他有機物猛烈反應。硝酸與鹽酸的體積1:3混合可以製成具有強腐蝕性的王水。
原料:NH3 ,水,空氣.
主要反應為:4NH₃+ 5O₂ =催化劑+強熱= 4NO + 6H₂O [氧化爐中]; (反應條件:800度高溫,催化劑鉑銠合金作用下)
2NO + O₂ == 2NO₂ [冷卻器中];
3NO₂ + H₂O == 2HNO₃ + NO [吸收塔];
4NO₂ + O₂+ 2H2O == 4HNO₃ [吸收塔]。
硫酸(化學式是H₂SO₄)是化學六大無機強酸之一。純硫酸一般為無色油狀液體,純硫酸凝固點過高(283.4K),所以為了方便運輸通常製成98%硫酸,因此人們把濃度低於98.0%而高於70%的稱為濃硫酸,而濃度低於70%的稱為稀硫酸。除此之外,將高濃度的SO通入硫酸可製成發煙硫酸(HSO)。有關發煙硫酸的濃度,人們通常以SO的百分比作準或者是HSO的百分比作準,兩者均可。一般所稱的“發煙硫酸”的濃度為45%(含109%HSO)或65%(含114.6% HSO)。100%純發煙硫酸為固體,熔點為36℃。
物理性質
濃硫酸(濃度98.0%),密度1.84 g/cm³,沸點337℃。濃硫酸能與水以任意比例互溶,同時放出大量的熱,使水沸騰。濃硫酸露置在空氣中,會吸收空氣中的水份而使自己濃度下降,所以濃硫酸可做實驗室中乾燥劑。
化學性質
濃硫酸有酸性和強烈的氧化性,在加熱時,可以與除金、鉑之外的所有金屬反應,生成高價金屬硫酸鹽,本身一般被還原成SO₂。在上述反應中,硫酸表現出了強氧化性和酸性。但常溫下,濃硫酸會使鐵、鋁等金屬鈍化從而阻止反應的進一步進行。熱的濃硫酸還可將碳、硫、磷等非金屬單質氧化到其高價態的氧化物或含氧酸,本身被還原為SO₂。在這類反應中,濃硫酸只表現出氧化性。因為濃硫酸具有氧化性,所以實驗室製取H₂S、HBr、HI等還原性氣體不能選用濃硫酸作乾燥劑。
除此之外,濃硫酸還具有脫水性,可被濃硫酸脫水的物質一般為含氫、氧元素的有機物,反應時,濃硫酸按水分子中氫氧原子數的比(2∶1)奪取被脫水物中的氫原子和氧原子。蔗糖、木屑、紙屑和棉花等物質中的有機物,被脫水後生成了黑色的炭(炭化)。脫水性是濃硫酸的化學性質。
物理性質
稀硫酸是無色無味透明液體。熔點較低。
化學性質
1、稀硫酸可與多數金屬(比銅活潑)氧化物反應,生成相應的硫酸鹽和水;
3、稀硫酸可與鹼反應生成相應的硫酸鹽和水;
4、稀硫酸可與氫前金屬在一定條件下反應,生成相應的硫酸鹽和氫氣;
發煙硫酸是無色或微有顏色稠厚液體,能發出窒息性的三氧化硫煙霧,是一種含有過量三氧化硫的硫酸。含三氧化硫50%以上的遇冷成結晶狀。有很強的吸水性。當它與水相混合時,三氧化硫即與水結合成硫酸。相對密度約1.9(含20%三氧化硫)。凝固點隨濃度變化很大,呈現先升后降的趨勢。含20%遊離三氧化硫的發煙硫酸的凝固點2.5℃,隨著遊離三氧化硫含量的增加,當遊離三氧化硫45%時,凝固點最高達到35.0℃,再逐漸增加遊離三氧化硫含量,凝固點則會迅速降低。遇水、有機物和氧化劑易引起爆炸。有強烈腐蝕性。
工業制硫酸的原料一般是黃鐵礦石,主要成分為FeS₂。
將其磨碎,在燃燒爐中燃燒,生成Fe₂O₃和SO₂氣體:
4FeS₂ + 11O₂ =高溫= 2Fe₂O₃ + 8SO₂
SO₂在催化劑存在(一般為VO)的情況下繼續氧化成SO₃:
2SO₂ + O₂ =催化劑= 2SO₃
SO₃用較濃的硫酸(略小於98.3%)吸收,就可生成硫酸:
SO₃ + H₂O == H₂SO₄
需制稀硫酸時再按照所需濃度用濃硫酸配製。
鹽酸是氫氯酸的俗稱,是氯化氫(HCl)氣體的水溶液。市售鹽酸一般質量分數為37%(約12mol/L)。
一般的鹽酸呈無色,但工業鹽酸因為含有雜質(Fe )而呈黃色。鹽酸有刺激性氣味。濃鹽酸具有極強的揮發性,因此打開盛有濃鹽酸的容器后能在其上方看到酸霧,為氯化氫揮發后與空氣中的水蒸氣結合產生的鹽酸小液滴。
鹽酸為一元強酸,氯化氫氣體溶於水時完全電離。
鹽酸可以與指示劑相互作用使指示劑顯色;可以與鹼反應生成相應的氯化物和水;可以與活潑金屬單質反應生成鹽和氫氣;可以與金屬氧化物反應生成鹽和水;可以與鹽反應生成新酸和新鹽;可以與大部分碳酸鹽或碳酸氫鹽(HCO-)反應,生成二氧化碳和水;鹽酸還具有還原性。
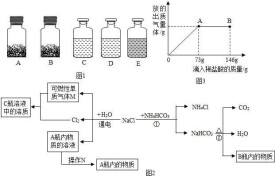
工業上生產鹽酸的主要方法是使氯氣跟氫氣直接化合,然後用水吸收生成的氯化氫氣體。
氯化氫是在合成塔里合成的。
H₂+Cl₂=點燃=2HCl
然後用水吸收,
在合成塔內完成。
純的無水氫氧化鈉為白色半透明,結晶狀固體。有吸水性,可用作乾燥劑。且在空氣中易潮解,氫氧化鈉極易溶於水,溶解度隨溫度的升高而增大,溶解時能放出大量的熱,288K時其飽和溶液濃度可達16.4mol/L(1:1)。它的水溶液有澀味和滑膩感。純固體燒鹼呈白色,有塊狀、片狀、棒狀、粒狀,質脆;純液體燒鹼為無色透明液體。氫氧化鈉還易溶於乙醇、甘油;但不溶於乙醚、丙酮、液氨。溶解或濃溶液稀釋時會放出熱量。
氫氧化鈉密度為2.130g/cm³,熔點318.4℃,沸點在一個標準大氣壓下為1390℃。
氫氧化鈉溶於水中會完全解離成鈉離子與氫氧根離子,所以它具有鹼的通性:能與指示劑相互作用使指示劑顯色;能與任何質子酸進行酸鹼中和反應;其溶液能夠與鹽溶液發生複分解反應;能與酸性氧化物反應生成鹽和水。除此之外,氫氧化鈉還可以與和酯反應,而生產出醇和羧酸鹽;氫氧化鈉溶液與兩性金屬反應,生成鹽和氫氣;也會與兩性非金屬反應生成鹽和氫氣。
工業上生產燒鹼的方法有苛化法和電解法兩種。
純鹼苛化法
將純鹼、石灰分別經化鹼製成純鹼溶液、化灰製成石灰乳,於99~101℃進行苛化反應,苛化液經澄清、蒸發濃縮至40%以上,製得液體燒鹼。將濃縮液進一步熬濃固化,製得固體燒鹼成品。苛化泥用水洗滌,洗水用於化鹼。
Na₂CO₃+Ca(OH)₂==2NaOH+CaCO₃↓
天然鹼苛化法
天然鹼經粉碎、溶解(或者鹼鹵)、澄清后加人石灰乳在95~100℃進行苛化,苛化液經澄清、蒸發濃縮至NaOH濃度46%左右、清液冷卻、析鹽後進一步熬濃.製得固體燒鹼成品。苛化泥用水洗滌,洗水用於溶解天然鹼。
Na₂CO₃+Ca(OH)==2NaOH+CaCO₃↓
NaHCO₃+Ca(OH)==NaOH+CaCO₃↓+HO
隔膜電解法
將原鹽化鹽后加入純鹼、燒鹼、氯化鋇精製劑除去鈣、鎂、硫酸根離子等雜質,再於澄清槽中加入聚丙烯酸鈉或苛化麩皮以加速沉澱,砂濾后加入鹽酸中和,鹽水經預熱後送去電解,電解液經預熱、蒸發、分鹽、冷卻,製得液體燒鹼,進一步熬濃即得固體燒鹼成品。鹽泥洗水用於化鹽。
2NaCl+2H₂O=通電=2NaOH+Cl₂↑+H₂↑
離子交換膜法
將原鹽化鹽后按傳統的辦法進行鹽水精製,把一次精鹽水經微孔燒結碳素管式過濾器進行過濾后,再經螫合離子交換樹脂塔進行二次精製,使鹽水中鈣、鎂含量降到0.002%以下,將二次精製鹽水電解,於陽極室生成氯氣,陽極室鹽水中的Na 通過離子膜進入陰極室與陰極室的OH 生成氫氧化鈉,H 直接在陰極上放電生成氫氣。電解過程中向陽極室加入適量的高純度鹽酸以中和返遷的OH ,陰極室中應加入所需純水。在陰極室生成的高純燒鹼濃度為30%~32%(質量),可以直接作為液鹼產品,也可以進一步熬濃,製得固體燒鹼成品。
碳酸鈉常溫下為白色粉末或顆粒。無氣味。有吸水性。露置空氣中逐漸吸收 1mol/L水分(約15%)。碳酸鈉易溶於水,甘油,20℃時100g水能溶20g碳酸鈉,35.4℃時溶解度最大,100g水中可溶解49.7g碳酸鈉,微溶於無水乙醇,不溶於丙醇。
由於碳酸鈉在水溶液中水解,電離出的碳酸根離子與水中氫離子結合成碳酸氫根離子,導致溶液中氫離子減少,剩下電離的氫氧根離子,所以溶液顯鹼性。
碳酸鈉能與酸反應,生成鹽、水和二氧化碳;與部分鹼發生複分解反應,生成新鹽和氫氧化鈉;和部分鹽發生複分解反應,生成新碳酸鹽和新的鈉鹽。由於碳酸鈉在水中水解生成氫氧化鈉和碳酸,它與某些鹽的反應則會推動化學平衡向正方向移動,生成相應的鹼和二氧化碳。
工業上主要採取聯合制鹼法(侯氏制鹼法)制純鹼。
第三步,合成的碳酸氫鈉部分可以直接出廠銷售,其餘的碳酸氫鈉會被加熱分解,生成碳酸鈉,生成的二氧化碳可以重新回到第一步循環利用。