核移植
核移植
核移植是將供體細胞核移入去核的卵母細胞中,使後者不經精子穿透等有性過程即可被激活、分裂併發育,讓核供體的基因得到完全複製。培養一段時間后,在把發育中的卵母細胞移植到人或動物體內的方法。核移植的細胞來源主要分為:供體細胞來源和受體細胞的來源兩種。核移植主要用於細胞移植和異種器官移植,細胞移植可以治療由於細胞功能缺陷所引起的各種疾病。
供體核可以是早期胚胎細胞、胚胎千細胞和體細胞。早期都採用合子核到64細胞期的胚胎細胞核質體分裂球作供體細胞核,80年代開始,隨著胚胎幹細胞(embryo stem cells,ES)的建立和對其研究的深入,人們對胚胎幹細胞在核移植方面的應用前景寄予厚望,但ES建系太困難,僅在小鼠上獲得成功。Teruhiko Wakayama等利用ES系克隆小鼠,結果有29%的重構胚在體外能發育到囊胚階段,移植給假孕小鼠有8%胚胎附植併產下小鼠。1997年Dolly羊的出現,開始了體細胞的核移植,並發展很快。
1.1胚細胞
用0.2%鏈霉蛋白酶預處理胚胎,溶去胚胎的膠膜及透明帶,分離出單個卵裂球。消化透明帶的時間是影響卵裂球質量的重要因素,作用時間短,透明帶不能充分消化,卵裂球不易獲得;作用時間長,則影響到卵質膜,容易破裂,在操作時容易失敗。因此,在分離卵裂球時應在解剖鏡下監視透明帶的消化過程,當透明帶變薄,膨脹適度時就應移出,再用適當口徑的吸管吹打使之分離。另外,蘇格蘭學者Campbell等顯微分離胚盤細胞並在體外進行缺血飢餓傳代培養,誘使細胞處於"靜止"狀態,以便調整染色體結構,從而有助於核的重組與發育,他們使用這種方法建立了綿羊TNT4細胞系,該細胞形態類似於胚胎幹細胞,但更扁平、上皮化。
1.2體細胞
最早用青蛙腸粘膜上皮細胞獲得了後代。Wilmut等用綿羊乳腺細胞獲得Dolly羊。美國夏威夷大學Ryuzo Yanagimachi教授領導的一個國際科研小組於1998年以小鼠卵丘細胞為核供體,採用吸移管注入,利用機械和化學激活方式進行細胞的融合,成功培育三代克隆小鼠。對小鼠、牛體細胞移植的相關研究中發現休眠(G0)的顆粒細胞核與去核MⅡ期卵母細胞構成的體細胞重構胚,其發育率及產生克隆後代的能力遠高於其它類型的休眠體細胞,這可能緣於顆粒細胞上存在著與卵母細胞緊密聯繫的胞質微絨毛橋的緣故,它或許有助於供體核同受體核胞質因子的交換。
作為細胞核移植的受體細胞主要有三類:去核的卵母細胞、受精卵和2-細胞胚胎,其中卵母細胞應用最為廣泛。有人用兩個去核卵母細胞融合后產生的胞質作為受體進行各代核移植,以增核移植胚胎的細胞數和提高繼代移植效率。研究證明,體外成熟培養的卵母細胞核移植成功率不如體內成熟的卵母細胞,其原因可能是卵母細胞在體外成熟過程中,需要合成一些蛋白質來完成第一次減數分裂,體外成熟的一些卵母細胞其活動有可能受到抑制。
2.1卵母細胞的去核方法
2.1.1盲吸法用微細玻璃管在第一極體下盲吸,吸除第一極體及處於分裂中期的染色體和周圍的部分細胞質,但該方法成功率低。為提高去核率,利用Hoechst33342染料對染色質的特異性染色作用,在熒光顯微鏡下去核后判斷去核是否完成,去核準確率大為提高。Stice等用Hoechst33342(1μg/ml)染色,在紫外線下照射的時間控制在10s以內,未觀察到對胚胎髮育的負面影響。
2.1.2半卵法用微細玻管針在透明帶上做一切口后,用微細玻管吸去一半染色質至另一半空透明帶內,即將卵母細胞分為兩半,然後用Hoechst33342染色,確定不含染色體的一半為細胞質受體。其操作方法如下,將卵母細胞移入35mm含有mPBSA(磷酸緩衝液,其中有D-葡萄糖1000mg/l、丙酮酸36mg/l、0.4%牛血清白蛋白、1%青霉素和鏈黴素10000μg/ml)的皮氏培養皿中進行顯微操作,首先分兩步進行分割透明帶,即先在透明帶上切一小口,然後用另一切割針擴大切口,從而分割透明帶。透明帶被切除後轉移到含有mPBSA+5μg/ml細胞鬆弛素B的35mm的皮氏培養皿中作用3一5min,然後用固定針(內徑為透明帶的l/5一1/3,外徑接近透明帶的直徑)固定,分割針進入透明帶的隙口中並將該針固定在靠著透明帶的地方,緩慢吸取卵母細胞液,當分割針中吸取了一半卵母細胞液時,這時將該針從卵黃隙中移出,並靠著透明帶切割邊緣輕微地擦過以達到完全的分割,將其針中的卵母細胞液移入準備好了的空透明帶中,並用Hoechst33342染色,熒光顯微鏡下觀察不發熒光的作為受體卵母細胞。
2.1.3離心去核Tatham等以15000g、2min離心牛卵母細胞,用鏈霉蛋白酶去除卵母細胞透明帶(ZP),經滲透壓梯度離心,MⅡ期紡錘體可從大多數卵母細胞中分開,把無透明帶的去核胞質作核移植的供質,同分裂球聚集經電融合成核移植胚,最後放入藻酸鈉假透明帶中,能在體外卵裂和發育,但其效果還有待於進一步研究。
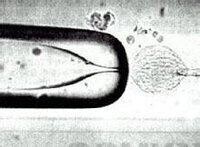
核移植
多數研究者在多數卵母細胞出現第一極體的成熟時期去核,去核時間,體內成熟在發情開始后48h,體外成熟22-24h。卵母細胞去核程序與重構胚中再程序化狀況密切相關,去核率越高,其克隆胚最終發育成正常胚的可能性越大。去核率的高低與卵母細胞所處的成熟時期以及所採用的方法密切相關。以前的核移植研究均採用未激活的卵母細胞作為核受體,並認為激活后卵母細胞的重排能力會下降,影響核移植的效率。但Ushijima,等和Terlovw等;研究表明,激活后的卵母細胞作為核供體時,重構胚融合和發育能力均優於融合激活同時進行的效果。
2.3 胞質容士與重構胚的發育潛力
有人對核反比例與重構胚發育的關係進行研究,結果表明,卵母細胞去除的胞質量與預期供核體積大小相當時,可以為細胞周期的相互作用創造最好的條件,而去除太少或太多並不理想。基於去除細胞質的量與去核率關係切,因此,在保證有較高的去核情況下。去除的胞質應盡量少。
在顯微操作儀操縱下,用一直徑接近卵裂球大的移植針吸取一枚分離出的完整卵裂球,注入去核的受體卵母細胞的間隙中,根據移人的部位不同,可分為帶下移植和細胞質內注射。那些卵裂球很難分離的胚胎可以在添有鈣和鎂-遊離的磷酸緩衝鹽溶液的mPBSA中孵育30-60min使細胞分裂停止。但孵育時間超過60min,細胞膜的完整性將遭到破壞,操作過程中細胞的溶化率將增加。在移植針移開后,對移植卵裂球上方的透明帶施加壓力使卵裂球與半卵母細胞接觸。
4.1 融合與激活
核移植
對兔卵電融合完成後,卵母細胞也因電刺激受到激活從而開始新的編程和發育,但對小鼠、大鼠和牛等還需進一步充分的激活才能獲得發育。其方法有化學和電激活兩種,化學激劑有7%乙醇、Ionomycin(離子黴素)、鈣離子載體A23187,採用Ionomycin激活后再用6-DMAP處理3h,可避免出現PCC(早熟染色體凝集),並增加羊重構胚的發育率及出生率。
4.2 融合率與細胞期
Prather等(1989)研究結果表明,融合率與細胞期無顯著差異,說明卵裂球體積變小對融合率並無顯著的影響,張涌(1992)在小鼠研究中也得出類似的結果。Robal等也認為,融合率與受體卵母細胞的時齡有關,並且還與核供體接觸的面積和接觸的緊密程度有關,而與移入的卵裂球處於什麼時期無關,但是重構胚的發育率與供體胚的細胞期是有關的。
4.3 溫度、卵母細胞成熟時間對卵母細胞激活的影響
隨著卵母細胞在體外成熟時間的延長,進而老化,成熟促進因子(MPF)下降,易激活。體外成熟老化的牛卵母細胞對溫度誘導激活高度繁感,在一定的溫度誘導激活下,卵母細胞染色質聚縮,"自動去核"的頻率高。幼稚卵母細胞不容易在室溫下激活,即使激活也不穩定,可能逆轉到中期。
核移植

核移植
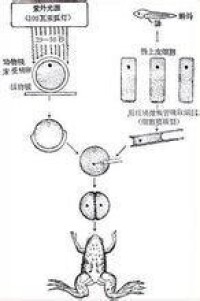
鯽魚和鯉魚是經常出現在人們餐桌上的兩種淡水魚。它們的親緣關係比較近。鯉魚幼小時常常會被誤認為是鯽魚,如果沒有注意到它嘴巴邊上的兩根須的話。但從總體上說,鯽魚和鯉魚的區別還是比較大的。鯽魚的個子小,長到200~300克就不會再長了;鯉魚是大個子,只要一兩年就能長到兩三千克重。鯽魚肉質細嫩肥腴,鮮美可口;鯉魚的肉較粗較老,滋味比鯽魚遜。20世紀80年代初,中國武漢的一些生物科學工作者,進行了一項大膽的試驗。他們先對鯽魚的成熟卵細胞“動手術”,設法去除掉它的細胞核。然後又從鯉魚的胚胎細胞中取出細胞核,讓它到上述的鯽魚細胞中“安家落戶”。在他們的精心操作之下,這種換掉了細胞核的鯽魚卵細胞就像正常的受精卵細胞一樣,開始了不斷的分裂,最終發育成面目一新的雜交魚。這種魚一年就能長到500克以上,但外觀形態和肉質滋味都酷似鯽魚,只是嘴巴邊上多了兩根須。這是一次成功的細胞核移植。不難看出,細胞核移植和細胞融合一樣,能向人類提供在大自然里是難以想象的動植物新品種,從而帶來巨大的經濟效益。其實,在同種生物中使用細胞核移植技術也有巨大的價值,它能使性狀特別優異的品種迅速得到推廣。道理很簡單,生物個體的體細胞數量總要比生殖細胞多得多,而體細胞細胞核里的遺傳物質則與生殖細胞是一模一樣的。當人們發現了性狀特別優異的動植物體后,用細胞核移植技術,就可以把它大量的體細胞細胞核移植到同種生物的卵細胞里,培養出大量的性狀特別優異的後代。

核移植
美國器官移植專家
異種器官移植
治療性克隆是利用核移植技術將病人的體細胞核移植到去核的卵母細胞中,使其重編程併發育成囊胚,然後再用胚胎幹細胞分離技術從克隆囊胚的ICM分離出多能胚胎幹細胞(ES)。這種幹細胞在遺傳學上和病人完全一致,再定向誘導其分化成病人所需要的體細胞進行移植,以取代和修復患者已喪失功能的細胞、組織或器官,而達到完全治癒。治療性克隆不僅解決移植物與受者間的免疫排斥反應問題,而且可以解決移植物的來源問題。
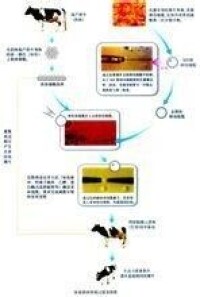
核移植科普圖

核移植
到2007年為止,雖然核移植技術的發展較快,然而該技術還存在許多問題,如核移植成功率普遍比較低、重構胚的發育率低、畸形胚的比率高。體外培養的時間過長或培養液的成份可能導致移植胚的流產以及出生后的仔畜很快死亡。基因重組編程的機制尚不清楚,其中MPF、NEBD(核膜破裂)和PCC在基因組重編過程的作用還需闡明。基因印記對核移植重新編程的影響以及基因印記與動物克隆技術的成功及不足有何關係,還不清楚。
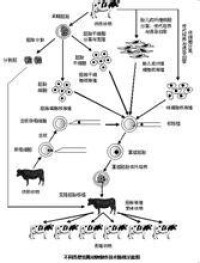
2001年我國科學家將牛耳細胞克隆的胚胎移入135頭牛體內,每頭牛移植了兩枚克隆胚胎。從2002年1月8日起,陸續獲取了14頭克隆牛犢。至2003年11月,這批被克隆的牛,存活的只有5頭。
體細胞核移植技術在畜牧業、醫藥衛生,以及其它領域擁有著廣泛的應用前景。