免疫PCR
免疫PCR
免疫PCR (Immuno PCR, Im-PCR) 是利用抗原抗體反應的特異性和PCR擴增反應的極高靈敏性而建立的一種微量抗原檢測技術。
用抗體檢測抗原是免疫學的最基該方法,用酶或同位素標記抗體可使檢測的敏感性提高,常用的定量檢測方法ELISA和RIA均基於標記分子可以使檢測的信號增強。免疫PCR是在ELISA的基礎上建立起來的新方法,用PCR擴增代替ELISA的酶催化底物顯色。PCR具有很強的放大能力,其可以定量地檢測DNA和RNA,具有非常高的敏感性和特異性,因此,將與抗原結合的特異抗體通過連接分子與DNA結合,再經PCR擴增,由此定量檢測抗原使敏感性高於ELISA和RIA。
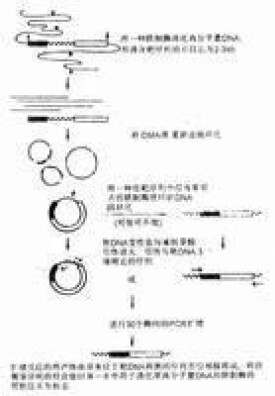
免疫PCR主要由兩個部分組成,第一部分的免疫反應類似於普通的酶聯免疫吸附試驗(ELISA)的測定過程;第二部分即通常的PCR檢測,抗原分子的量最終由PCR產物的多少來反映。第一步中,首先用待測抗原(如牛血清白蛋白(BSA))包被微滴板孔,再加入相應的特異抗體,於是抗體就與固相上的抗原結合形成抗原抗體複合物,蛋白A-鏈親合素(Protein A-Streptavidin)嵌合體(重組融合蛋白)中的蛋白A部分可與固相上抗原抗體複合物中的抗體IgG結合,而鏈親合素部分可與生物素化的pUC19(質粒DNA) (Biotin-pUC19)中的生物素反應,從而將特定的DNA間接吸附於固相。接下來,就是第二步中的PCR過程,第一步中吸附於固相的pUC19質粒DNA在相應的引物存在下,可經PCR在幾小時內而放大數百萬倍,PCR產物的多少與固相上抗原的量成正比。
PCR由 ①待測抗原;②生物素化抗體;③親和素(連接分子);④生物素化DNA;⑤PCR擴增五部分構成。
被檢測的樣品可以是抗原,或者是作為抗原的某種抗體。待檢的抗原可以直接吸附於固相,這一過程與ELISA試驗是相同的,因此有些吸附性差的抗原不能應用目前介紹的免疫PCR方法進行檢測,需要對免疫PCR進行改進,以便能夠檢測吸附性差的抗原。免疫PCR的後續過程需PCR擴增,目前有些方法應用的固相板或管是特殊用於免疫PCR,並且有些PCR僅可以直接用微量板進行擴增,這樣可以簡化實驗過程和提高檢測的精確性。免疫PCR具有非常高的敏感性,特別適用於檢測微量抗原。
免疫PCR中的特異抗體是對應於待檢抗原,與ELISA一樣,抗體的特異性和親合力將影響免疫PCR的特異性和敏感性。一般均選用單克隆抗體,這個抗體常採用生物素標記,通過親和素再結合DNA。
連接分子是連接特異抗體與DNA之間的分子。目前介紹的方法中均是通過生物素與親和素系統使特異抗體與DNA連接,生物素和親和素作為免疫PCR的連接分子在連接方式上有許多差異。Sano首次報道PCR時用的是重組葡萄球菌A蛋白-親和素嵌合蛋白(SPA-親和素)。其具有結合IgG和生物素的兩個位點,因此可以將IgG與生物素化的DNA連接成複合物。由於重組的SPA-親和素沒有商品試劑,且SPA不但可以結合特異抗體的IgG,而且還可以與樣品中吸附於固相的無關IgG結合,特別是檢測的抗原就是某種IgG,因此,Ruzicke認為Sano的免疫PCR本底高和特異性差。Ruzicke用商品化的親和素系統試劑建立了一種免疫PCR,這種方法是先將親和素與生物素化的DNA預結合成複合物,然後再與結合固相的特異性抗體結合,這種方法存在的問題是親和素與生物素化的DNA分子預結合時二者的分子比例並不是等同的,一個親和素分子可以結合4個分子生物素,因此在預結合時生物素化的DNA分子不能過多,否則DNA分子上的生物素將親和素完全飽和,親和素再無結合生物素化抗體的能力;但在低飽和生物素化DNA時,親和素結合的生物素化DNA存在許多種類的複合物,甚至還有遊離的親和素,只有部分結合生物素化DNA的親和素才能起到連接分子的作用,因此,這樣預結合的親和素和生物素化DNA是一均質性很差的混合物。雖然預結合的複合物可以減少測試過程中的1次孵育和沖洗,但是這樣的複合物作為連接分子必然導致敏感性低和誤差大,並且每次製備的連接分子均有差異,從而導致重複性差。
Hong zhou等建立了一種免疫PCR方法,連接分子是鏈親和素,在連接抗體和DNA時是以遊離的方式加入,這樣鏈親和素先與生物素化抗體結合,沖洗后,再加入生物素化的DNA。這個方法雖然多了1次孵育和沖洗過程,但具有較好的敏感性和重複性。
免疫PCR中的DNA是一指示分子,用DNA聚合酶將結合於固相上的DNA特異放大,由此定量檢測抗原。免疫PCR的敏感性高於ELISA主要是應用了PCR強大的擴增能力。免疫PCR中的DNA分子可以選擇任何DNA,但要保證DNA的純度,且有較好的均質性,儘可能不選用受檢樣品中可能存在的DNA。一般可選用質粒DNA或PCR產物等。DNA的生物素化是用生物素標記的dATP或dUTP通過DNA聚合酶標記在DNA分子上,一般是一個分子DNA標記兩個生物素,標記率可達百分之百。生物素化的DNA用量需預先選定,過多易出現非特異結合而引起本底過高,過低將導致敏感性低和出現不同濃度抗原得出同樣結果的飽和現象。
免疫PCR的PCR擴增系統與一般PCR一樣,主要包括引物、緩衝液和耐熱DNA聚合酶。由於免疫PCR需用固相進行抗原抗體反應,同時又需要對固相結合的DNA進行擴增,因此,免疫PCR固相的選擇應根據具體情況確定。用微量板作為固相必須有配套的PCR儀,以使可以用微量板直接擴增,否則需要用PCR反應管作為固相擴增后的PCR產物用瓊脂糖凝膠電泳或聚丙烯醯胺凝膠電泳檢測,根據PCR產物的大小選擇兩種凝膠的濃度。電泳后凝膠經染色和拍照記錄結果,再檢測底片上PCR產物的光密度,並與標準品比較就可以得出待檢抗原量。
(一)抗原+生物素化抗體→抗原-生物素化抗體複合物;
(二)加親合素→抗原-生物素化抗體-親合素複合物;
(三)加生物素化DNA→抗原-生物素化抗體-親合素-生物素化DNA;
(四)PCR擴增生物素化DNA部分。
將噬粒 BLuescript skt,用生物素標記的M13引物進行PCR擴增製備出含T3和T7引物序列的280bp DNA片段,即為生物素化DNA。
1 試劑
洗滌液:20mmol/L Tris-HCI(pH7.5),含150mmol/LNaCl0.1mmol/L EDTA和0.1%Tween20;
2 操作
1)包被
用包被緩衝液稀釋抗原(BSA),加入微滴板中(45μl孔),4℃過夜(約15h),用洗滌液洗板3次×5min。
2)封閉:
每孔加200μl含4.5%脫脂奶及變性鮭魚精子DNA(1mg/ml)、0.1mmol/L EDTA的20mmol/L Tris-Hcl(pH7.5)(含150mmol/L NaCl緩衝液,37℃溫育80min,洗板數次。
3)抗原抗體反應:
用釋釋液1:8000稀釋單克隆抗BSA抗體,每孔加50μl,室溫(~22℃)下45min,洗板孔15次×10min,去除未結合的抗體分子。
4)鏈親合一蛋白A結合反應:
每孔加入50μl用稀釋液稀釋的已與生物素-pUC19結合的鏈親合素-蛋白A嵌合體,室溫(~22℃)50min,使得嵌合體-pUC19結合於固相的抗原抗體複合物上,然後洗板15次×10min,再用無NaN3的TBS洗3次,然後即可將微滴板用於後面的PCR反應。
5)PCR
實驗條件 50mmol/L KCI、10mmol/L Tris-HCI(20℃pH8.3)、1.5mmol/LMgCl2、明膠(10μg/ml)、0.8mmol/LdNTPs(每種0.2mM)、2μM引物(每一引物1μM)和TaqDNA多聚酶(50U/ml)。
PCR周期 PCR前,用紫外線(UV)(254nm)照射上述反應混合物,然後將之加入到微滴板孔中,每孔40μl,再加20μlUV照射的石蠟覆蓋,按下述溫度在PCR儀上進行PCR周期:起始變性94℃5min;30個周期:變性94℃5min,退火58℃1min,延伸72℃1min,最後延伸72℃ 5min,得到的PCR產物為特定的261bp的片段。
⒉ 加50μl於微孔板內,4℃過夜。同時設陰性對照(加50μl 0.85% NaCl於另一孔內)。
⒊ 用400μl的0.05% 溫20pBS(以下簡稱TPBS),洗滌五次。
⒋ 加入2.25%的100μl正常山羊血清(NGS) PBS封閉2小時.
⒌ 用含0.15% NGS的TPBS洗3次.
⒍ 加入100μl用0.75% NGS適當稀釋的單克隆抗體(內含100μg的鮮魚精DNA),室溫孵育30min.
⒎ 用TPBS洗滌五次.
⒏ 加入50μl適量稀釋的生物素化抗鼠IgG抗體,室溫孵育30min.
⒐ 用TPBS洗滌五次.
⒑加入60μl適量稀釋的生物素化DNA和親和素,室溫孵育30min.
⒒用TPBS洗滌五次,再用HPLC級水洗三次.
⒓PCR擴增:加入50μl PCR反應液(內含T3和T7引物),95℃ 60sec,50℃ 110sec,72℃ 110sec,循環30次。取PCR產物10μl於1.7%瓊脂糖凝膠上電泳,和核酸分子量標準相比較,在相應的位置郵現電泳帶為陽性。必需時將電泳結果照相,進行定量分析.
1)凝膠檢測系統 用凝膠掃描儀或計算機輔助視頻設備對溴化乙錠染色的瓊脂糖或聚丙烯醯胺凝膠進行定量,放射性標記的擴增產物可通過放射自顯影定量測定,最近用自動DNA測序儀檢測熒游標記的核酸,這種方法可準確測量擴增產物的大小,而且其檢測靈敏度達fg水平,但由於自動DNA序列儀和熒游標記引物極為昂貴,所以現在僅用於研究。
3)固相測定系統 最常用的為96孔聚苯乙烯微量滴定板,可用儀器比色或讀數,可用親合素分子通過疏水相互作用包被滴定板,此固相系統可特異結合生物素或生物素化的分子可用於生物素化的PCR產物的定量,如用生物素和地高辛雙重標記的擴增產物可用微量滴定板法定量,將生物素和地高辛同時標記PCR產物的方法有三種途徑:①在反應混合物中同時加入地高辛和生物素標記的脫氧核苷酸類似物(DIG-/Bio-dUTP);②加入生物素化的引物1和DIG-dUTP;③加入生物素引物1和地高辛標記的引物2。定量方方法為:雙重標記的擴增產物用乙醇沉澱以去除未結合的標記物,然後加至親合素包被的微量滴定板上溫育至少2小時,洗滌數次后,與DIG抗體:AP結合物溫育,根據其底物不同可產生不同的顏色,親合素介導的固相捕獲生物素標記靶分子的技術是一個有效、靈活和容易操作的技術,將成為定量PCR的一個關鍵技術。
4)SPA(Scintillation Proximity Assay)系統 用親合素包被的氟微球作為固相載體,用生物素標記引物,在擴增時摻入氟化的核苷酸,擴增完成後,加入已包被的氟微球以捕獲生物素化的PCR產物,此捕獲過程可使與氟微球緊密結合,氟被氘激發產生光脈衝,可用閃爍計數儀測量。與比色法相比,此法具有更大的線性範圍。
5)點雜交檢測系統 將擴增產物變性后固定於尼龍膜表面,與標記的DNA探針雜交,亦可將序列特異的寡核苷酸探針通過多聚T(poly T)尾巴固定於膜上,與變性后的已標記的擴增產物雜交,在後者由於靶基因不是直接結合於膜表面,故其反應動力學接近於液相,反應速度快,通常使用生物素化的探針或擴增產物,用親合素-AP結合物產生顏色斑點,通過與已知濃度的標準比較顏色強度進行定量。
6)電化學發光檢測系統 通過親合素-生物素系統將擴增產物結合於磁性珠,然後與2,2'-聯吡啶-釕螯合物(TBR)標記的探針雜交,加入三丙胺(tripropylamine,TPA)溶液,並轉移至電化學發光儀的檢測池,當電極的電壓增加至一定水平時TPA和TBR都瞬時氧化,TPA氧化後生成一種不穩定的、具有高度還原性的中間物質,可與氧化的TBR反應,使之進入激發態,當由激發態變為基態時可發射出620nm的光,發光強度與TBR標記物的量成正比,通過發光強度對PCR產物定量,此法的敏感性為amol水平,可自動化測量。
7) DNA酶免疫測定系統 通過抗DNA單克隆抗體與擴增產物結合、再通過酶第二抗體結合物進行定量測定。此法不需對引物和擴增產物進行標記,但易出現交叉反應和單克隆抗體昂貴的費用限制了此法的廣泛應用。
8)激光誘導熒光檢測法 首先用熒游標記物FAM(商品名)的N-羥基琥珀醯亞胺酯衍生物藉助氨已基連接臂偶聯於正向引物的5'-核苷酸上,然後PCR擴增,用毛細管電泳擴增產物,最後用氬離子激光光原檢測器檢測熒光強度進行定量測定。此法的優點為樣本用量少,可自動化檢測,快速、靈敏和高解析度。
總之,可用上述方法對靶基因定量,其準確性可通過復管測定和利用內標使數據標準化而得到提高。由於親合素介導的固相捕獲生物素標記靶分子的技術具有有效、靈活和容易操作等特點,有較好的臨床應用前景。定量PCR仍然存在技術上的問題,目前多用於研究,但在腫瘤、細菌、真菌和病毒性疾病的診斷和治療方面對此技術的需求將日益增加。
免疫PCR技術目前尚處於研究階段,還沒有一個十分成熟和滿意的方法,配套試劑尚缺乏,所以應用的還不多,在報道的幾種方法中均是用一些已知的標準品進行試驗。Sano,Ruzicka和Hong zhou分別用牛血清白蛋白、小鼠IgG和重組人原癌基因產物ETS;蛋白作為待檢抗原進行免疫PCR,他們的結果均表明免疫PCR的敏感性比ELISA高105倍,且PCR產生的背景信號很弱,可以檢測到幾百個分子的抗原,在理論上免疫PCR可以檢測到一個分子抗原,因此,免疫PCR特別適用於檢測一些含量特別少的抗原分子。目前介紹的免疫PCR還存在一些缺點,在報道的文獻中均採用待檢抗原直接吸附固相,這樣固相的均質性必然對結果有很大的影響;同時檢測的樣品液中其它成分也可以吸咐固相,極易產生背景過高或精確度下降。另外,有些難於吸咐固相的抗原也就不能用免疫PCR檢測,連接分子的特異性和均質性對PCR影響很大,從理論上看Hong zhou的生物素標記抗體和DNA以及用遊離的鏈親和素連接抗體和DNA是一比較理想的方法,但是如能做到生物素化抗體、親和素和生物素化DNA3個分子預先連接一個複合物,那麼將簡化實驗過程。PCR擴增過程相對簡單,如用微量板作為固相需選用配套的PCR儀,否則需將其移入反應管內,這必然導致很大的誤差,經放大可產生顯著差異。固相也可以直接採用某些PCR反應管,並且可以直接用一般的PCR儀進行擴增,但沖洗過程相對複雜一些。免疫PCR具有非廣泛的應用前景,十分有必要進一步完善免疫PCR的實驗過程和配套試劑的研製。