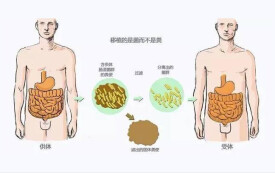
糞便移植
一種通過重建腸道菌群來治療疾病的方法
糞便移植,fecal microbiota transplantation (FMT),是一種通過重建腸道菌群來治療疾病的方法。即把經過處理的健康人的糞便液,灌到患者腸道內。操作過程需要通過嚴格的篩選和實驗方案來實施,1958年美國醫生用糞水挽救感染垂死的患者,這是英文文獻記載最早的案例。

糞便移植
東晉(元~)葛洪,著《肘備急》,載糞清治療食毒嚴腹瀉,“絞糞汁,飲合二升,謂黃龍湯,陳久佳”,載糞治療疾病,“驢矢,絞取汁五六合,及熱頓服,立定”。
紀,李時珍在《本草綱目》中記載了口服糞水治療嚴重腹瀉、發熱、嘔吐和便秘等疾病。中國傳統醫學一直是現代醫學的寶庫。中醫里的很多療法或藥方,之所以被人們認為是“偽科學”,是因為現代科學還沒有發展到可以真正揭示它們的階段。中國古代用糞便治病的辦法,看似離譜,但在今天終於找到了圓滿的科學解釋。
1958年,一種名叫偽膜性腸炎的消化道疾病死亡率高達75%。美國科羅拉多大學醫學院外科醫生beneiseman,對4名患有嚴重偽膜性腸炎的患者,採用了抗生素、氫化可的松、益生菌等治療手段,但病人仍腹瀉嚴重,甚至出現休克。無奈之下,醫生最終和患者及家屬商議,用患者家屬的大便製成糞水對患者進行灌腸。結果,其中3名患者在幾天之內奇迹般地康復出院,另一名患者在住院期間則死於與腸道感染無關的其他疾病。
此後近20年,由於無法從科學角度清楚地揭示它的治療原理,這一療法並沒引起人們的重視。
1980年,中國301醫院消化科也曾用同樣的方法治好了一例嚴重腹瀉的病人,但並未對此作進一步研究,更沒有發表過什麼論文。之後腸道作為人體應激時的中心器官之一,其屏障功能、免疫功能、與其他器官的緊密聯繫、以及腸道細菌微生態逐漸被學界認識”。
近10年來,由於高通量基因測序技術的出現給科學家提供了得力“武器”,人類“攻入”了腸道菌群這一新的科學領地。科學家忽然發現,原來總重量高達1.5千克的腸道菌群,在人體中發揮了巨大作用,與肥胖、腸道疾病乃至精神疾病都有著隱秘而密切的聯繫。
自2004年以來,在《自然》《科學》《細胞》等頂級學術刊物上發表的有關腸道菌群與疾病和健康關係的論文已有上百篇,其他各類生物醫學刊物的相關論文達上千篇。包括肥胖、糖尿病、癌症、自閉症等在內的超過50多種疾病都有證據表明與腸道菌群失調有關係,而通過配方營養、益生菌和藥物調節菌群預防減輕疾病的報道更是如雨後春筍,層出不窮。
2005年10月,13個國家在法國巴黎召開了“人體微生物組研究計劃”圓桌會議。會議認為,應該像做“人類基因組計劃”那樣,組織全球力量,開展“人類微生物組計劃”,把人體共生微生物組的基因組成全部測定出來。當腸道菌群的作用被揭示以後,糞便移植的原理也就可以得到很好的解釋。之所以用“移植”這個詞,說明現在已經把腸道菌群看成組成人體的一部分。
最近幾年,艱難梭菌感染在美國發病率的迅猛上升,也是造成糞便移植在臨床上這麼火的重要原因。艱難梭菌感染與抗生素的長期使用有關,並對多種抗生素具有耐藥性。艱難梭菌感染常常在醫院內發生。有數據顯示,2008年,美國每1000例住院病人里就會發生8.75例感染。上述的偽膜性腸炎就是由艱難梭菌感染引起的。相比之下,中國目前的艱難梭菌感染病人還不是很多。
2010年,中國人民解放軍總醫院消化科接手了一個患克羅恩病的病人。患者病情常年反覆發作,頻繁腹瀉,痛苦不堪,用了各種治療手段也沒有什麼起色。採用國外剛剛興起的“糞便移植”療法。在經過糞便移植以後,病情有了很大改善,從曾經的一天腹瀉十餘次減少到5次。然而,腸道菌群種類豐富,數量龐大,究竟是哪些細菌起了作用,這還需要進一步研究。
2011年,美國一個合作組將既往這些通俗、雜亂的醫學名詞統一為fecal microbiota transplantation (FMT),翻譯為糞菌移植。
2013年,美國將糞菌移植納入難辨梭狀芽孢桿菌感染治療的指南,用於第三次複發的治療。全世界已經有50項批准的臨床試驗在探索多種疾病的治療。
2006年細胞學雜誌封面展示了一次研究:美國北卡羅來納州大學的生物學家 John Rawls 通過跨種屬動物間糞便微生物區系移植,來研究機體如何形成糞便微生物區系,糞便微生物區系又是如何影響宿主生理機能的。試驗先沖洗老鼠的腸道至無菌,然後移植斑馬魚的腸道微生物群,結果發現移植后菌群的構成發生了明顯變化,反之亦然。
同在2006年,Ley等通過比較肥胖人群與非肥胖人群遠端結腸菌群的差異,發現肥胖者遠端結腸內類桿菌比非肥胖者明顯減少,而硬壁菌則相應增加。而且,肥胖者體重減輕1年後,硬壁菌的比例變成與非肥胖者相似。為了再次驗證腸道菌群的改變是否導致了機體肥胖,Ley等進行了另一個實驗,他們把肥胖型小鼠和非肥胖型小鼠的腸道菌群分別定植於兩組非肥胖型無菌小鼠的腸道,2周后發現,定植肥胖型小鼠腸道菌群的無菌小鼠,比起另一組小鼠體重有所增加。Turnbaugh也製造了一個家鼠模型,通過給兩組老鼠的無菌腸道分別導入肥胖和瘦弱小鼠的糞便微生物群系,來證明肥胖、飲食與腸道微生物區系的關係。除個別外,他發現導入肥胖小鼠微生物區系的無菌家鼠比導入瘦鼠微生物區系的家鼠的體重要重。這充分說明小鼠體重的增加可能歸因於腸道菌群的不同。
2008年,Kalliom等為了明確早期的腸道菌群是否與兒童肥胖相關,通過對 25 個體重超重的 7 歲兒童進行前瞻性研究,結果發現,與體重正常的同齡兒童相比,肥胖兒童的腸道雙歧桿菌減少,腸球菌增多,說明腸道菌群紊亂髮生在體重增加之前。然而,腸道菌群促進體重增加的變化機制尚不清楚。
2009年9月的歐盟糖尿病研討會上,荷蘭研究人員的臨床治療試驗驗證了糞便移植是否對代謝病有幫助,微生物群失調是否容易導致糖尿病。他們發現18例有代謝病的病人,在給他們灌輸來自瘦的、健康捐贈人的糞便后,使用胰島素治療非常有效,而且降低了血脂。在西方人群中,腸應激綜合征是一種常見病,常規的治療沒有滿意的效果。然而很多試驗證明胚牙乳桿菌對該病有治療價值,可以減輕疼痛,改善腸功能。除了治療腸炎疾患外,臨床工作者偶爾也用來治療似乎跟腸道無關的疾病,例如慢性疲勞綜合征、痤瘡和多發性硬化症,經驗證明一些移植病例的繼發癥狀有所好轉。新南威爾士州消化道研究中心實施了一項臨床實驗,使用抗生素治療 18 例帕金森患者的難辨梭菌,觀察到患者出現便秘,之後採用了糞便移植替代療法,結果除未發生便秘外,神經病學癥狀也得到了顯著改善。
在認識到腸道菌群與機體健康的重要關係后,人們開始思考調控腸道菌群的方法。顯然,糞便移植是一種最直接的方法和途徑,其在醫學應用、動物生產領域的深度和廣度值得大力研究和開發。筆者根據腸道微生物群功能和眾多糞便移植的研究結論,展望了糞便移植在獸醫科學上的應用前景,期待日後獸醫臨床加以證實。
糞便移植的主要作用機理可能是利用糞便中有益菌種的生態佔位,定植抗力,生物奪氧,免疫調節,降低腸腔 pH 值和細菌代謝產物的營養等。移植的糞便中最重要的是常年棲息於腸道內的數以億計的微生物,它們和腸道上皮細胞等生物成分與食源性非生物成分(未被消化的食物)及來自胃、腸、胰和肝的分泌物(如激素、酶、黏液和膽鹽等)共同構成腸道微生態系統。糞便移植的意義就在於重建正常的腸道微生態結構。
糞便移植
腸道菌群是人體擁有細胞數最多的獨特“功能器官”,作為一種特殊的“器官移植”,FMT的作用日益受到廣泛關注。目前已明確FMT是治療RCDI的安全、無不良反應且療效佳的方案。隨著FMT的臨床研究日趨增多,FMT還可應用於IBD、IBS、便秘以及其他非胃腸道疾病,但對這些疾病的療效以及作用機制仍有待進一步明確。
糞菌移植(fecal microbiota transplantation,FMT)作為一種歷史悠久且可以重建腸道菌群的療法重新被臨床所關注,即將健康人糞便中的功能菌群,通過一定方式移植到病人腸道內,調節腸道菌群失衡,重建具有正常功能的腸道微生態系統,為治療腸道內及腸道外疾病提供幫助。目前已確定FMT對CDI具有較好的療效。FMT在其他疾病的治療也正在研究中,如便秘、腸易激綜合征(IBS)、炎症性腸病(IBD)、代謝綜合征和自身免疫性疾病等。FMT的臨床應用進行匯總,詳情如下:
複發性難辨梭菌感染(RCDI)
關於FMT成功應用於CDI的病人日趨增多。2012年首項多中心長期隨訪研究表明FMT治療RCDI病人的治癒率高達98%。2013年,一項隨機對照臨床試驗表明FMT治療RCDI的療效明顯優於抗生素組(緩解率94% vs 23%~31%)。對重型CDI,84%的病人在首次接受FMT后癥狀獲得緩解,且90d內無複發,複發時92%的病人接受再次FMT治療后仍可獲得治癒。
目前普遍認為導致CDI難以控制的一個重要原因是抗生素的濫用導致腸道菌群紊亂。研究顯示複發型CDI病人腸道內硬壁菌門和擬桿菌門的數量有所減少,而FMT可修復抗生素引發的腸道菌群紊亂,並可持續維持正常菌群結構。2013年,FMT被列入CDI的治療指南中,明確規定對反覆3次發作的CDI病人,應考慮使用FMT治療。目前臨床上雖對CDI病人仍首選抗生素治療,如萬古黴素、甲硝唑等,該治療對大多數病人在初期都具有較好的療效,但複發率高達15%~30%,且病人複發一次后,再次複發的可能性增加至40%。第二次複發后,第三次複發的可能性則劇增至65%。所以,隨著更多的臨床研究結果顯示FMT的治療意義,有理由相信FMT將會逐漸成為治療CDI的主要療法。
炎症性腸病(IBD)
關於IBD的病因尚未完全闡明。越來越多的證據表明腸道菌群變化在IBD發生、發展中具有重要的作用。有研究發現IBD病人腸道內菌群豐富度與正常人比有所降低,減少了約25%,主要表現為硬壁菌門和擬桿菌門數量減少,變形桿菌門和放線菌門數量的增加。硬壁菌門所分泌的代謝產物,可減少促炎因子(如IL-12,IFN-γ)的產生和抑制結腸炎的發生,提示腸道菌群與黏膜免疫密切相關。IBD病人腸道內共生菌所引起的過度免疫或免疫失調將導致黏膜損傷,對於遺傳易感者,腸道菌群的異常定植可能成為解釋IBD患病的新線索。
1988年,首例FMT治療原發性UC病人顯示持續性臨床癥狀緩解和組織學治癒。2003年,6例嚴重、反覆發作型UC病人接受FMT治療后,臨床癥狀、結腸鏡檢查和組織學檢查結果均出現逆轉。2012年,一項對62例UC病人的回顧性分析表明,接受FMT治療的病人中67.7%達到臨床完全緩解。Anderson等對FMT治療IBD的Meta分析顯示,治療后63%的UC病人癥狀得到緩解,76%的病人可停用IBD相關藥物,76%的病人胃腸道癥狀減輕。2013年,10例患有輕、中度UC的青少年接受連續5d的FMT治療,結果顯示1周後有33%的病人獲得臨床緩解,78%癥狀得到改善,1個月後仍有67%的病人癥狀好轉。該研究表明FMT治療UC與CDI存在不同,UC病人治療效果隨著時間的延長可出現減退。關於FMT在CD的臨床應用研究仍限於零星的個案報道。Vermeire等對4例頑固性CD病人行FMT治療,8周后癥狀雖未得到改善,但在治療過程中發現,經過2~4周的治療后病人腸道菌群趨於與供者腸道菌群一致,然而8周后又恢復至初始狀態,表明與CDI不同,需改善FMT治療CD的方案,以更好地適應該病特點。動物實驗雖已取得不錯的結果,但在臨床上卻不盡如意,仍需大量研究去證明FMT對IBD的療效。
腸易激綜合征(IBS)和慢性便秘
IBS是一種胃腸道功能紊亂性疾病,包括腹瀉型IBS(D-IBS)、便秘型IBS(C-IBS)、混合型IBS(M-IBS)和不確定型IBS(U-IBS)四種亞型。IBS的病因尚不清楚,可能是由腸源性病原菌引起,與腸道菌群的改變密切相關。1989年,Borody等首次報道用FMT治療便秘,療效較佳。Jeffery等發現某些IBS亞型的腸道菌群組成結構發生改變,表現為豐富度減少以及擬桿菌門數量減少。對IBS-C病人的腸道菌群分析后發現腸道內硫酸鹽還原菌以及與便秘相關的甲烷生成菌數量均增加。已有近50篇文獻介紹FMT用於治療腹瀉型和便秘型IBS。一個長期隨訪調查報告顯示,45例患有嚴重慢性便秘的病人經治療后,60%的病人癥狀獲得改善。
慢性疲勞綜合征、代謝疾病和自身免疫性疾病
近年的研究發現腸道菌群對某些非胃腸道疾病的發生、發展也可能起一定的作用,關於FMT對這些疾病的治療研究同樣日趨增多。患有慢性疲勞綜合征的人常伴有胃腸道功能紊亂以及腸道菌群改變。Fremont等分析發現,病人腸道內大腸桿菌比例下降,而產乳酸革蘭陽性菌,如腸球菌和鏈球菌過度生長。Smits等對60例有慢性疲勞綜合征和腸道功能紊亂的病人行FMT治療,50%的病人癥狀獲得明顯改善。
腸道內菌群結構改變還與肥胖或2型糖尿病有著密切關係,肥胖者的腸道內擬桿菌門和硬壁菌門所佔比例增多。一項雙盲隨機對照試驗結果顯示,將瘦者糞便移植至肥胖者的腸道內可明顯地改善肥胖者體內胰島素的敏感性,並且肥胖者腸道內產丁酸的菌群增加。
治療營養代謝疾病
結腸微生物群的主要代謝功能是對食物殘渣、腸道上皮細胞分泌的黏液等進行發酵分解,併合成一些維生素等小分子物質。代謝產生的短鏈脂肪酸,特別是醋酸鹽、丙酸鹽和丁酸鹽能促進盲腸對鈣、鐵、鎂等離子的吸收。丁酸鹽是結腸上皮細胞的主要能量來源,幾乎全被吸收利用,影響結腸中上皮細胞的增殖。這些複雜的代謝產物,對宿主而言是能量和可吸收的底物,但同時也為細菌自身的生長和繁殖提供了能量和營養。因此,微生物菌群與機體是共生關係,當一系列原因導致動物機體菌群失調后均可採用糞便移植重構正常菌群,達到緩解和治療由失調引起的一系列癥狀,比如獸醫臨床上常見的惡病質、個體瘦弱、功能性腸便秘和某些營養缺乏症。
改善機體免疫力低下
腸道黏膜是免疫系統與外環境之間的主要界面。腸道相關淋巴組織是機體最大的免疫細胞群。宿主與腸道黏膜表面菌群的相互作用對於機體免疫系統的發育、成熟十分重要。因此對於免疫力低下的動物,及時通過糞便移植建立正常的腸道微生態結構,讓機體免疫系統有機會接觸各種微生物,或許可以提高機體免疫力。
增強屏障保護功能
腸道菌群可以通過以下幾種機制發揮屏障功能:營養競爭、佔位競爭、腸道上皮細胞黏附位點競爭以及產生抗菌物質。因此,在獸醫臨床上,對於各種常發性腹瀉、抗生素治療無效的腹瀉、頑固性痢疾、急慢性腸炎,以及犬細小病毒病、輪狀病毒病等腸道病毒引起的腹瀉,可進行糞便移植,在腸道建立起一層生物保護屏障,輔助對抗病原微生物。
調整機體能量平衡
根據相關試驗研究結論,可設想在肉用經濟動物生產上,收集強壯健康個體的糞便,移植給瘦弱、食慾不良的個體,達到治療和促肥育、降低料重比的目的。而對於伴侶動物如犬、貓,則移植瘦小、健康的同種個體糞便,以達到控制體重增長的目的。
輔助治療肥胖和II型糖尿病
有關腸道菌群與機體代謝平衡方面又有了一個新觀點:II 型糖尿病和肥胖與高脂飲食所激發的機體輕度炎症反應密切相關。然而研究發現,作為一種細菌性因素,腸道菌群中革蘭氏陰性桿菌產生的脂多糖是高脂飲食誘發機體出現肥胖症、糖尿病和炎症反應的前提條件。因此,糞便移植或許可用於獸醫臨床上輔助治療肥胖症、糖尿病和減輕腸道炎性反應。目前為止,在使用糞便移植的文獻報道中,還沒有提到任何副作用。儘管如此,這項技術並未推廣,到2015年2月為止,僅存在於美國的一些醫院。問題之一在於還沒有進行過相關的可控研究,無法防止糞便移植可能傳播難以發現的疾病,像病毒、致病菌、寄生蟲等;之二是因為糞便不是市場銷售的生物製品,操作程序沒有得到統一的規定,應用劑量也沒有文獻具體報告;之三是由於篩選健康捐獻者的程序複雜,要像檢查器官移植捐贈者一樣進行檢查,成本較高。
“糞便移植”療法是把經過處理的健康人的糞便液,灌到患者腸道內。操作過程需要通過嚴格的篩選和實驗方案來實施。
1958年Nieuwdorp找到Ben Eiseman(當時是美國科羅拉多大學丹佛分校的內科醫生)的論文後,打算採取糞便移植的治療措施,Nieuwdorp告訴他的主管——Joep Bartelsman。Bartelsman意識到Nieuwdorp並不是在開玩笑,他同意了Nieuwdorp的方案。
治療方案很簡單:他們將對該病人進行結腸沖洗(希望藉此也能清除艱難梭菌),並用來自捐贈者(她的兒子)的健康菌群替代。他們將她兒子的排泄物和鹽水混合,通過插在鼻子上的一個薄塑料管,將混合物直接注射入病人的十二指腸。Nieuwdorp和Bartelsman決定在幾個月的治療中有4名艱難梭菌患者痊癒,兩人接受了來自第二名捐贈者的糞便移植。
2013年,美國一名32歲女子此前因被“艱難梭菌”感染,多年來經常嘔吐及腹瀉。於是她接受了一項手術,從自己體型肥胖的女兒胃部抽取糞便微生物,移植至自己的腸中,期望根治疾病。但該女子接受手術后雖然痊癒,體重卻無故暴增,從手術前的62公斤長到了16個月後的77公斤磅,與自己的女兒一樣,也變成了一個肥胖的人。該名女子實施手術的羅得島布朗大學醫學院醫生凱莉透露,手術十分順利,但病人約一年後回到診所,投訴體重暴增,其身體質量指數(BMI)由原本的26(過胖),急增至33(中度肥胖)。此外,這名女子還表示感到有東西在體內不斷移動。
據悉,該女子其後接受營養師指導減肥,但體重不減反增,院方懷疑手術影響了她的新陳代謝,同時也不排除是抗生素影響等其他原因。過去在老鼠身上的實驗顯示,移植肥胖生物細菌將引致接受方體重大增,不過由於人類病例極少,凱莉目前仍未能確認女子體重持續上升的原因。
英國雷丁大學的卡拉察斯醫生則認為,動物的身體構造與人不同,目前未有確鑿證據證明體重與糞便益菌移植有關。美國每年有1.4萬人因感染“艱難梭菌”死亡。這種疾病的主要癥狀是嘔吐和腹瀉。由於抗生素耐葯問題越發嚴重,這種腸道感染也變得更加難治和容易複發。移植健康人糞便中的腸道菌群是目前最理想的治療方法。