被動擴散
物質從高濃度向低濃度擴散的方式
離子或小分子在濃度差或電位差的驅動下,不需要任何特定的轉運介質或載體,而通過膜轉運的一種形式。
被動擴散是指物質從生物膜的高濃度側向低濃度側擴散的方式,即物質順濃度梯度擴散通過有類脂層屏障的生物膜(如細胞膜等)。這種方式與主動運輸(active transport)相比,叫做被動運輸(passive transport)。被動擴散包括協助擴散(促進擴散)和自由擴散。
協助擴散又稱易化擴散、促進擴散,或幫助擴散。是指非脂溶性物質或親水性物質,不消耗ATP進入膜內的一種運輸方式。
自由擴散(free diffusion)是指物質從濃度高的一側通過細胞膜向濃度低的一側轉運,例如O2、CO2、N2、甘油、乙醇、苯等物質,可以從濃度高的一側轉運到濃度低的一側。這種物質出入細胞的方式叫做自由擴散。自由擴散不需要消耗細胞內新陳代謝所釋放的能量,是一種簡單的運輸方式。
也叫自由擴散(free diffusing),特點是:①沿濃度梯度(或電化學梯度)擴散;②不需要提供能量;③沒有膜蛋白的協助。
某種物質對膜的通透性(P)可以根據它在油和水中的分配係數(K)及其擴散係數(D)來計算:
P=KD/t,t為膜的厚度。
非極性的小分子如O2、CO2、N2可以很快透過脂雙層,不帶電荷的極性小分子,如水、尿素、甘油等也可以透過人工脂雙層,儘管速度較慢。分子量略大一點的葡萄糖、蔗糖則很難透過,而膜對帶電荷的物質如:H+、Na+、K+、Cl—、HCO3—是高度不通透的
事實上細胞的物質轉運過程中,透過脂雙層的簡單擴散現象很少,絕大多數情況下,物質是通過載體或者通道來轉運的。離子、葡萄糖、核苷酸等物質有的是通過質膜上的運輸蛋白的協助,按濃度梯度擴散進入質膜的,有的則是通過主動運輸的方式進行轉運。
也稱促進擴散(faciliatied diffusion)。協助擴散是指非脂溶性物質或親水性物質,如氨基酸、糖和金屬離子等藉助細胞膜上的膜蛋白的幫助順濃度梯度或順電化學濃度梯度,不消耗ATP進入膜內的一種運輸方式。協助擴散同樣不需要消耗能量,並且也是從高濃度向低濃度進行。
協助擴散與簡單擴散相比,具有以下一些特點:
● 促進擴散的速度比自由擴散要快幾個數量級。
● 具有飽和性:受膜蛋白的數量影響,當溶質的跨膜濃度差達到一定程度時,促進擴散的速度不再提高。
(一)離子載體
離子載體(ionophore),是疏水性的小分子,可溶於雙脂層,提高所轉運離子的通透率,多為微生物合成,是微生物防禦被捕食或與其它物種競爭的武器,
離子載體也是以被動的運輸方式運輸離子,可分成可動離子載體(mobile ion carrier)和通道離子載體(channel former)兩類:
可動離子載體:如纈氨黴素(valinomycin)能在膜的一側結合K+,順著電化學梯度通過脂雙層,在膜的另一側釋放K+,且能往返進行(圖5-2)。其作用機理就像虹吸管可以使玻璃杯中的水跨越杯壁屏障,向低處流動一樣。此外,2,4-二硝基酚(DNP)、羰基-氰-對-三氟甲氧基苯肼(FCCP)可轉運H+,離子黴素(ionomycin)、A23187可轉運Ca2+。
圖5-2 纈氨黴素的分子結構
通道離子載體:如短桿菌肽A(granmicidin)是由15個疏水氨基酸構成的短肽,2分子的短桿菌肽形成一個跨膜通道,有選擇的使單價陽離子如H+、Na+、K+按化學梯度通過膜,這種通道並不穩定,不斷形成和解體,其運輸效率遠高於可動離子載體(圖5-3)。
圖5-3 短桿菌肽構成的通道
(二)通道蛋白
通道蛋白(channel protein)是衡跨質膜的親水性通道,允許適當大小的離子順濃度梯度通過,故又稱離子通道。有些通道蛋白形成的通道通常處於開放狀態,如鉀泄漏通道,允許鉀離子不斷外流。有些通道蛋白平時處於關閉狀態,即“門”不是連續開放的,僅在特定刺激下才打開,而且是瞬時開放瞬時關閉,在幾毫秒的時間裡,一些離子、代謝物或其他溶質順著濃度梯度自由擴散通過細胞膜,這類通道蛋白又稱為門通道(gated channel)。
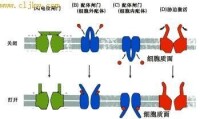
幾種不同的門控離子通道
不同通道對不同離子的通透性不同,即離子選擇性(ionic selectivity)。這是由通道的結構所決定的,只允許具有特定離子半徑和電荷的離子通過。根據離子選擇性的不同,通道可分為鈉通道、鈣通道、鉀通道、氯通道等。但通道的離子選擇性只是相對的而不是絕對的,比如,鈉通道除主要對Na+通透外,對NH4+也通透,甚至於對K+也稍有通透。
目前比較明確的有兩類機械門通道,其一是牽拉活化或失活的離子通道,另一類是剪切力敏感的離子通道,前者幾乎存在於所有的細胞膜,研究較多的有血管內皮細胞、心肌細胞以及內耳中的毛細胞等,後者僅發現於內皮細胞和心肌細胞。牽拉敏感的離子通道是指能直接被細胞膜牽拉所開放或關閉的離子通道。其特點為對離子的無選擇性、無方向性、非線性以及無潛伏期。這種通道為2價或1價的陽離子通道,有Na+、K+、Ca2+,以Ca2+為主。研究表明,當內皮細胞被牽拉時,由於通道開放引起Ca2+內流,使以Ca2+介導的血管活性物質分泌增多,Ca2+還可作為胞內信使,導致進一步的反應。
表面受體與細胞外的特定物質(配體ligand)結合,引起門通道蛋白髮生構象變化,結果使“門”打開,又稱離子通道型受體。分為陽離子通道,如乙醯膽鹼、谷氨酸和五羥色胺的受體,和陰離子通道,如甘氨酸和γ-氨基丁酸的受體。
N型乙醯膽鹼受體[1]是目前了解較多的一類配體門通道。它是由4種不同的亞單位組成的5聚體,總分子量約為290kd。亞單位通過氫鍵等非共價鍵,形成一個結構為α2βγδ的梅花狀通道樣結構,其中的兩個α亞單位是同兩分子Ach相結合的部位(圖5-5)。
Ach門通道具有具有三種狀態:開啟、關閉和失活。當受體的兩個α亞單位結合Ach時,引起通道構象改變,通道瞬間開啟,膜外Na+內流,膜內K+外流。使該處膜內外電位差接近於0值,形成終板電位,然後引起肌細胞動作電位,肌肉收縮。即是在結合Ach時,Ach門通道也處於開啟和關閉交替進行的狀態,只不過開啟的概率大一些(90%)。Ach釋放后,瞬間即被乙醯膽鹼酯酶水解,通道在約1毫秒內關閉。如果Ach存在的時間過長(約20毫秒后),則通道會處於失活狀態。
電位門通道(voltage gated channel)是對細胞內或細胞外特異離子濃度發生變化時,或對其他刺激引起膜電位變化時,致使其構象變化,“門”打開。如:神經肌肉接點由Ach門控通道開放而出現終板電位時,這個電位改變可使相鄰的肌細胞膜中存在的電位門Na+通道和K+通道相繼激活(即通道開放),引起肌細胞動作電位;動作電位傳至肌質網,Ca2+通道打開引起Ca2+外流,引發肌肉收縮。
根據對Na+、K+、Ca2+通道蛋白質的結構分析,發現它們一級結構中的氨基酸排列有相當大的同源性,屬於同一蛋白質家族,是由同一個遠祖基因演化而來。K+電位門通道由四個α亞單位(I-IV)構成(圖5-6),每個亞單位均有6個(S1-S6)跨膜α螺旋節段,N和C端均位於胞質面。連接S5-S6段的髮夾樣β摺疊(P區或H5區),構成通道的內襯,大小可允許K+通過。
K+通道具有三種狀態:開啟、關閉和失活。目前認為S4段是電壓感受器, S4高度保守,屬於疏水片段,但每隔兩個疏水殘基即有一個帶正電荷的精氨酸或賴氨酸殘基。S4段上的正電荷可能是門控電荷,當膜去極化時(膜外為負,膜內為正),引起帶正電荷的氨基酸殘基轉向細胞外側面,通道蛋白構象改變,“門”打開,大量K+外流,此時相當於K+的自由擴散。K+電位門它和Ach配體門一樣只是瞬間(約幾毫秒)開放,然後失活。此時N端的球形結構,堵塞在通道中央,通道失活,稍後球體釋放,“門”處於關閉狀態。
鏈黴菌(Streptomyces lividans)的鉀離子通道KcsA也是由四個亞單位構成的,但每個亞基只有兩個跨膜片段,結構較為簡單。1998年,Roderick MacKinnon 等用X射線衍射技術獲得了高分辨的KcsA通道圖像,發現離子通透過程中離子的選擇性主要發生在狹窄的選擇性過濾器中。選擇性過濾器長1.2nm,孔徑約為0.3nm(K+脫水后直徑約0.26nm),內部形成一串鉀離子特異結合位點,從而只有鉀離子能夠“排隊”通過通道。
與電壓門控性通道家族關係密切的是CNG通道,從蛋白質序列來看,它們與電壓門鉀通道結構相似,也有6個跨膜片段,各為帶電荷片段,P區構成孔道內側,整個通道為四聚體結構。在CNG通道中,細胞內的C末端較長,上面含有環核苷酸的結合位點。
環核苷酸門通道分佈於化學感受器和光感受器中,與膜外信號的轉換有關。如氣味分子與化學感受器中的G蛋白偶聯型受體結合,可激活腺苷酸環化酶,產生cAMP,開啟cAMP門控陽離子通道(cAMP-gated cation channel),引起鈉離子內流,膜去極化,產生神經衝動,最終形成嗅覺或味覺。
長期以來, 普遍認為細胞內外的水分子是以簡單擴散的方式透過脂雙層膜。後來發現某些細胞在低滲溶液中對 水的通透性很高, 很難以簡單擴散來解釋。如將紅細胞移入低滲溶液后,很快吸水膨脹而溶血,而水生動物的卵母細胞在低滲溶液不膨脹。因此,人們推測水的跨膜轉運除了簡單擴散外, 還存在某種特殊的機制, 並提出了水通道的概念。
1988年Agre在分離純化紅細胞膜上的Rh血型抗原時,發現了一個28 KD 的疏水性跨膜蛋白,稱為CHIP28 (Channel-Forming integral membrane protein),1991年得到CHIP28的cDNA 序列,Agre將CHIP28的mRNA注入非洲爪蟾的卵母細胞中,在低滲溶液中,卵母細胞迅速膨脹,並於5 分鐘內破裂,純化的CHIP28置入脂質體,也會得到同樣的結果。細胞的這種吸水膨脹現象會被Hg2+抑制,而這是已知的抑制水通透的處理措施。這一發現揭示了細胞膜上確實存在水通道,Agre因此而與離子通道的研究者Roderick MacKinnon共享2003年的諾貝爾化學獎。
