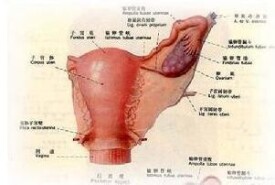
卵巢過度刺激綜合症
體外受孕輔助生育的主要併發症之一
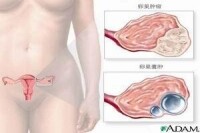
卵巢過度刺激綜合征(ovarianhyperstimulationsyndrome,OHSS徠)為體外受孕輔助生育的主要併發症之一。多見於促性腺激素(HMG/HMG+hCG等)治療期間,表現為噁心、嘔吐、腹部不適、體重增加、卵巢增大、胸腹腔積液、少尿、水電解質平衡紊亂、腎衰、血栓形成等,嚴重的可危及生命。監測排卵手段和臨床經驗的不斷豐富使得現在這種併發症比以前大大減少。OHSS主要臨床表現為卵巢囊性增大、毛細血管通透性增加、體液積聚於組織間隙,引起腹腔積液、胸腔積液,伴局部或全身水腫。近年來,OHSS的發生呈上升趨勢,越來越引起臨床醫務工作者的重視。
卵巢過度刺激綜合症
卵巢過度刺激綜合症
(1)輕度OHSS:表現為體重增加、口渴、腹部不適、下腹稍腫脹、輕度噁心及嘔吐等。體格檢查無失水及腹部陽性體征,B超示卵巢增大(直徑>5cm),有多個黃體,可見腹腔少量積液。
(2)中度OHSS:噁心嘔吐,腹脹加重,腹痛、呼吸急促,但無顯著液體丟失及電解質平衡失調錶現。體檢可見腹部膨隆但無腹肌緊張,腹水征可能為陽性,可捫及腫大的卵巢。B超示卵巢囊性腫大(>7cm)和中等量腹腔積液。
(3)重度OHSS:中度OHSS的癥狀進一步加重,並有大量體液丟失的臨床表現(如煩躁不安、脈搏快、血壓低)。第三間隙液體積聚,出現腹腔積液甚至腸腔積液,低血容量休克,血液濃縮、尿少、水電解質平衡紊亂等,體檢見腹部緊張、腹水征陽性、卵巢明顯增大。B超檢查示卵巢直徑>10cm,極重症病例可因大量腹水、胸水、心包積液而發生急性呼吸窘迫綜合征,也可併發肝、腎衰竭和血栓形成等併發症。如血細胞容積≥45%,白細胞≥15×109/L,大量腹水、少尿、輕度肝、腎功能障礙即可診斷為重度OHSS。如血細胞容積≥55%,白細胞≥25×109/L,大量腹水、腎衰、血栓栓塞現象,並發展為呼吸窘迫綜合征提示病情極其嚴重。
卵巢過度刺激綜合症
2.實驗室及超聲檢查疑診OHSS者應作全血細胞分析、肝腎功能檢查、水電解質測定、盆腔超聲檢查、體重測量、E2水平測定等。監測觀察卵巢對促性腺激素的反應是預防OHSS的重要措施。OHSS可表現為血細胞容積和白細胞升高,低鈉、低蛋白血症。超聲檢查可見卵巢增大、卵泡黃素囊腫、輕度者卵巢增大至5~7cm,中度為7~10cm,重度為10cm以上。同時可見腹腔積液、胸腔積液或心包積液。重度OHSS可出現肝功能不全(表現為肝細胞損害)和膽汁淤積、鹼性磷酸酶、谷丙轉氨酶、穀草轉氨酶、膽紅素、肌酸激酶增高,通常於1個月內恢復正常,一些病人的肝活檢可見肝脂肪變性,Kuffer細胞增生。腹水屬滲出液,含較高濃度的蛋白質。
3.病情觀察和預測
(1)卵巢過度刺激的預測:血清E2和卵巢形態學變化可反映卵巢的刺激程度。在刺激的7~8天開始,每天進行B超監測及E2測定。Brinsden等認為,在行IVF或配子輸卵管內移植(gameteintra-fallopiantransfer;GIFT)者,血清E2≥10000pmol/L(3000pg/ml),卵巢直徑≥12mm,卵泡數≥20是卵巢過度刺激的閾值指標。超過此閾值OHSS的危險性明顯增加。故在助孕過程中應嚴密監測卵巢的反應,但E2水平應考慮所採用的實驗方法不同而有差異。有人提出血雌激素升高的速度比其絕對水平更能反應卵巢對刺激的敏感性。
Ellenbogen提出用卵泡超聲評分法預測OHSS。他們用陰道超聲檢測了34例PCOS患者的63個促排卵周期(HMG加HCG);評分方法為:卵泡平均直徑5~8mm為1分,9~12mm為1.5分,13~16mm為2分,≥17mm為3分,並累計雙側卵巢卵泡總分。結果發現總分<25者不發生OHSS,總分>30分均發生OHSS。另外,總分還與血E2水平相平行。
(2)根據雌激素水平選擇預防措施:Brinsden等認為,在助孕過程中,可根據雌激素水平採取適當的措施預防OHSS的發生。①血清E2≤10000pmol/L(3000pg/ml),無OHSS表現者可直接作胚胎移植。②E2在5000~10000pmol/L(1500~3000pg/ml)移植胚泡后需作黃體支持時,宜選用黃體酮。③血清E2≥17000pmol/L(5500pg/ml)、總卵泡數≥40者禁用HCG促排卵,此時可繼續使用促性腺激素釋放激素激動劑(GnRHagonist,GnRH-A)抑制卵巢過度刺激反應(機制見下述),待恢復正常大小后再以小劑量促性腺激素刺激卵巢。④血清E2在10000~17000pmol/L(3000~5500pg/ml),卵泡數在20~40的病例,仍可用HCG,但宜採用胚泡冷凍,暫不作新鮮胚泡移植,這樣可避免OHSS惡化。新近,Thinen等對23例OHSS高危病例作胚泡冷凍處理,結果僅2例發生OHSS,1例為輕度,另1例重度,凍融胚泡移植成功率較高(22.7%)。⑤在促排卵過程中,血清E2>1000pg/ml,出現4個以上直徑≥14mm的卵泡時,有多胎妊娠的危險,多胎妊娠易引起OHSS,應盡量避免用HCG促排卵。
(3)促排卵藥物的選擇:有關GnRH-A研究的資料表明,採用GnRH-A代替HCG可誘導卵泡成熟和排卵,並有效減少了OHSS的發生,與HCG相比,排卵率、妊娠率相似,多胎率減少,而對卵子數量和質量無影響,但黃體期血E2和孕酮水平較低,可能出現黃體功能不足,使流產率增加,應適當進行黃體支持治療。其發生原因可能是:①GnRH-A調節垂體促性腺激素分泌細胞自身受體,使LH分泌減少。②GnRH-A誘導的LH/FSH峰降調節卵巢黃體的相應受體,使其反應性降低。③GnRH-A直接溶解黃體的作用不能排除。因此,GnRH-A誘發排卵后必須經人工補充孕酮,有些學者主張同時補充,以支持黃體功能。用孕酮支持黃體功能較HCG明顯減少OHSS的發生,但如E2不很高,也可補充HCG。GnRH-A誘發排卵有利於減少黃體期OHSS的發生,雖然仍可見多個增大的黃體化囊腫,但其功能較差,血E2、孕酮水平較低,因此臨床癥狀較輕。Lewitt對HCG促排卵有重度OHSS史的患者,用GnRH-A取代HCG作促排卵治療,結果使用GnRH-A后無一例發生重度OHSS,妊娠率與使用HCG促排卵相似。超促排卵治療宜採用GnRH-A長程方案(即從治療周期前1周期的黃體期使用到HCG注射日)。PCOS超排卵前宜用GnRH-A1個周期,既可降低OHSS發生,又可治療其雄激素過多。GnRH-A誘導排卵的適應證為:對HMG/FSH促排卵或助孕技術超排卵治療高度敏感,有OHSS高危的患者。Aboulghar等主張,以前使用FSH發生重度OHSS史的PCOS患者可以選用HMG或重組的人FSH(小劑量遞增法)治療。他們比較了HMC和重組的人FSH(劑量為75U/d,每周遞增37.5U),結果兩組均無重度OHSS發生,妊娠率分別為20%和15.4%。
卵巢過度刺激綜合症
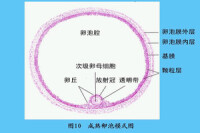
卵巢的高敏反應特徵是血清雌激素濃度明顯增高(>10000pmol/L)和出現大量卵泡(>20個),常為中等大小的卵泡(直徑<14mm)。一般認為,出現過多卵泡是OHSS的重要標誌。許多資料表明,PCOS是OHSS的最重要高危因素。最近發現,高胰島素血症PCOS者,OHSS的危險性極大,有人比較了用促卵泡生成素(FSH)治療的PCOS病例,發現高胰島素血症的OHSS發病率明顯高於對照組;高胰島素血症組卵巢增長速度及未成熟卵泡數量亦高於對照組,排卵期血漿E2水平也以高胰島素組為高。故認為,胰島素與FSH可能具有協同作用,使卵巢對FSH的敏感性明顯提高。
在體外受孕(IVF)過程中,HCG常用作促卵泡成熟和促排卵劑,與內源性黃體生成素(LH)比較,HCG更易導致OHSS,其原因是:①HCG製劑半衰期較長,排卵后的後續作用較明顯;②HCG製劑對LH受體的親和力較內源性LH強且作用時間長。資料表明,HCG與其受體結合的親和力較LH強2~4倍,半衰期為24~36h(LH半衰期為60min)。葯代動力學研究顯示,肌注HCG5000U或10000U后,HCG水平的增高可持續6~10天。因此,在HMG/FSH超促排卵時,HCG注射可引起卵巢進一步增大,形成多個黃體囊腫,超生理量的血F2和孕激素(P)水平在卵巢反應過度的患者中易引起多胎妊娠及OHSS;③HCG製劑同時具有LH和FSH樣作用,可持續刺激卵巢,促進粒層細胞黃素化。另外,注射HCG加上妊娠時內源性HCG加重OHSS。所以在IVF或促排卵治療過程中,妊娠成功者發生重度OHSS的危險性更高。
卵巢過度刺激綜合征(OHSS)為體外受孕輔助生育的主要併發症之一。輔助生育、體外受孕時,人為的過度刺激卵巢可出現3類常見併發症:①OHSS及多囊卵巢綜合征(PCOS),其發生機制未明,可能主要與血管內皮生長因素(VEGF)的過度表達、前列腺素合成過多、炎性因子及血管緊張素-2(AT-2)釋放等因素有關。②血栓栓塞性病變,尤其對已存在高凝狀態者來說。輔助生育過度刺激卵巢后可發生嚴重的血栓栓塞性病變。③多胎妊娠和異位妊娠,主要是多個卵子同時成熟,同時受孕所致。臨床上使用排卵誘導劑,如人絨毛膜促性腺激素(HCG)、人絕經后促性腺激素(humanmenopausalgonadotropin,HMG)及氯米芬時,卵巢被過度刺激而引起的一系列臨床表現。嚴重者可危及生命。
卵巢過度刺激綜合症
1.根據病史和臨床表現。體重增加、口渴、腹部不適、下腹稍腫脹、輕度噁心及嘔吐等。
2.B超示卵巢增大(直徑>5cm),有多個黃體,可見腹腔少量積液。
3.血細胞容積和白細胞升高,低鈉、低蛋白血症。重度OHSS可出現肝功能不全(表現為肝細胞損害)和膽汁淤積、鹼性磷酸酶、谷丙轉氨酶、穀草轉氨酶、膽紅素、肌酸激酶增高。
4.疑診OHSS者應作全血細胞分析、肝腎功能檢查、水電解質測定、盆腔超聲檢查、體重測量、E2水平測定等。
實驗室檢查:疑診OHSS者應作全血細胞分析、肝腎功能檢查、水電解質測定、體重測量、E2水平測定等。監測觀察卵巢對促性腺激素的反應是預防OHSS的重要措施。OHSS可表現為血細胞容積和白細胞升高,低鈉、低蛋白血症。重度OHSS可出現肝功能不全(表現為肝細胞損害)和膽汁淤積、鹼性磷酸酶、谷丙轉氨酶、穀草轉氨酶、膽紅素、肌酸激酶增高,通常於1個月內恢復正常,一些病人的肝活檢可見肝脂肪變性,Kuffer細胞增生。腹水屬滲出液,含較高濃度的蛋白質。
其他輔助檢查:
1.腹部、盆腔超聲檢查可見卵巢增大、卵泡黃素囊腫、輕度者卵巢增大至5~7cm,中度為7~10cm,重度為10cm以上。同時可見腹腔積液。
2.胸部X線檢查胸腔積液或心包積液。
3.重度OHSS可出現肝功能不全,一些病人的肝活檢可見肝脂肪變性,Kuffer細胞增生。
卵巢過度刺激綜合症
重度OHSS者應立即入院治療,糾正低血容量和電解質、酸鹼平衡紊亂是治療OHSS的關鍵,晶體液不能維持體液平衡,應選用白蛋白(50%)、血漿或低分子右旋糖酐,每天記錄液體進、出量及腹圍和體重,也可用中心靜脈壓監測補液。OHSS血栓形成並不多見,有異常表現時,應鼓勵病人活動下肢,必要時使用肝素(5000U,2次/d),避免使用利尿劑。大量腹腔或胸腔積液導致呼吸窘迫者,可在超聲指導下做腹腔穿刺或胸腔穿刺放液(量宜小)。最近研究證實腹腔穿刺放液不僅可迅速緩解癥狀,而且可去除過度刺激卵巢向腹腔內釋放大量AT-2。對嚴重少尿、無尿、高氮質血症、急性腎功能衰竭、嚴重胸水、腹水、電解質紊亂者可行血液透析,不主張穿刺放液。多數病例在黃體中期后,病情可減輕,完全緩解要到下次月經后。妊娠成功者可能病程較長,病情較嚴重。
Koike等報道,用持續性腹水自動輸注系統(continuousautotransfusionsystemofascites,CASA)治療重症OHSS取得良好效果。採用CASA系統,每天給患者行腹水回輸5h,回輸速度100~200ml/h,可有效擴充血容量,避免應用白蛋白,縮短了住院日。
對巨大卵巢囊腫、扭轉或破裂者,應急診剖腹探查,合併多胎妊娠(>2胎)者,應中止妊娠。由於OHSS致死的病例很少,約佔刺激周期數的1/1萬以下,因此,相對來說誘導排卵仍是較安全的。
據報道血管緊張素轉換酶抑製劑(ACEI)對OHSS發展有抑制作用,Morris等觀察到卡托普利(巰甲丙脯酸,Captopril)可減少促排卵者E2和孕酮的產生。在月經周期的卵泡期,卵泡液中的腎素活性明顯增加,應用LH或HCG后,腎素升至峰值(排卵前期),這提示卵泡組織中的腎素-血管緊張素系統處於促性腺激素的調控之下,發生OHSS前、后,病人的血漿血管緊張素轉換酶活性亦明顯升高。由於腎素-血管緊張素系統參與OHSS發生,且與繼發性血流動力學、體液平衡紊亂有關,因此,在臨床上可試用ACEI來防治OHSS。白蛋白可結合和滅活尚未知曉的卵巢因子,且能提高血管內膠體滲透壓。
Lsik等給患者輸注白蛋白10g,結果治療組未見中重度OHSS,而對照組有5例發生OHSS。凍融胚泡移植可預防OHSS的發生,Shaker等則比較了凍融胚泡移植和白蛋白的預防效果,他們將26例高危OHSS病例分成兩組,各13例,A組作凍融胚泡移植,B組在采卵時輸注白蛋白40g,5天後重複1次,然後作新鮮胚泡移植。結果發現輕度OHSS為A組10例,B組9例,兩組均無中、重度OHSS發生。上述資料表明,凍融胚泡移植和白蛋白輸注均有預防OHSS的作用。
OHSS病人的血漿和腹水中的可溶性血管細胞黏附分子-1(solublevascularcelladhesionmolecule-1,SVCAM-1)和可溶性細胞間黏附分子-1(SICAM-1)明顯升高,SVCAM-1和血漿E2呈正相關(HCG刺激期間),SICAM-1和卵子獲得數目之間亦呈正相關,提示這兩種黏附分子的變化在OHSS的發病中起了重要作用,但發生機制有待進一步研究。嚴重OHSS病人血漿γ-球蛋白下降,腹水中的IgG和IgA濃度升高。OHSS病人血漿抗凝血酶Ⅲ活性下降,這可能是大量抗凝血酶Ⅲ滲入腹水所致。
總之,凡使用HCG、HMG、氯米芬等促排卵治療時,均應想到本症發生的可能,應定期測定血E2及採用B超監護,凡可能發生OHSS的高危病人,應停止HCG注射或採用胚泡冷凍,避免用HCG支持黃體功能。
1.肺部併發症:其特點是非肺組織實質性、限制性肺功能障礙,這至少與腹水形成、腹內壓升高、膈肌活動(下降)受限、胸廓擴張受限有關。由於以上原因,使肺擴張不全、肺通氣下降、通氣/血流比值失調,導致通氣障礙性低氧血症。如伴有肺部感染、肺血管的血栓栓塞性病變可導致嚴重的成人呼吸窘迫症和肺功能衰竭。Howat等報道1例輔助體外受孕後患者發生重症ARDS和敗血症,經長期治療,並用氨甲蝶呤(MTX)預防以後可能發生的異位妊娠,獲得成功。
2.胸腔積液、心包積液、膽汁淤積綜合征、深部靜脈血栓形成或動脈懸浮性血栓、良性顱內高壓綜合征、多發性腦梗死(由於高凝狀態腦血管栓塞所致)、假性膽鹼酯酶缺乏症。
卵巢過度刺激綜合症
1.血清E2和卵巢形態學變化可反映卵巢的刺激程度。在刺激的7~8天開始,每天進行B超監測及E2測定。卵巢直徑≥12mm,卵泡數≥20是卵巢過度刺激的閾值指標。超過此閾值OHSS的危險性明顯增加。故在助孕過程中應嚴密監測卵巢的反應,但E2水平應考慮所採用的實驗方法不同而有差異。有人提出血雌激素升高的速度比其絕對水平更能反應卵巢對刺激的敏感性。
2.患有系統性紅斑狼瘡或原發性抗磷脂綜合征(primaryantiphospholipidsyndrome,paps)者,由於本身的高凝狀態,行體外助孕應用促性腺激素GnRH-A等製劑時,更易發生血栓栓塞性病變及其他併發症。給予肝素治療后又易發生骨量減少,妊娠后易併發妊娠中毒症、多胎妊娠、糖尿病,產後易併發腎炎、肋軟骨炎、精神抑鬱,並可使自身免疫性疾病病情惡化。分娩的嬰兒抗磷脂抗體陽性,可出現性早熟、新生兒狼瘡、先天性畸形(如肺動脈狹窄)等。因此,患這些疾病的母親和嬰兒的併發症均明顯高於一般的體外助孕者。
3.Gal等報道,在排卵誘導期用小劑量的酮康唑(Ketoconazole)可降低多囊卵巢病人的卵巢類固醇類激素生成量,可協助控制對卵巢的過度刺激。
預防:
1.防止OHSS發生的重要措施是選擇合適的體外受孕對象,凡有嚴重自身免疫性疾病(如類風濕性關節炎和系統性紅斑狼瘡)、肝功能障礙、嚴重腎臟病變、高凝狀態及既往有血栓栓塞性疾病者不宜接受體外受孕。
2.亦有人主張用小劑量FSH刺激法誘導排卵,尤其是對多囊卵巢患者可明顯降低OHSS及多胎妊娠的發生率。例如,以重組的人FSH(rhFSH)75U/d治療,共用14天,必要時再稍增加劑量,用此法的排卵率與常規方法相當。OHSS伴有肝功能損害時,血清IL-6明顯高於無肝功能損害者,而且體外受孕的成功率明顯下降。
3.根據雌激素水平選擇預防措施:Brinsden等認為,在助孕過程中,可根據雌激素水平採取適當的措施預防OHSS的發生。①血清E2≤10000pmol/L(3000pg/ml),無OHSS表現者可直接作胚胎移植。②E2在5000~10000pmol/L(1500~3000pg/ml)移植胚泡后需作黃體支持時,宜選用黃體酮。③血清E2≥17000pmol/L(5500pg/ml)、總卵泡數≥40者禁用HCG促排卵,此時可繼續使用促性腺激素釋放激素激動劑(GnRHagonist,GnRH-A)抑制卵巢過度刺激反應,待恢復正常大小后再以小劑量促性腺激素刺激卵巢。④血清E2在10000~17000pmol/L(3000~5500pg/ml),卵泡數在20~40的病例,仍可用HCG,但宜採用胚泡冷凍,暫不作新鮮胚泡移植,這樣可避免OHSS惡化。⑤在促排卵過程中,血清E2>1000pg/ml,出現4個以上直徑≥14mm的卵泡時,有多胎妊娠的危險,多胎妊娠易引起OHSS,應盡量避免用HCG促排卵。
在體外受孕(externalfertilization)過程中,OHSS的發生率為1%~10%,促排卵治療的OHSS發生率約4%。山東省立醫院的報道為6.8%。由於該綜合征為醫源性,亦有報道總體發生率約23.3%,其中中、重度發生率1%~2%,2/3發生在受孕周期。1/3發生在非受孕周期。