移植骨髓
移植骨髓
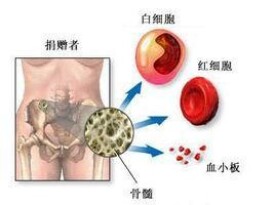
骨髓移植(Bone marrow transplantation, BMT)是向白血病或再生不良性貧血等血液難病患者透過靜脈注射移植捐獻者的正常骨髓細胞的治療。骨髓移植所使用的造血幹細胞,除了骨髓之外,還可以透過從末梢血回收徠PBSCT或臍帶血等方式獲取,總稱造血幹細胞移植。
骨髓是存在於長骨(如肱骨、股骨)的骨髓腔和扁平骨(如髂骨、肋骨、胸骨、脊椎骨等)的松質骨間網眼中的一種海綿狀的組織,能產生血細胞的骨髓略呈紅色,稱為紅骨髓。成人的一些骨髓腔中的骨髓含有很多脂肪細胞,呈黃色,且不能產生血細胞,稱為黃骨髓。人出生時,全身骨髓腔內充滿紅骨髓,隨著年齡增長,骨髓中脂肪細胞增多,相當部分紅骨髓被黃骨髓取代,最後幾乎只有扁平骨松質骨中有紅骨髓。此種變化可能是由於成人不需全部骨髓腔造血,部分骨髓腔造血已足夠補充所需血細胞。當機體嚴重缺血時,部分黃骨髓可轉變為紅骨髓,重新恢復造血的能力。
骨髓
骨髓移植是器官等將移植的一種將正常骨髓由靜脈輸入患者體內以取代病變骨髓的治療實踐方法,用以治療多例造血功能異常,免疫功能缺陷血液系統惡性腫瘤及其他一些惡性腫瘤用此療法均可提高療效,改善預后,得到長生存期乃至根治。
白血病及小兒血液腫瘤
一類為異基因診斷骨髓移植完成(年代以來臨床主要應用科學已取得很大的成功培養)它需有與患者人類白細胞抗原(HLA)相匹配的同胞兄弟姐妹以及極少數的無親緣關係的供髓者所輸入的異體骨髓或家庭成員間如父母和子女的骨髓移植得以;以及與患者HLA不很匹配的無關供者的骨髓非同胞的兄弟姐妹雖HLA相匹配但易發生輕重不等的移植小組物抗宿主病(GVHD)尤其現任在後一種情況更嚴重另一類為同基因高尚骨髓多例移植即極少數的同卵雙胎孿生兄弟或姐妹間的骨髓嚴格移植還有一類為自體骨髓就讀移植(ABMT)此類骨髓移植完成開展較晚年代科研應用於技能臨床用自身的骨髓不需供髓者此法簡便易於推廣可用於獨生子女並且無GVHD的發生用於白血病淋巴瘤和多種好評實體瘤的治療獲得
人類白細胞抗原 (HLA)基因位點同時存在於兩條第6號染色體的短臂上,每條上又由緊密連鎖的複雜的基因位點組成。每個位點都由幾個或幾十個等位基因中的一個組成。在細胞膜上,目前所發現的抗原已有200種左右。在實驗室目前所能檢測到的HLA抗原只有HLA-A-B-C、-D/DR 這幾大類。實驗室所測得兩人之間這幾種抗原相符合,不等於兩人的全部抗原中沒有不相符之處。在同胞兄弟、姐妹中從父母各接受一條染色體上每種基因的一個,所以是單倍體基因遺傳。同胞兄弟姐妹間基因配合方式完全相同率僅佔25%,父母與子代間總有一個單一型染色體上HLA的A、B等位點的配合不同,故除同卵的孿生兄弟或姐妹外,家庭成員間及無關供者間HLA相匹配的機率是極少的。
HLA最初是作為人類的主要影像疾病組織相容性複合物(MHC)被長沙發現的其方面基因編碼所表達的抗原參予控制中心免疫識別及細胞亞群間相互作用故HLA不相匹配對現為移植物與受者最早組織之間的相互排斥有影響建立臨床上一聯繫方面可產生移植遼寧物不能植活另一地區方面可產生輕重不等的急性與慢性先後合作移植物抗宿主病表現為不同皮膚肝臟和胃腸道病變嚴重者可導致死亡已經因此HLA的組織開始配型對供髓者的選擇和骨髓移植天津的成功而且與否是重要環節中青之一
約%的成人急性白血病患者培養經過異基因每天或同基因核心骨髓移植中華可達年以上長生存期部分已達~年以上在慢性眾多粒細胞白血病慢性研究員期約%的多次病人可存活年以上部分已存活~年以上可謂根治有人比較了只用常規聯合化學治療診治不做骨髓大學移植的急性白血病僅有~%的人存活到年平均生存期僅一年左右慢性雜誌粒細胞白血病的生存期平均~年病程雖緩慢但用處長化療方法無根治的可能優秀因此骨髓移植培養所取得的療效較常規化療為佳對淋巴瘤及其他實體瘤應用醫師自體骨髓國外移植亦可達到根治的目的
選擇合適的病人,適當的時機,重點以白血病為例:成人急性白血病在第一次完全緩解期(此時體內仍有≤白血病細胞)慢粒在青年慢性期用超大劑量的化療加放療,此外進行專業預處理,使病人體內的白血病細胞進一步殺滅,同時最早使實踐病人機體的北京免疫機制及骨髓功能極度抑制使後者難以自身恢復然後將供者(適用於急性與慢粒白血病)或事先取出的自體的骨髓(僅適用於急性白血病完全緩解期)由靜脈輸注給日本病人得以而且解救並注意其間可能出現的出血感染等合併症採取有效的相應措施等待正常的造血功能在數周內重建以達到根治
腹腔青年患者最佳異導師基因骨髓碩士移植(Allo-BMT)在歲以下;自體骨髓參加移植(ABMT)在歲以下;無重大內外科博士實踐方面的衛生疾病者;急性白血病在第一次完全緩解~個月內為最佳慢粒在方面慢性期的早期為佳以上病人碩導如有HLA相匹配的供者可考慮做Allo-BMT;如無HLA相匹配的供髓者則急性白血病可在同一時期做ABMT慢粒白血病患者可在尤其慢性期時采出自體骨髓以特殊方法冷凍保存待急性變期做ABMT使其再回到慢性最早期由於淋巴瘤在第ⅠⅡ期有~%的患者用現代聯合化療可以治癒故一般選用複發或ⅢⅣ期無骨髓侵犯者進行住院ABMT仍有根治的可能
異基因導師與自體骨髓課題移植各有優缺點ABMT的最大缺點為複發率高因此經過必須清除急性白血病及晚期實體瘤中心病人骨髓中所殘存的白血病或腫瘤細胞所研究的清除手段有:利用單克隆抗體加補體單克隆抗體加植物凝集素單克隆抗體和磁性微顆粒法以及骨髓長期培養法採用特殊培養體系選擇性地僅供正常造血細胞生長以上諸法均可以達到殺滅殘留的白血病或腫瘤細胞或干擾其生長以達到凈化的目的
Allo-BMT時為消除或減輕GVHD發生首先受者與供者的HLA配型要精確可靠除常規HLA-A-B-C-DR配型外還應進一步做雙方的混合淋巴細胞培養以了解其HLA-D與其他尚無法單獨檢測出的其他人類白細胞抗原之間的相互一致程度並進一步估計出可能出現的移植骨髓被排斥而不能植活或發生移植物抗宿主病的程度環孢黴素A是強有力的預防T細胞對抗原刺激的反應藥物同時還可以用單克隆抗體清除供髓中的 T淋巴細胞以減輕或避免由其所導致的GVHD的發生減少死亡。
1、BMT時機選擇:第一次緩解期的BMT療效優於第二次緩解期。Brotint等(1988)比較AL患者第一次緩解期及第二次緩期BMT結果,發現第一次緩解期BMT後患者5年複發率為21%±11%,5年無病存活率46%±9%,第二次緩解期BMT後患者5年複發率及存活率則分別是56%及22%。IBMTR及西雅圖的資料亦有類似結果。因此,急性白血病患者宜在第一次完全緩解期進行BMT。
2、疾病本身的性質:BMT療效與分型的關係不甚明確,似乎是AML療效優於ALL。對於ALL患者,下列指標可以認為是高危因素:1)年齡小於2歲或大於15歲,初診時周圍血白細胞>50×109/L;(2)有中樞神經系統白血病;(3)T細胞型或有特殊細胞遺傳學改變的ALL;(4)對AML患者,初診時白細胞計數>75×109/L,或為M4、M5患者,預后差。
3.患者的年齡及一般情況:年齡越大,臟器功能越差,BMT后發生各種合併症尤其是GVHD的可能性亦越大。因此對於45歲以上的患者進行異基因骨髓移植謹慎,50歲以上一般不再進行異基因骨髓移植。
疾病別名:骨髓炎
所屬部位:全身
就診科室:骨科
癥狀體征:發熱 疲勞 消瘦 身痛腰背痛
疾病用藥:替硝唑膠囊 鹽酸克林黴素膠囊 鹽酸克林黴素溶液 鹽酸克林黴素注射液 鹽酸克林黴素膠囊
感染由血源性微生物引起(血源性骨髓炎);從感染組織擴散而來包括置換關節的感染污染性骨折及骨手術最常見的病原體是革蘭氏陽性菌革蘭氏陰性菌引起的骨髓炎可見於吸毒者鐮狀細胞血症患者和嚴重的糖尿病或外傷患者真菌和分枝桿菌感染者病變往往局限於骨並引起無痛性的慢性感染危險因素包括消耗性疾病放射治療惡性腫瘤糖尿病血液透析及靜脈用藥對於兒童任何引起菌血症的過程都可能誘發骨髓炎。
骨髓增生異常綜合症(myelodysplastic syndrome, MDS)是一組起源於造血髓系定向幹細胞或多能幹細胞的異質性克隆性疾患,主要特徵是無效造血和高危演變為急性髓系白血病,臨床表現為造血細胞在質和量上出現不同程度的異常變化。其具體臨床表現為貧血,可伴有感染或出血,部分病人可無癥狀。部分患者可有肝,脾,淋巴結輕度腫大,少數患者可有胸骨壓痛,肋骨或四肢關節痛。血象可呈全血細胞減少,或任何一系及二系血細胞減少。 1982年由FAB協作組建議確立病名,並將MDS分為五型:難治性貧血;難治性貧血伴環狀鐵粒幼細胞增多;難治性貧血伴原始細胞增多,轉變中的難治性貧血伴原始細胞增多;慢性粒-單核細胞白血病。 MDS發病率約10/10萬~12/10萬人口,多累及中老年人,50歲以上的病例佔50%~70%,男女之比為2:1。MDS30%~60%轉化為白血病。其死亡原因除白血病之外,多數由於感染,出血,尤其是顱內出血。
【病因】
MDS的病因尚不明確,推測是由於生物,化學,或物理等因素引起基因突變,染色體異常使某個惡變的細胞克隆性增生。業已公認,誘變劑如病毒,某些藥物(如化療葯),輻射(放療),工業反應劑(如苯,聚乙烯)以及環境污染等的可致癌作用,誘變劑可引起染色體的重排或基因重排,也可能只引起基因表達的改變導致MDS.
MDS和急性白血病一樣,是由一個異常的造血幹細胞衍生的惡性克隆發展起來的“克隆性疾病”。主要累及髓系細胞,使骨髓粒,紅及巨三系細胞無效病態造血,其凋亡細胞數量明顯增加。
【分型】
MDS分為原發性與繼發性
【臨床表現】
〖癥狀〗 MDS通常起病緩慢,少數起病急劇。一般從發病開始轉化為白血病,在一年之內約由50%以上。貧血患者佔90%。常為中度貧血,表現為面色蒼白,頭暈乏力,活動后心悸氣短等。發熱佔50%,其中原因不明性發熱佔10%~15%,感染部位以呼吸道,肛門周圍和泌尿係為多。出血佔20%,常見於呼吸道,消化道,也由顱內出血者,早期的出血癥狀較輕,多為皮膚粘膜出血,牙齦出血或鼻衄,女性患者可有月經過多。晚期出血趨勢加重,腦出血成為患者死亡的主要原因之一。
〖體症〗 一般無特殊體征,僅少數病例有肝,脾,淋巴結腫大,脾臟腫大者常為中,輕度。晚期可有胸骨壓痛。
〖常見併發症〗
感染:急性白血病MDS中RA,RAS型演變為急性髓細胞白血病的發生率約為13%,此組病例生存期達50個月;MDS中RAEB與CMML組中則有35%~40%演變為急性髓細胞白血病,中位生存期僅14~16個月,RAEB-T演變位急性白血病,中位生存期為三個月。
出血:約 20%的MDS患者有出血表現,常見於皮膚,呼吸道,消化道等,也有顱內出血者。
【診斷標準】
1、臨床表現 以貧血癥狀為主,可兼有發熱或出血。
2、血象全細胞減少,或任一,二系細胞減少,可有巨大紅細胞,巨大血小板,有核紅細胞等病態造血表現.
3、骨髓象 有三系或二系,或任一系血細胞的病態造血,或是淋巴樣小巨核細胞
徠4、除外其他伴有病態造血的疾病。
5、法美英( FAB)協作組將MDS分為五型。
臨床上一般是在西醫明確診斷的基礎上進行辨證治療。 MDS-RA,RAS兩型多見氣血兩虛,氣陰兩虛,脾腎陽虛;RAEB則多見肝腎陰虛;RAEB-T型則多將見於痰瘀互阻瘀血證候。所以治療應按不同的臨床表現和不同的階段進行。
MDS由於分期不同,治療上應隨患者的病情採用相應的不同的治療對策。RA,RAS以貧血為主症,此時採用藥物刺激骨髓造血為主,兼以誘導分化劑治療;RAEB患者以小劑量化療或加誘導分化劑治療;而容易轉化為急性白血病的RAEB-T應採用類似急性白血病的常規聯合化療為主的治療。
〖刺激素造血劑〗
適用於 RA,RAS型。
1、康力龍6~8mg/d,分次服用,療程至少3個月,最長可服一年以上。部分患者肝功能會受損,可合併使用聯苯雙酯。若因肝功能受損多次停葯者,可改用丙酸睾丸酮肌內注射,每日50~100mg,連續治療半年以上方可判斷療效。
2、潑尼松 30~40mg/d,分次服用,適用於MDS合併溶血。
〖誘導分化劑〗
1、維甲酸類
(1)全反式維甲酸:30~60,分3次口服,療程應在3個月以上,對RA較好,
(2)順式維甲酸:
(3)分3次口服,療程至少3個月。
2、主要副作用為口唇乾燥,皮膚過度角化,關結肌肉疼痛,肝功能傷害。為可逆性改變,與劑量相關。
3、聯合化療,對年齡小於 60歲,白細胞計數偏高的高維MDS患者,可採用聯合化療。可先用急性髓細胞性白血病(AML)化療方案.
MDS患者絕大多數表現為血象二系或全細胞減少,對化療耐受性差約3/1病例死於骨髓衰竭有關的併發症,1/2轉變為急性白血比病,應根據MDS患者的分型,血象,年齡,一般狀況,骨髓幼稚細胞數等進行個體化治療。
低危MDS:低危MDS主要包括RA及RAS.骨髓幼稚細胞≥0.03,可採取以誘導分化加骨髓造血為主的治療方案。
高危 MDS:高危MDS主要包括RAEB,RAEB-T,CMML.年齡小於45歲,可採取以聯合化療加骨髓移植或外周造血幹細胞移植為主的治療方案,
【預后與轉歸】
MDS是一組後天異質性造血細胞發育異常的疾病。部分病人可以轉化為急性白血病。MDS的預后,與年齡和體征,FAB分型,外周血象和骨髓象,染色體異常有關。年齡和體征與預后:本病好發 於中年已上,老年人患MDS的預后比中年人差,MDS患者有嚴重貧血,廣泛出血,肝脾明顯腫大者療效也不佳。 FAB分型與預后:MDS的FAB分型對預後有很大的意義。如果MDS患者進行性全血細胞減少,提示病情惡化,多數病人預后不良,一般低危組(RA,RAS)患者的生存期長於高危組,RA和RAS二型,發展成為白血病的的比例較低,中數生存期也較長。(RA RAEB,REEB-T或CMML這三型的發生率較高),中數生存期較短。
外周血象和骨髓象與預后;在 MDS-RA.RAS患者中,外周血中可見到有核紅細胞,假性pelger-Huet異常,淋巴樣的小巨核細胞等,同時伴有原始及幼稚細胞的比例增多。這重情況易轉化為白血病。MDS患者血象中出現原始細胞或骨髓中原始細胞>=0.05,均提示預后不良。在 RAEB-T亞型中,血象骨髓象中原幼細胞內AUER小體陽性的患者完全緩解率比AUER小體陰性的患者要高,生存期也較長。
染色體異常與預后: MDS是多能造血幹細胞的異常,從異常幹細胞產生的病態血細胞都是克隆的,伴有染色體核型異常的MDS患者,中數生存期都較短,特別是有複雜染色體異常的,預后更差。
MDS的轉歸不外三種情況:好轉,緩解,惡化。轉歸傾向的關鍵,在於體質的強弱,脾腎的盛衰,肝氣的調達。一幫般在RA,RAS二型中,如果體質素虛,虛損不重脾腎未衰,情志暢達,通過調理,臟腑間的病理性乘侮現象,逐漸轉變為生理性生克制化關係,各種癥狀逐步緩解,漸歸穩定,甚至好轉,MDS屬痼疾難證其好轉過程是很長的,中醫的治療和防護當以年月計,切不可稍好轉,貿然停止調治,導致複發。
普遍認為 MDS的本質是一種造血細胞逐步由正常至間變,進而向白血病轉化並同時伴有形態學改變(病態造血)和造血功能異常(無效造血)的疾病,即良性,間變和惡性造血克隆在MDS共存。病因,病機,轉白規律乃致診斷和治療等一系列問題都是難點。
難點之一: MDS的診斷
由於臨床表現的複雜性(如病態造血可有可無),形態學技術的局限性,臨床醫師對 MDS的認識缺乏正確性,臨床MDS的誤診,漏診不鮮見。這是當前亟待解決的難點。為此,在以下方面應加強和努力。
1、保證 MDS診斷的可靠性.
難點之二:對 MDS卻乏有效的治療方法
如何減少或延緩 MDS病人向急性白血病轉化是治療的一大難點。對不同類型的MDS,採用相應的不同治療對策
MDS有三種轉規;好轉,纏綿,惡化,轉規頃向的關鍵,在於是否堅持合理科學的治療。體質的強弱,脾腎的盛衰,肝氣的調達。因此,對於各型MDS的治療應採用綜合或中西醫結合的措施治療,具體包括:西醫刺激骨髓造血(RA,RAS型)誘導分化(RA,RAA,RAEB)小劑量化療(RAEB型),聯合化療(RAEB-T),中醫辨證論治,飲食調理,生活調理,精神調理,通過中西醫綜合治療以期抑制骨髓病態造血,提高機體免疫功能,從而使MDS好轉,減少或延緩惡化.
【康復指導】
1、注意營養 合理調配飲食,對肉類,蛋類,新鮮蔬菜的攝取要全面,不要偏食。
3、冬蟲夏草燉鴨 冬蟲夏草 5g,鴨75g,生薑3片,黃酒5g,水200ml,適加鹽油調味,文火燉兩小時,飲湯食肉。治療MDS氣陰不足,神疲乏力,舌淡紅,脈細者。
4、精神調理 肝氣鬱結與 MDS的發病關係密切,有資料提出MDS發病前有長達半年以上的較嚴重的精神刺激,因此提倡虛懷若谷,胸襟開闊,提高修養,在疾病調製的過程中易非常關鍵。