顱內高壓症
一種臨床上常見的神經系統合併症
顱內高壓症(intracranial hypertension,ICP)是一種臨床上常見的神經系統合併症,許多神經內科、神經外科和非神經系統障礙性疾病,最終都可能以顱內高壓症為主要的表現,是由多種顱內、外疾病引起的顱腔內容物的體積增加並超出顱內壓調節代償範圍的一種常見的臨床綜合征。頭痛、嘔吐和視乳頭水腫稱為顱內壓增高三聯征,為顱內壓增高的典型表現。若病理性、持續性的顱內壓增高,可出現危及病人生命的緊急情況,顱內壓增高危象—腦疝綜合征(簡稱腦疝),死亡率極高,它幾乎涉及所有臨床學科,是急需作出正確判斷及處理的急危重症。
.異顱壓
顱腔密封固、骨構圍繞形空腔,含腦組織、腦脊液和血液。成人後顱骨無法伸縮,因此,顱腔內容物之間稍有變化就會互相影響。正常成人顱腔的內容物約1450ml,其中腦組織約佔1300ml,腦脊液佔65ml(不包括枕大孔以下的腦脊液),血液佔110ml。根據Monrose-Keffie學說,在顱腔內總體容積不變的情況下,各組成成分的任何一種容量的增加都是需要以換取其它兩種成分的減少為代價,或者導致顱內壓的增高為結果。
顱壓隨齡增化,嬰顱壓完。顱壓維持~,超顱壓症。況,顱壓超~需積極治療;顱壓超病非嚴,隨危及患。
2.腦灌注壓
腦部具有自動調節腦壓的功能,以保證正常的腦血流灌注。腦灌注壓(CPP)=平均動脈壓(MAP)-顱內壓(ICP),腦灌注壓在50~150mmHg(1mmHg約等於13.6mmH2O)的範圍內,腦能夠維持正常的腦血流量需求。平均動脈壓的下降,或者顱內壓的增高,都會引起有效腦灌注壓的迅速下降。當腦灌注壓低於50mmHg時,腦的自動調節能力即失去代償,腦血流量隨腦灌注壓的降低而被動下降,腦功能就會遭受到損害。
引起顱內壓增高的原因很多,大致可分為原發性和繼發性兩種。
原發性顱內壓增高
創傷性腦損傷(traumatic brain injury,TBI)包括硬膜外、硬膜下血腫,腦挫傷等等。
腦腫瘤
出血性腦卒中
缺血性腦卒中(包括腦靜脈系統血栓形成)
顱內高壓症
繼發性顱內壓增高
氣道阻塞性疾病
低氧或高碳酸血症
中毒和代謝性疾病
藥物引起的顱內壓增高
子癇
癲癇發作
其他(例如,高原腦水腫,肝臟衰竭等等)
神經外科手術后
佔位病變(血腫)
腦血流量增加(血管擴張)
腦脊液循環障礙
1.頭痛,是顱內高壓最常見的癥狀,顱內壓愈高,頭痛愈明顯,多為瀰漫性鈍痛。疼痛好發於晨起時,常呈待續性或陣發性加重。任何引起顱內壓增高的因素如咳嗽、排便等均可使疼痛加劇。嘔吐或過度換氣可使頭痛減輕。急性顱內壓增高頭痛劇烈,坐立不安,往往伴有噴射性嘔吐。
2.嘔吐,一般與飲食無關,嘔吐前有或無噁心,常呈噴射性,且多伴有劇烈頭痛、頭昏,頭痛劇烈時嘔吐癥狀也較重。
3.視力障礙,表現為一過性黑朦,逐漸發展為視力減退甚至失明。眼底檢查可見視乳頭水腫,靜脈擴張、出血。壓迫時可表現復視,急性顱內高壓可無視乳頭水腫表現.
4.意識障礙,煩躁、淡漠、遲鈍、嗜睡,甚至昏迷。
5.癲癇或肢體強直性發作。
6.生命體征變化,血壓升高,脈搏慢而洪大,呼吸慢而深即庫欣(Cushing)三主征。嚴重顱內壓升高者脈搏可在每分鐘50次以下,呼吸每分鐘l0次左右,收縮壓可達24kPa(l80mmHg)以止,此為腦疝的先兆徵象。
(2)枕骨大孔疝(小腦扁桃體疝),後頸部及枕部疼痛,頸肌強直,強迫頭位嗜睡,意識障礙,大、小使失禁甚至深昏迷,雙側瞳孔散大,對光反射遲鈍或消失,呼吸深慢或突然停止。
顱內高壓症的治療取決於病因、顱內高壓的程度和持續時間,顱內高壓的程度與顱內病變的部位和範圍密切相關。因此,應儘快弄清病因,從根本上解決顱內高壓問題。
顱內高壓症的治療目標是:應將顱內壓至少控制在250~300mmH2O以下;通過維持適宜的平均動脈壓使腦灌注壓達到60mmHg以上,保證腦部的正常功能活動;避免一切能夠加重或促發顱內高壓的不利因素。
1、一般措施,任何原因造成急性顱內高壓症是導致患者死亡的主要原因之一,有條件的情況下應當立即收入ICU積極搶救治療。及時、適量的給予脫水治療,有效的降低顱內壓,使患者平穩渡過急性期,是急性顱內高壓症搶救成功的關鍵。
急性顱內高壓症的患者應絕對卧床休息,抬高床頭位置可降低腦靜脈壓和腦血容量,這是降低顱壓的簡單方法。理想的頭位角度應依據患者顱內壓監測的個體反應而定,頭抬高15~30°是比較安全的,可使顱內壓持續降低。保持顱內靜脈迴流通暢,應避免頭部過高或頸部衣帶過緊、頭部位置不正和患者躁動不安現象,以防顱內壓增高。保持環境安靜、舒適,生命體征不穩者,並密切觀察病情變化。嘔吐時將患者的頭頸保持側位,以防誤吸;保持氣道通暢,防止氣道阻塞、低氧血症和高碳酸血症,並保證血氧飽和度實時監測,及時吸氧。呼吸停止的患者除立刻進行人工呼吸,應迅速進行經口氣管插管,氣管內加壓吸氧,並同時給予脫水劑,還需使用呼吸興奮劑。心跳、呼吸同時停止者除立即進行氣管加壓吸氧,心室內注射鹽酸腎上腺素外,應立即行心外按壓。每日進液量不宜過多,一般控制在2000ml左右,靜脈補液宜用5%葡萄糖液和0.45%氯化鈉混合的低鈉糖鹽水,每日補鈉量控制在5.6g為宜,注意監測水、電解質和酸鹼平衡,正確處理稀釋性低鈉綜合征。合併應激性高血糖時可引起非酮性高滲性高血糖性腦病。
嚴重的高血壓、低鈉血症、貧血和癲癇發作都能引起顱內壓增高,應給予相應的處理。
不是所有的顱內高壓都能表現出來,例如TBI患者伴有昏迷時並不能表現出頭痛、噁心和嘔吐,一些急性顱內高壓症患者的視神經乳頭並無水腫,單純根據臨床表現很難準確判斷,因此,顱內壓監測顯得尤為重要。目前顱內壓監測的方法主要有兩種,經側腦室置管監測顱內壓和經硬膜感測測量顱內壓方法,兩種方法各有優缺點。對重度腦損傷患者應考慮顱內壓監護,以動態觀察顱內壓變化,根據後者的具體情況選擇合適的治療方法,並監測治療效果。顱內壓監護需要較多的人力和物力,即使在有條件的醫院,也應嚴格選擇病例,適時適度的採用這一監測技術。
2、減輕腦水腫,於短時間內由靜脈注入高滲藥物,使血液滲透壓升高,利用血液和腦細胞的壓力差,使腫脹的腦細胞內外水分迅速進入血液,通過尿液排出體外,從而縮小腦組織的體積,達到降低顱內壓目的。

顱內高壓症
滴注甘露醇的繼發作用是由腎臟清除使自由水大量丟失,血清滲透壓升高,細胞內水分轉移到細胞外,引起較持久的細胞內脫水。大量水分進入血液使血黏度降低,腦脊液短暫性增加,又可使血管反射性收縮及腦血容量下降。隨著顱內高壓症時間的延長,在各種因素的作用下,病變區域的血-腦屏障可能逐漸出現功能障礙、通透性增加。另一方面,由於甘露醇分子量較小,很易透過受損的血-腦屏障進入水腫區,反覆使用可在局部蓄積,加重局部血管源性水腫。Kaufmann等給動物連續靜脈滴注甘露醇5次后,發現甘露醇在腦組織內蓄積,尤其是在水腫部分,水腫的腦組織和血漿之間出現了方向相反的滲透壓梯度。過度使用脫水劑可造成腦細胞脫水萎縮,進一步加重神經功能損害,加重病情。反覆用藥可使甘露醇積聚於腦內引起顱內壓反跳性增高,長時間用藥降顱壓效果不佳,尤其是血清滲透壓>320mOsm/kg時,還可加重充血性心力衰竭、循環血量不足、低鉀血症,長期使用后的高滲狀態和急性腎小管壞死等。
如大劑量反覆使用甘露醇,可因甘露醇小分子逸出血管外,使腦水腫惡化,出現明顯的顱內高壓症反跳現象。急性顱內壓反跳如不及早發現和控制可導致腦灌注壓下降,腦血流量不足、腦代謝障礙、腦疝形成。隨時注意停葯後有無反跳現象,不僅能指導用藥,還利於患者預后的判斷,及時採取相應的措施。在顱內壓的監護下,甘露醇的給藥方式,應改為不定時,不定量使用,隨時調整甘露醇的一次用量、間隔時間及滴速。
(2)髓袢利尿劑,此類藥物促進腎臟排尿、排鈉,能抑制腦脊液生成、減輕膠質細胞腫脹、減少細胞外液的鉀離子濃度,增強高滲藥物的降壓作用。常用藥物為呋塞米(速尿),每次20~40mg,靜脈注射,作用較溫和。它與甘露醇有協同作用,可減少後者的用量與延長用藥間歇時間。還可使腦脊液生成減少40%~70%。速尿1~2mg/kg/次靜脈注射后2~5min發生作用,可持續4~8h。呋塞米是顱內高壓症伴有心、肺、腎功能障礙者的首選葯,待尿量增多后再用甘露醇或白蛋白等製劑,以防后二者使血容量增加、心臟負荷過重。亦可與甘油果糖注射液聯合用於有心、腎、肺功能不全的顱內高壓症患者。
(3)膠體脫水劑,如人白蛋白、凍乾血漿、植物蛋白製劑β-七葉皂甙鈉,可單獨或與其他脫水劑聯合應用。
白蛋白與速尿聯合應用,每次應用速尿0.5~1mg/kg,每日2~6次,使患者保持輕度脫水狀態,既可吸收水分進入血管導致腦組織脫水,又可利尿,比單用速尿或甘露醇好。
心功能不全者忌用高滲脫水劑;腎功能衰竭時不宜應用脫水療法;休克者應先提高血壓再用脫水劑;伴低蛋白血症者應先給予白蛋白或濃縮血漿后,再酌情用脫水劑。滲透療法可致心力衰竭或因利尿而血容量突然下降導致休克;可引起電解質紊亂;少數可致血尿、溶血。此外,反覆使用高滲脫水劑可產生全身性高滲透壓。
(4)高張鹽水在國內尚未普及應用,3%~23.4%的高張鹽水也能產生滲透效應,將腦實質間隙的水分通過血腦屏障帶入血管腔內,以達到降低顱內壓的效果。對伴有低血容量和低血壓的顱內高壓症患者更為有益。副作用可引起出血、低鉀血症和高氯性酸中毒。
(5)碳酸酐酶抑製劑對慢性顱內壓增高者,可考慮給予乙醯唑胺口服治療,但長期應用時應合用碳酸氫鈉片。
3、降溫和止痙對發熱的患者應給予退熱藥物或冰毯降溫,因感染引起發熱者應根據致病原合理選擇抗生素治療。
低溫療法可降低腦耗氧量、減少腦血流量、降低顱內壓、減輕腦水腫。因此有效的降溫和止痙(如人工冬眠)也很重要。隨著監控技術的發展,低溫對心臟的副作用也在減少。全身低溫比頭局部低溫能更有效地降低腦部溫度,低溫療法已成為治療重症顱內高壓症的重要手段之一。
目前可供臨床使用的方法為頭顱局部物理降溫聯合人工冬眠療法,可使腦血流量下降、腦體積縮小,不僅可降低高顱壓,還可降低腦代謝率,增加腦組織對缺氧的耐受力。冬眠藥物在靜脈注射時容易誘發低血壓,一旦發生血壓下降,應立即停葯,必要時用升壓藥物。
4、巴比妥類藥物麻醉,僅用於難治性顱內高壓症的患者,可能的作用機制與腦血流量和腦氧代謝降低有關。本類藥物除降低腦代謝率、減少腦容量外,尚可作為自由基清除劑。臨床可選用戊巴比妥或硫噴妥鈉,戊巴比妥負荷劑量為3~10mg/kg,維持量1~4mg/kg/h,用藥期間宜對顱內壓進行監護,情況好轉時即應逐漸減葯。有心血管疾病的患者不宜使用。副作用包括低血壓、低血鉀症、呼吸系統併發症、感染、肝功和腎功異常。
5、激素,腎上腺皮質激素和地塞米松亦有降低顱內壓的作用,前者對血管源性腦水腫療效較好,但不應作為顱內高壓症治療的常規用藥。地塞米松降低顱內壓主要是通過減少血腦屏障的通透性、減少腦脊液生成、穩定溶酶體膜、抗氧自由基及鈣通道阻滯等作用來實現。靜脈注射后12~24h發生作用,持續3d或更久。近年來主張開始應用衝擊劑量,0.5~1mg/kg/次,每6h一次靜脈注射,2~4次病情好轉后,可迅速減至0.1~0.5mg/kg/次。應注意,激素降低顱內壓的作用較高滲脫水劑慢而弱,當原發感染的病原不明或不易控制時要慎用激素。但亦有人認為激素治療腦卒中(特別對細胞毒性腦水腫)無確切療效。2005年完成的CRASH是一項多中心、隨機對照的大規模臨床試驗,入組的TBI患者上萬例,腦腦外傷后48h內給予甲基強的松龍治療能增加患者死亡的危險性(22.3%~25.7%),提出對TBI患者不推薦常規投給激素類藥物治療。對急性腦血管病患者使用激素控制腦水腫也沒有令人信服的循證醫學證據。
6、應用鎮靜止痛藥,適當的應用鎮靜止痛藥物是顱內壓增高症的重要輔助治療手段。鎮靜葯作為控制顱內壓的關鍵性因素常被人們忽略,顱內壓代償功能下降的患者用力屏氣使胸內壓、頸靜脈壓增加即可增加顱內壓,焦慮、恐懼可提高腦代謝率使顱內壓增高,給予鎮靜葯是必要的。苯二氮卓類能使腦氧代謝和腦血流量下降,但對顱內壓影響不大。應選擇對血壓作用最小的鎮靜藥物,還要注意對低血容量的糾正,以防血壓過度降低。異丙酚(propofol)是一種理想的靜脈注射鎮靜葯,其作用時間短,不影響患者的神經系統檢查,還有抗癲癇、清除自由基的作用。
顱內高壓症
8、過度換氣迅速將PCO2降至25~30mmHg,幾分鐘內即可降低顱內壓。用機械輔助呼吸或非插管患者用急救面罩增加通氣次數(16~20次/min)可達到過度換氣,造成呼吸性鹼中毒,使血管收縮及腦血容量減少而降低顱內壓。顱內壓平穩后,應在6~12h內緩慢停止過度換氣,突然終止可引起血管擴張和顱內壓反跳性增高。該法不適用於成人呼吸窘迫綜合征和限制性肺通氣患者。
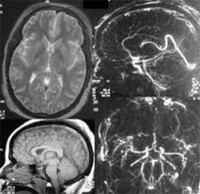
9、手術治療,急性顱內壓增高應做CT或MRI檢查確定血液、腦脊液和水腫組織的病理容積。手術治療方法包括切除顱內佔位性病變、腦脊液引流和顱骨開瓣減壓手術。腦室引流對恢復腦脊液的正常循環具有重要意義,最簡單的手術是腦室持續引流,可直接放出腦脊液,使腦室縮小,達到降顱壓目的。要防止感染,避免引流管堵塞。腦室引流或腦脊液分流術是緩解嚴重顱內高壓症的重要手段。若發生腦疝可酌情行減壓術。要充分運用好去顱骨瓣減壓手術,在內科保守治療失敗的情況,不要忘記這是最好的降顱壓手段之一。
總之,對顱內高壓症的治療,首先考慮藥物治療,必要時再輔以其他治療方法,手術治療只是最後的手段。急性顱內高壓症患者的治療,應個體化,不同情況選擇合適的方法,療程不宜過長,並注意藥物的毒、副作用。顱內高壓症治療期間,宜保持機體在輕度脫水狀態,若生命體征平穩,意識清楚,應逐漸減少脫水劑的用量或停葯。除了脫水劑的使用外,還應注意全身綜合治療,特別是對其他併發症或伴發症的控制。脫水劑治療期間還應監測血漿滲透壓、血漿粘度、血紅蛋白含量、血細胞比容等。如果滲透壓過高,血液濃縮,粘度增加,會加重缺血性腦損傷,使預后惡化,甚至誘發其他重要臟器功能的損害,產生多器官功能障礙等。
顱內壓是指顱腔內容物對顱腔內壁的壓力。腦脊液循環通暢時,通常以側卧位腰段蛛網膜下腔穿刺所測的腦脊液靜水壓力為代表,亦可經顱內監護系統直接測得。正常成人為0.8~1.8kPa(80~180mmH2O),兒童較低。在病理情況下,當顱內壓監護測得的壓力或腰椎穿刺測得的腦脊液壓力超過2kPa(200mmH2O)時,即為顱內壓增高。
診斷顱內壓增高應包括:
(1)是否有顱內高壓:頭痛、嘔吐及視乳頭水腫是臨床確認有顱內壓增高存在的依據,但三主征常不全部具備,尤其是早期患者。
(2)顱內壓增高的程度:根據有無腦幹受累(意識、瞳孔、呼吸等生命體征變化)的表現來推斷顱內壓增高的程度及其嚴重性。
(3)確定引起顱內壓增高的病因:臨床上常先根據患者起病方式、進展速度、生命體征受累情況及視乳頭水腫明顯與否等進行歸類、分型,以縮小導致顱內壓增高疾病譜的範圍,再通過相應的輔助檢查以明確病因。
(4)確定是否有腦疝發生:通常瀰漫性顱內壓增高,耐受程度較強,不易出現腦疝。局灶性顱內壓升高,耐受性差,易導致腦組織移位,出現腦疝,特別是病變進展迅速者,更易導致腦疝形成。
凡可引起顱腔內容體積增加並超出其調節代償範圍的疾病均可導致顱內壓力增高。但顱內佔位病變、顱腦外傷、顱內感染、腦卒中、腦寄生蟲病、顱骨疾病、腦積水、系統疾病的伴發症或併發症、中毒和妊娠高血壓綜合征等是常見原因。其機制包括:腦組織體積增加,顱內佔位性病變,顱內血容量增加,腦脊液增加(腦積水),顱腔狹小等。
顱內壓不斷增高,其自動調節機制失代償,可使部分腦組織受到壓迫從壓力較高向壓力低的地方移位,通過正常生理孔道或非生理孔道而疝出,使腦的重要結構或生命中樞及其相鄰的重要血管和神經受壓,腦脊液循環發生障礙產生相應的癥狀群並常危及生命,即為腦疝綜合征。
根據病因不同,顱內壓增高可分為瀰漫性顱內壓增高和局限性顱內壓增高2類。根據病變發展的快慢不同,顱內壓增高可分為急性型,亞急性型,慢性型和慢性型急性加重型4類。顱內高壓症的分期如下:
(1)代償期:顱腔內容雖有增加,但並未超過代償容積,顱內壓可保持正常,臨床上也不會出現顱壓增高的癥狀 。
(2)早期:病變繼續發展,顱內容增加超過顱腔代償容積,逐漸出現顱壓增高的表現,如頭痛、嘔吐等。此期顱壓不超過體動脈壓的1/3,約在15~35mmHg範圍內,腦組織輕度缺血缺氧,預后良好。
(3)高峰期病變進一步發展,腦組織有較嚴重的缺血缺氧。病人出現明顯的顱內壓增高“三聯症”。此期的顱內壓可達到平均體動脈壓的一半,血流量也僅為正常的1/2。PaCO2多在50mmHg以上,腦血管自動調節反應喪失,往往迅速出現腦幹功能衰竭。
(4)衰竭期:病情已至晚期。此時顱內壓高達平均體動脈壓水平,腦灌注壓<20mmHg,甚至等於零,腦組織幾乎無血液灌流,腦細胞活動停止,腦電圖呈水平線,即使搶救,預后也極為惡劣。
